基于3T-MR圖像淚腺定量測量在Graves眼病診斷及分期中的價值
胡昊,許曉泉,吳飛云,陳歡歡,蘇國義,沈杰,洪迅寧,施海彬
Graves眼病是成年人常見的眼眶疾病,屬于自身免疫性眼病,多為雙眼患病[1]。Graves眼病早期即可出現眼部不適癥狀,如畏光、流淚、異物感和燒灼感等。既往認為其主要與瞼裂增寬、眼球突出度增加導致淚液蒸發加速,滲透壓增高有關[2-3]。近年有文獻報道,淚腺受累導致分泌功能下降,也是Graves眼病患者早期出現癥狀的重要原因[4-5]。雖然淚腺受累的具體機制尚不明確,但部分研究者基于正常淚腺腺泡細胞表面同樣表達促甲狀腺素受體(thyroid stimulating hormone receptor,TSHR)[5],提出淚腺受累與球后組織受累的病理生理改變相似,均表現為淋巴細胞多灶性浸潤和脂肪組織增生[6-7]。據此,部分研究者嘗試從淚腺的角度來研究Graves眼病的臨床及相關影像學特點。
以往有研究中基于CT圖像分析,發現Graves眼病患者的淚腺定量測量值與正常組之間有明顯差異,可輔助Graves眼病的臨床診斷[8-9]。但CT軟組織分辨力欠佳,且有電離輻射,在眼科影像學檢查中已逐步被MRI所取代。此外,準確判斷Graves眼病的臨床分期對指導臨床制訂治療方案有重要意義。眼外肌的MRI定量測量,尤其是眼外肌/顳肌信號強度比可指導臨床對Graves眼病進行準確分期[10-11],但基于淚腺的MRI定量測量能否輔助判斷分期,目前相關報道尚不多見。因此,本研究基于3T-MR圖像對Graves眼病組及正常對照組的淚腺結構進行定量測量,旨在探討淚腺定量測量在Graves眼病的診斷及臨床分期中的價值。
材料與方法
1.臨床資料
回顧性分析2013年6月-2014年12月在本院首次臨床診斷為Graves眼病的33例患者的臨床及影像學資料。接受過激素治療、局部放療或手術治療的患者不納入本研究中。患者平均年齡(48.4±13.9)歲,男12例,女21例,均為雙眼患病,病程1個月~2年,平均(7±6)個月。Graves眼病的診斷和分期參考歐洲Graves眼病研究組(European Group on Graves'ophthalmopathy,EUGOGO)診斷標準[12],結合患者病史、眼部癥狀以及血清學指標(FT3、FT4、TRAb等)。臨床活動性評分(clinical active score,CAS)的主要觀察指標:①自發性的眼球后疼痛;②眼球運動時伴有疼痛;③眼瞼充血;④眼瞼水腫;⑤球結膜充血;⑥球結膜水腫;⑦眼阜水腫。本研究以單眼為單位進行CAS,患眼臨床表現符合以上任一指標記1分,定義CAS≥3分為Graves眼病活動期。Graves眼病組33例共66眼,其中活動期26眼,平均CAS為(4±1)分,非活動期40眼,平均CAS為(1±1)分。同期搜集24例無任何眼科疾病史的健康志愿者的眼眶MRI資料作為對照組(healthy control,HC),年齡(50.0±12.9)歲,男8例,女16例。本研究經本院倫理委員會批準,所有患者及志愿者簽署了知情同意書。
2.MRI檢查技術
使用Siemens Magneto m Trio 3TMR掃描儀及頭顱12通道相控陣線圈。掃描序列及參數:脂肪抑制(fat suppression,FS)T2WI序列,常規行眼眶橫軸面(TR 4000ms,TE 79ms)、冠狀面(TR 3800ms,TE 79ms)和斜矢狀面(TR 3500ms,TE 79ms)掃 描;T1WI序列,常規行眼眶橫軸面掃描(TR 600ms,TE 10ms);掃描層厚3mm,層間距0mm,視野20cm×20cm,掃描矩陣384×384;橫軸面掃描的定位線平行于聽眥線,冠狀面掃描定位線垂直于硬腭,斜矢狀面掃描的定位線平行于視神經長軸。
3.圖像分析
因淚腺眶部及瞼部在影像上不易區分,故研究中合并測量[13-14]。淚腺定量測量參數:橫軸面和冠狀面圖像上淚腺的長徑、短徑和截面積。參考Huang等[14]的研究,基于橫軸面FS T2WI,選擇淚腺顯示最大的層面,測量淚腺最前緣至最后緣的距離為橫軸面長徑,垂直于橫軸面長徑,測量最內側緣至最外側緣的距離為橫軸面短徑,手動勾畫該層面淚腺邊界獲得橫軸面最大截面積(圖1)。同理,在冠狀面FS T2WI上測量淚腺最上緣至最下緣的距離為冠狀面長徑,垂直于冠狀面長徑、測量最內側緣至最外側緣的距離為冠狀面短徑,并計算冠狀面最大截面積(圖2)。淚腺體積的測量采用面積求和法,基于橫軸面FS T2WI,逐層手動勾畫淚腺邊界,取各層面淚腺截面積之和與層厚相乘,獲得淚腺體積。淚腺與同側顳肌的信號強度比(signal intensity ratio,SIR),基于橫軸面FS T2WI,采用ROI(region of interest,ROI)法分別測量淚腺最高T2信號強度及同側顳肌的信號強度,取兩者比值作為淚腺/顳肌SIR。ROI大小取測量層面淚腺截面積的10%~15%[10](圖1)。所有定量參數均由兩位從事頭頸部影像診斷的醫師獨立測量,取兩者測值的平均值進行統計分析。
4.統計分析
使用SPSS 17.0軟件軟件包進行統計學分析。分別采用t檢驗和卡方檢驗對病例組與對照組的年齡及性別構成進行比較。采用組內相關系數(intra-class correlation coefficient,ICC)對兩位醫師測量的各項淚腺定量參數進行一致性評價。淚腺各定量參數的組間比較采用t檢驗或Mann-Whitney U檢驗。采用受試者工作特征曲線(ROC)分析組間比較有差異的淚腺定量參數在判斷Graves眼病活動期與非活動期中的診斷效能。曲線下面積(area under the curve,AUC)為0.8~0.9為診斷效能佳,0.7~0.8為良好[15]。以P<0.05為差異有統計學意義。
結 果
患者組與對照組的年齡和性別構成比的差異均無統計學意義(P>0.05)。兩位醫師測量的各項淚腺定量參數的一致性均很好(ICC>0.900)。除冠狀面長徑外,患者組的各項淚腺定量參數值均明顯大于對照組(表1),差異有統計學意義(P<0.05)。其中,橫軸面及冠狀面短徑對Graves眼病的診斷效能最優(AUC=0.853、0.810)。淚腺各定量參數值對Graves眼病診斷效能的計算結果見表2。
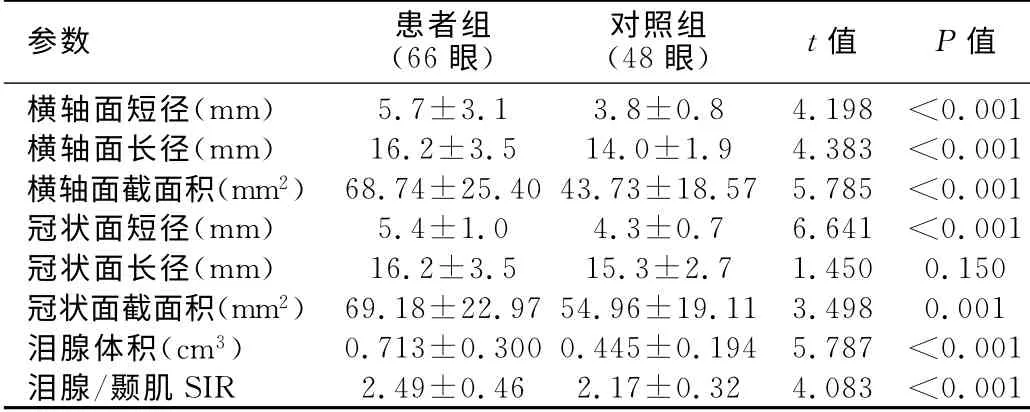
表1 病例組與對照組淚腺各定量參數值比較
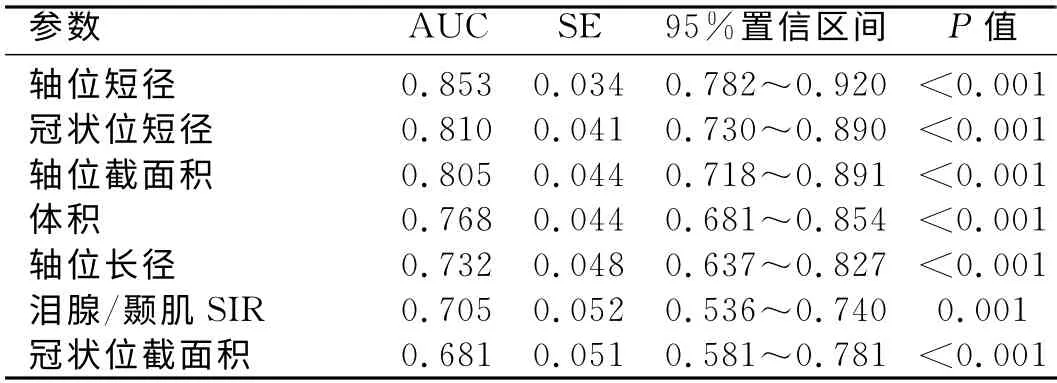
表2 淚腺各定量參數診斷Graves眼病的效能
Graves眼病活動組與非活動組間各定量參數值的測量結果及比較見表3。兩組間僅淚腺/顳肌SIR的差異有統計學意義(P=0.001)。以淚腺/顳肌SIR≥2.57作為閾值來指導分期,可獲得最優的診斷效能(AUC=0.711,敏感度57.7%,特異度77.5%)。

表3 病例組非活動期組與活動期組淚腺各定量參數值比較
討 論
既往有研究結果顯示健康人群中左右側淚腺的定量參數無明顯差異[13],故本研究中將對照組中左右眼的測量結果合并進行分析。除冠狀面長徑外,Graves眼病組淚腺各項定量測量參數值均明顯大于對照組,與以往的研究結果基本一致[8,9,14],提示淚腺定量測量對Graves眼病的診斷有一定輔助價值。進一步分析結果顯示,橫軸面及冠狀面短徑在Graves眼病組與對照組之間的差異更大,輔助診斷GO的效能更優。分析原因可能與Graves眼病引起的淚腺增大常以橫向增大為主有關[14]。此外,本研究結果顯示Graves眼病組淚腺/顳肌SIR明顯大于對照組,但其對Graves眼病的診斷效能略低于橫軸面及冠狀面各徑線值。
在本研究中,非活動期患者淚腺橫軸面短徑[(6.1±3.8)mm]與活動期組[(5.1±1.1)mm]間無明顯差異(P=0.194),但較對照組[(3.8±0.8)mm]明顯增大(P<0.001)。非活動期患者的淚腺/顳肌SIR較對照組稍高(分別為2.34±0.36和2.17±0.32,P=0.025),較活動期組(2.72±0.51)明顯降低(P=0.001)。上述結果說明,處于非活動期的患者與活動期患者相比,主要表現為淚腺/顳肌SIR下降,而淚腺徑線值無明顯差異。由于患者組中同時包含了活動期及非活動期患者,因此在鑒別患者組與對照組時,以淚腺徑線值的診斷效能更高。
Graves眼病活動期與非活動期組間比較顯示,淚腺/顳肌SIR是唯一有顯著差異的定量參數。既往曾有研究認為,活動期及非活動期組間淚腺徑線測量值有明顯差異[14],與本研究結果不同,筆者認為可能與該研究的樣本量較小有關。本研究結果顯示,以淚腺/顳肌SIR≥2.57作為診斷閾值,可獲得最優的臨床分期價值。結合Graves眼病累及淚腺的可能機制,筆者推測出現這一結果的可能原因:在活動期,淚腺組織炎性細胞浸潤、成纖維細胞增生、組織水腫,在FS T2WI上可見淚腺腫大、信號增高[16];而在非活動期,淚腺組織主要病理改變為纖維化、黏多糖沉積及脂肪細胞增生浸潤,在FS T2WI上可見腺體增大、信號強度降低[17]。與淚腺徑線值測量比較,淚腺/顳肌SIR更能反映疾病的病理生理改變,因而對Graves眼病的分期診斷價值更佳。但考慮到本研究中樣本量的局限性,未來還需要基于更大樣本量進行研究,來驗證本研究結果并確定更精確的診斷閾值。

圖1 橫軸面FS T2WI示淚腺橫軸面長徑、短徑、截面積及淚腺/顳肌SIR測量方法。選擇淚腺顯示最大的層面,測量淚腺最前緣至最后緣的距離為橫軸面長徑(DL),垂直于橫軸面長徑、最內側緣至最外側緣的距離為橫軸面短徑(DW),手動勾畫該層面淚腺邊界獲得橫軸面最大截面積(Area)。在淚腺(面積約為該層面淚腺截面積的10%~15%)和顳肌勾畫ROI,測量信號強度,取兩者比值作為淚腺/顳肌SIR。
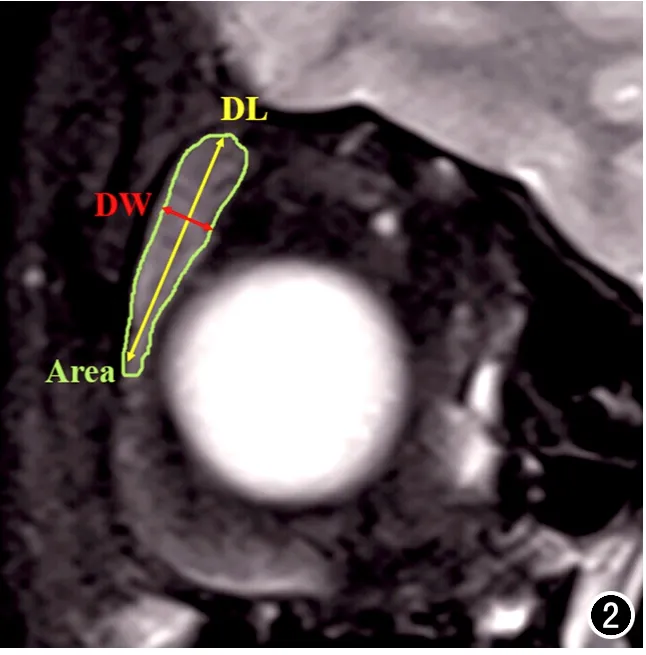
圖2 冠狀面FS T2WI示淚腺冠狀面長徑、短徑、截面積。選擇淚腺顯示最大的層面,測量淚腺最上緣至最下緣的距離為冠狀面長徑(DL),垂直于冠狀面長徑、內側緣至最外側緣的距離為冠狀面短徑(DW),手動勾畫該層面淚腺邊界獲得冠狀面最大截面積。
本研究中定量參數的選擇參考國內外多個研究,以臨床工作中測量方便作為選擇原則[8,9,13,14]。測量淚腺長徑、短徑及截面積均選取淚腺顯示最大的層面,淚腺體積采用面積求和法測量,簡便可靠。另外,本研究采用局部ROI法(ROI面積約為淚腺截面積的10%~15%)測量和計算淚腺/顳肌SIR,與Mayer等[10]進行眼外肌SIR測量的方法相似。雖然采用整體ROI法(ROI包括整個淚腺)測量的可重復性更高,但影像學上可觀察到Graves眼病尤其是活動期患者的眼外肌或淚腺呈不均勻改變[17],因此筆者認為局部ROI法更能反映淚腺SIR的"熱點",診斷價值更大。
本研究尚存在一些不足之處。首先,本研究僅回顧性分析了Graves眼病患者的臨床及影像學資料,未將影像學改變與淚腺分泌功能及淚液成分變化等進行對照分析;其次,本研究的樣本量有限。綜上所述,基于MR圖像進行淚腺定量測量可以輔助Graves眼病的臨床診斷和分期,為指導臨床治療提供依據。
[1]吳中耀,宋國祥.重視我國甲狀腺相關眼病的基礎與臨床研究[J].中華眼科雜志,2005,41(9):769-771.
[2]Gilbard JP,Farris RL.Ocular surface drying and tear film osmolarity in thyroid eye disease[J].Acta Ophthalmol(Copenh),1983,61(1):108-116.
[3]Khurana AK,Sunder S,Ahluwalia BK,et al.Tear film profile in Graves'ophthalmopathy[J].Acta Ophthalmol(Copenh),1992,70(3):346-349.
[4]Chang TC,Huang KM,Chang TJ,et al.Correlation of orbital computed tomography and antibodies in patients with hyperthyroid Graves'disease[J].Clin Endocrinol,1990,32(5):551-558.
[5]Eckstein AK,Finkenrath A,Heiligenhaus A,et al.Dry eye syndrome in thyroid-associated ophthalmopathy:lacrimal expression of TSH receptor suggests involvement of TSHR-specific autoantibodies[J].Acta Ophthalmol,2004,82(3):291-297.
[6]黑硯,康莉,李月月,等.甲狀腺相關眼病眼眶組織的病理改變[J].中華眼科雜志,2008,44(5):423-426.
[7]Jacobson DH,Gorman CA.Endocrine ophthalmopathy:current ideas concerning etiology,pathogenesis,and treatment[J].Endocr Rev,1984,5(2):200-220.
[8]Harris MA,Realini T,Hogg JP,et al.CT dimensions of the lacrimal gland in Graves orbitopathy[J].Ophthal Plast Reconstr Surg,2012,28(1):69-72.
[9]Bingham CM,Harris MA,Realini T,et al.Calculated computed tomography volumes of lacrimal glands and comparison to clinical findings in patients with thyroid eye disease[J].Ophthal Plast Reconstr Surg,2014,30(2):116-118.
[10]Mayer EJ,Fox DL,Herdman G,et al.Signal intensity,clinical activity and cross-sectional areas on MRI scans in thyroid eye disease[J].Eur J Radiol,2005,56(1):20-24.
[11]Rodríguez-González N,Pérez-Rico C,López-Para Giménez R,et al.Short-tau inversion-recovery(STIR)sequence magnetic resonance imaging evaluation of orbital structures in Graves'orbitopathy[J].Arch Soc Esp Oftalmol,2011,86(11):351-357.
[12]European Group on Graves'Orbitopathy(EUGOGO),Wiersinga WM,Perros P,et al.Clinical assessment of patients with Graves'orbitopathy:the European Group on Graves'Orbitopathy recommendations to generalists,specialists and clinical researchers[J].Eur J Endocrinol,2006,155(3):387-389.
[13]Tamboli DA,Harris MA,Hogg JP,et al.Computed tomography dimensions of the lacrimal gland in normal caucasian orbits[J].Ophthal Plast Reconstr Surg,2011,27(6):453-456.
[14]Huang D,Luo Q,Yang H,et al.Changes of lacrimal gland and tear inflammatory cytokines in thyroid-associated ophthalmopathy[J].Invest Ophthalmol Vis Sci,2014,55(8):4935-4943.
[15]El Khouli RH,Macura KJ,Barker PB,et al.Relationship of temporal resolution to diagnostic performance for dynamic contrast enhanced MRI of the breast[J].J Magn Reson Imaging,2009,30(5):999-1004.
[16]Tortora F,Prudente M,Cirillo M,et al.Diagnostic accuracy of short-time inversion recovery sequence in Graves'ophthalmopathy before and after prednisone treatment[J].Neuroradiol,2014,56(5):353-361.
[17]Bhatti MT,Dutton JJ.Thyroid eye disease:therapy in the active phase[J].J Neuroophthalmol,2014,34(2):186-197.

