鹽酸介質中APPB對A3鋼的緩蝕作用
蘇鐵軍,李克華,羅運柏,習 偉
(1.長江大學 工程技術學院,荊州434020;2.長江大學 化學與環境工程學院,荊州434023;3.武漢大學 化學與分子科學學院,武漢430072)
苯并咪唑衍生物熱穩定性好,無特殊刺激性氣味,毒性較小,其結構包括苯并咪唑母體環、苯并咪唑環上與N成鍵的1位取代基或與C成鍵的2位取代基[1]。許多研究表明,苯并咪唑衍生物能對酸液中的金屬起到緩蝕作用。目前,這些工作主要是針對2位取代的苯并咪唑衍生物來研究其緩蝕作用[1-4]。本工作對利用胺甲基化改性得到的一種1位取代苯并咪唑:1-(1-苯胺基-3-苯基-2-丙烯基)-2,3-二氫苯并咪唑(APPB,見圖1),采用失重法、動電位極化法和電化學阻抗法考察了鹽酸濃度、介質溫度和緩蝕劑濃度對APPB緩蝕作用的影響,討論了APPB對鹽酸中A3鋼的腐蝕動力學行為及其與A3鋼表面的吸附行為。

圖1 APPB的分子結構Fig.1 Molecular structrue of APPB
1 試驗
1.1 失重試驗
按SY 5405-1996《酸化用緩蝕劑性能試驗方法及評價指標》中的要求,配制一定濃度的鹽酸,將A3鋼片依次用400、800、1200目砂紙打磨,再依次用乙醇、丙酮洗凈,晾干,放入干燥器保存。在酸液中加入APPB,恒溫4h,測定A3鋼片在鹽酸中的損失質量,然后按式(1)和式(2)分別計算腐蝕速率和緩蝕率。

式中:v為腐蝕速率(g·m-2·h-1),W0和W分別為腐蝕前和腐蝕后的A3鋼片質量(g),S為掛片表面積(m-2),t為腐蝕時間(h)。
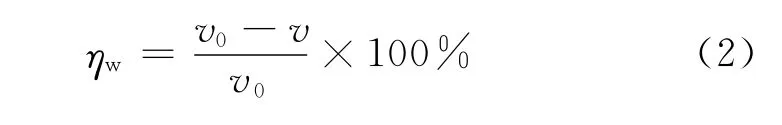
式中:ηw為緩蝕率,v0和v分別為未加APPB及加入APPB后的腐蝕速率。
1.2 電化學測試
在A3鋼片表面用AB膠涂抹均勻,依次用400、800、1200目砂紙將工作面打磨光亮,再用乙醇和丙酮洗凈,干燥器保存。所用儀器為CHI660E電化學工作站,測試時,采用三電極體系,AB膠包裹的A3鋼片作為工作電極,鉑盤電極為輔助電極,飽和甘汞電極作為參比電極。極化曲線測量的電位掃描范圍為-0.8~-0.2V,掃描速率為0.5mV·s-1。腐蝕電位、腐蝕電流、陰極和陽極的塔菲爾斜率均由儀器自帶軟件擬合得到,電化學阻抗譜測試的頻率范圍為0.1Hz~10kHz,交流激勵信號幅值為5mV。
為了進一步判斷APPB對A3鋼片極化行為的影響,計算了緩蝕劑作用系數。在相應腐蝕電位下,緩蝕劑的陰極和陽極作用系數由式(3)、(4)計算[5]:
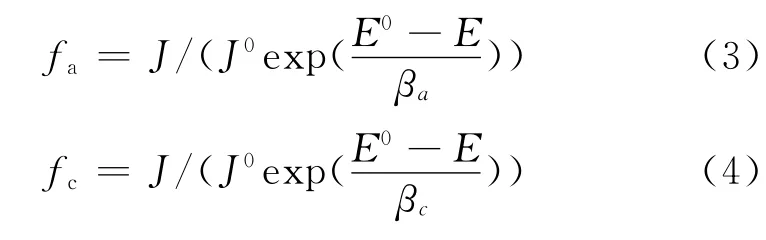
式中:fa和fc分別為緩蝕劑對電化學反應的陽極作用系數和陰極作用系數,J和E分別為加入緩蝕劑后的腐蝕電流密度和腐蝕電位,J0和E0分別為未加緩蝕劑時的腐蝕電流密度和腐蝕電位,βa和βc分別為用自然對數表示的塔菲爾斜率。當緩蝕劑的作用系數fj(j=a,c)<1時,說明緩蝕劑在該電位下對電極反應是起抑制作用的,若fj越小,說明對電極反應的抑制作用越強,緩蝕效果越好。當緩蝕劑的作用系數fj(j=a,c)>1時,則表明緩蝕劑對電極反應起促進作用,會加速腐蝕的發生[5]。
1.3 接觸角測定
將A3鋼片按前述方法進行打磨、洗凈和干燥后,浸入不加APPB和加入一定濃度APPB的鹽酸溶液中,4h后取出,洗凈,烘干。用JC2000D測量儀(上海中晨)測定水滴與鋼片表面的接觸角。
2 結果與討論
2.1 鹽酸濃度對APPB緩蝕作用的影響
在溫度為300K,5%~25%濃度的鹽酸中,采用失重法和極化曲線法考察了APPB對A3鋼的緩蝕性能,試驗結果分別見表1和圖2,擬合得到的極化曲線參數列于表2。
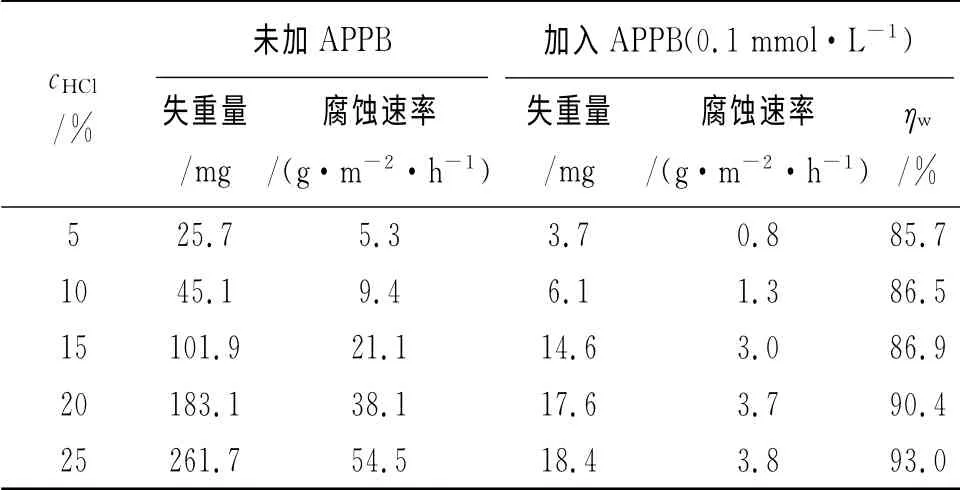
表1 不同鹽酸濃度下的失重法測試結果(300K)Tab.1 Results of weight loss in various concentrations of HCl solution with or without APPB(300K)
從表1可見,在相同的酸液濃度條件下,與空白酸液相比,加入APPB后,鋼片的腐蝕速率都有明顯降低。隨著酸液濃度的上升,無論是未加還是加入APPB,腐蝕速率均有增大的趨勢。但由于加入APPB后腐蝕速率隨酸液濃度上升而增大的幅度要小于未加APPB的增大幅度,緩蝕率并未隨之下降,相反還有所增加。
從表2可見,在不同濃度的酸液中,加入APPB后的腐蝕電流均小于相同酸液濃度時未加APPB的腐蝕電流,表明APPB抑制了電極反應的發生。緩蝕劑的陽極作用系數fa和陰極作用系數fc均小于0.2,表明APPB對陰極和陽極反應均有較強的抑制作用。隨著鹽酸濃度的增加,無論是未加APPB,還是加入APPB(0.1mmol·L-1),腐蝕電流均隨酸液濃度的升高而增大。但是二者增大的幅度有明顯的差異:未加APPB時,當鹽酸濃度從5%增加到25%時,腐蝕電流 增長了27倍;加入APPB后,同樣條件下,腐蝕電流僅增長17倍。可見,與未加APPB的相比,在酸液中加入0.1mmol·L-1緩蝕劑APPB后,腐蝕電流增大的趨勢明顯放緩,這與失重法試驗所得到的腐蝕速率隨酸濃度增加的變化趨勢是一致的,其原因可能是較低的pH有利于含有苯并咪唑基團的APPB與A3鋼表面發生供質子的化學吸附[6]。
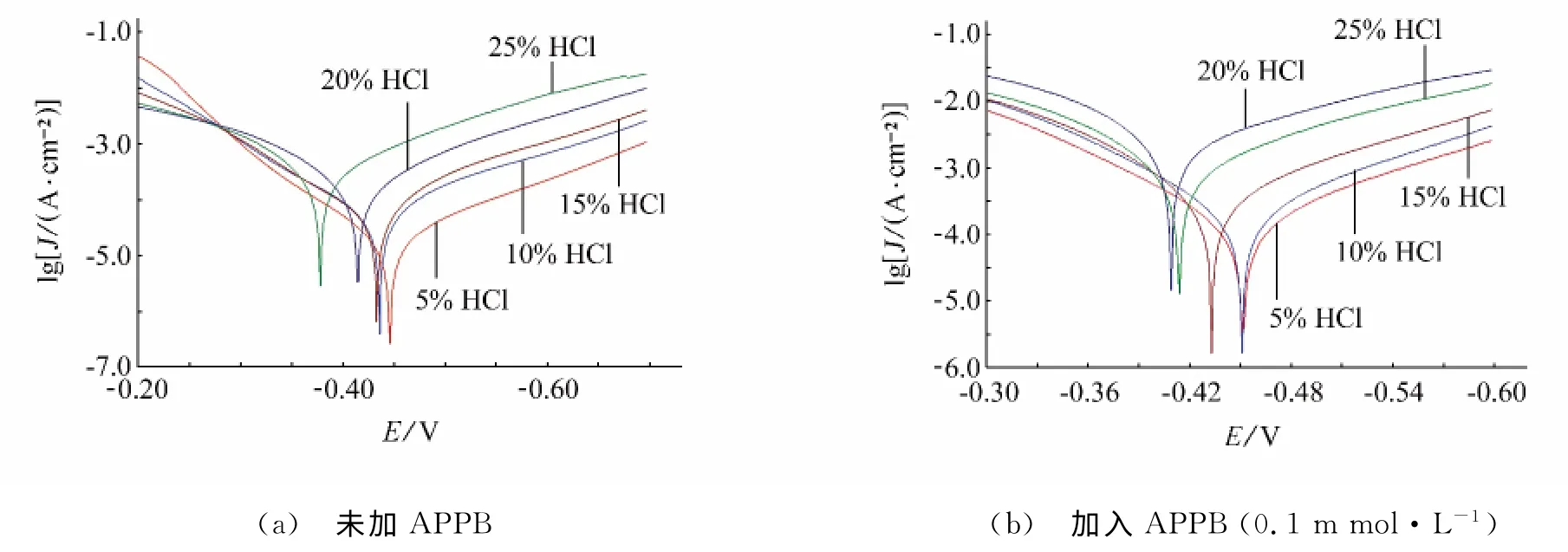
圖2 不同鹽酸濃度下對A3鋼的極化曲線Fig.2 Polarization curves for A3steel in different concentrations of HCl solution(a) blank (b) 0.1mmol·L-1 APPB
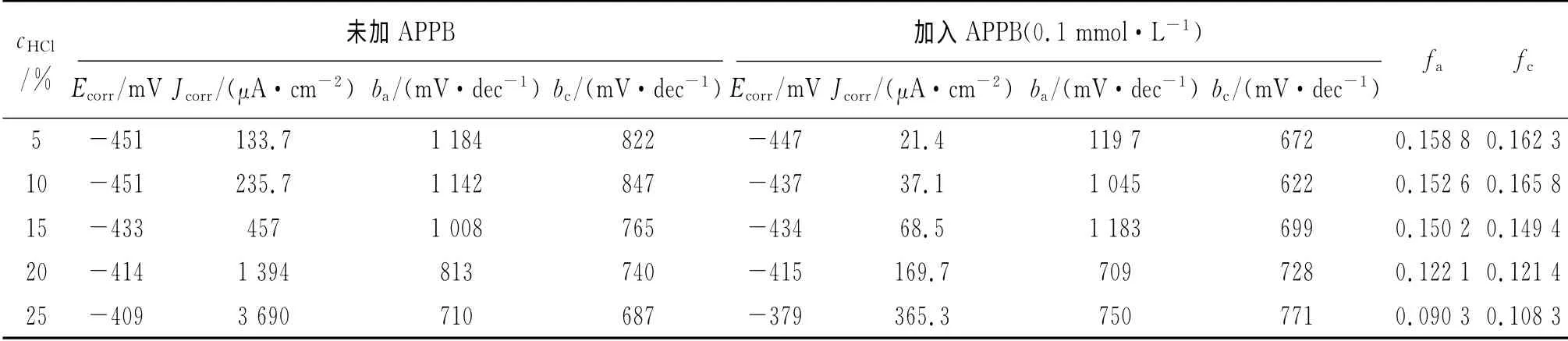
表2 不同鹽酸濃度下極化曲線參數(300K)Tab.2 Polarization parameters in HCl solutions with different concentrations(300K)
2.2 介質溫度對緩蝕作用的影響及動力學分析
在APPB為0.15mmol·L-1的15%鹽酸中,用失重法和極化曲線法考察了300、305、310、325K時的緩蝕情況,結果見表3和圖3,擬合得到的極化曲線參數見表4。
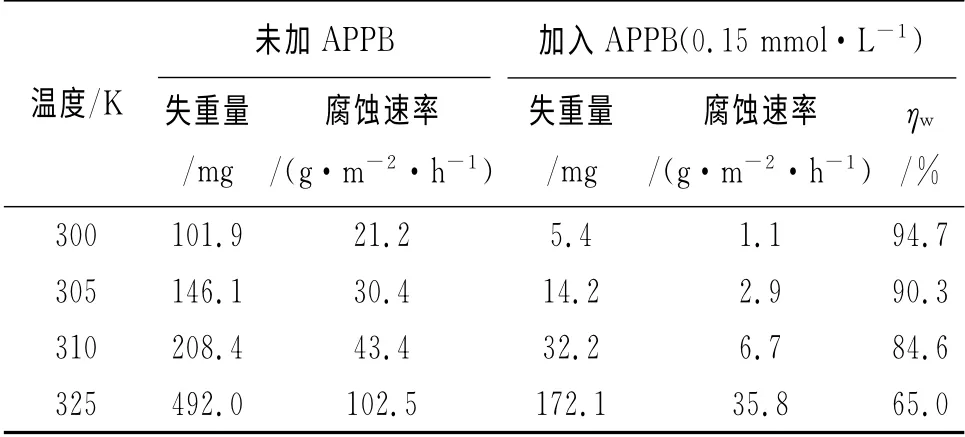
表3 不同溫度下的失重法測試結果(15%HCl,0.15mmol·Lˉ1 APPB)Tab.3 Results of weight loss at various temperatures(15%HCl,0.15mmol·L-1 APPB)
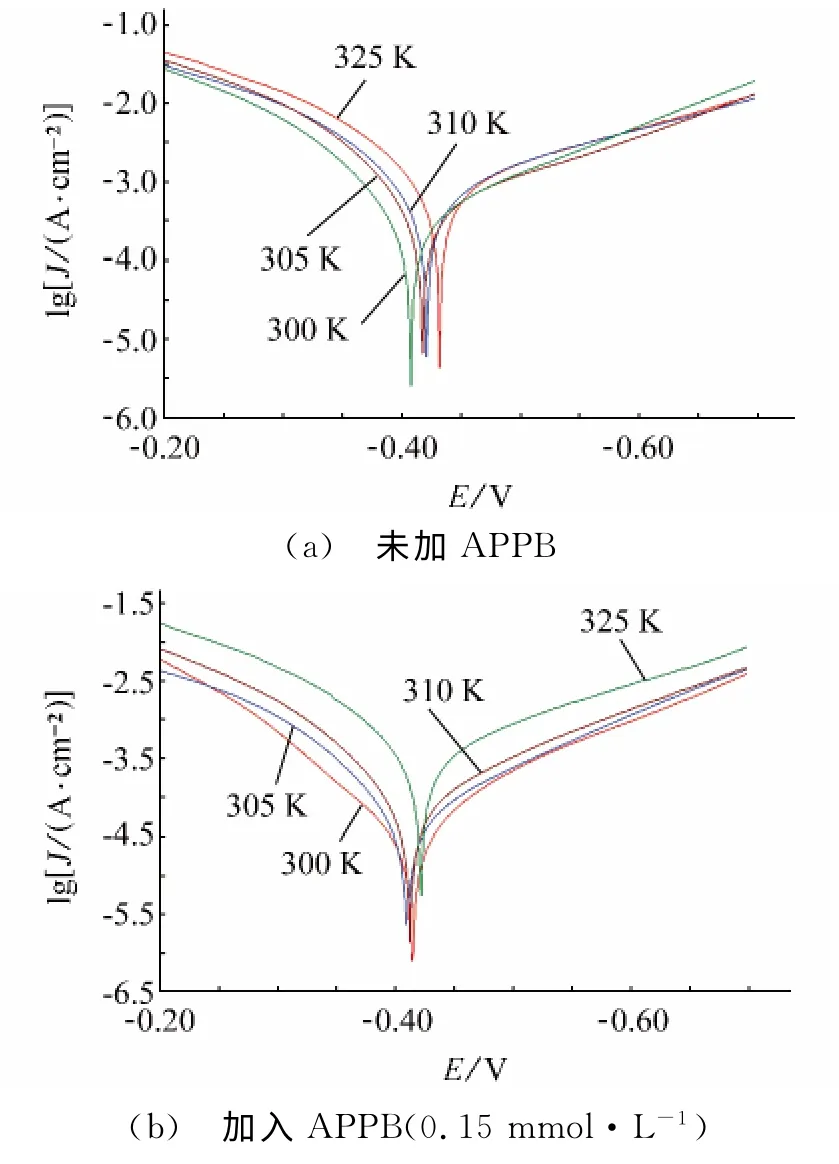
圖3 不同溫度條件下的極化曲線Fig.3 Polarization curves for A3steel at different temperatures(a) blank (b) 0.15mmol·L-1 APPB
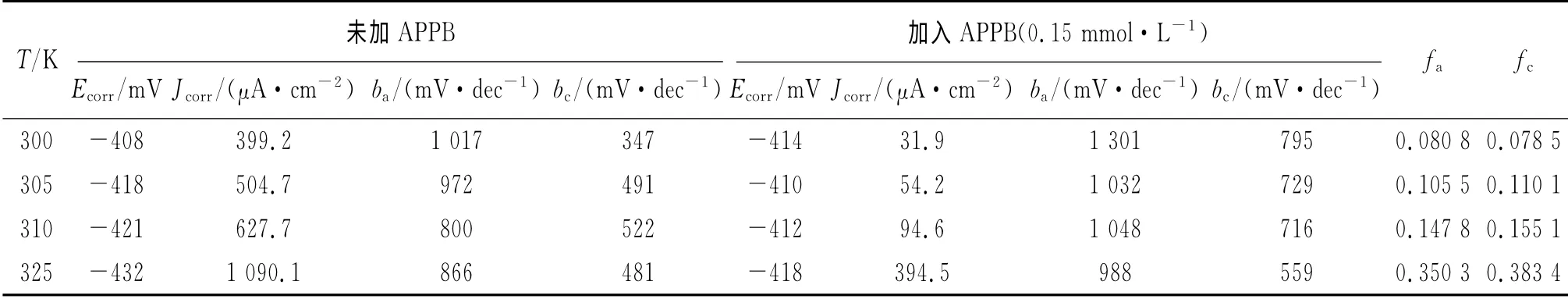
表4 不同溫度條件下的極化曲線參數Tab.4 Polarization parameters at different temperatures
從表3可見,隨著溫度的升高,腐蝕速率上升,緩蝕率下降,原因是升高的溫度削弱了APPB在A3鋼表面的吸附作用。從表4來看,腐蝕電流密度隨著溫度升高而增大,而且陰極和陽極的緩蝕作用系數也隨之遞增,這表明APPB是一種溫控型的緩蝕劑,溫度的升高將會降低APPB的緩蝕效果。這與表3中失重法所得到的緩蝕率隨溫度升高而降低的變化趨勢相吻合。
通常可將腐蝕過程視為一個Arrhenius過程[7],又因為腐蝕速率與電流密度成正比[8],所以可用式(5)來計算腐蝕反應的活化能:
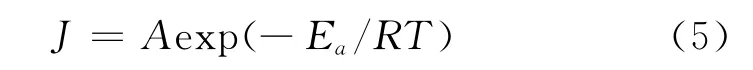
式中:J為腐蝕電流,A為指前因子,Ea為活化能,T為溫度。以ln(J)對T-1作圖,所得曲線如圖4所示。從圖4中擬合得到的直線斜率可求得腐蝕過程的活化能。計算結果表明,未加APPB時,A3鋼在15%鹽酸中發生腐蝕反應的活化能是32.41kJ/mol,加入0.15mmol·L-1的APPB后,腐蝕過程的活化能增大到72.99kJ/mol。由此可見,加入APPB后,腐蝕過程的活化能上升,意味鹽酸對A3鋼的腐蝕變得更加困難。研究表明,加入緩蝕劑后若活化能升高,則該緩蝕劑在金屬表面的吸附是物理吸附[9]。由此判斷,APPB在A3鋼表面的吸附存在物理吸附過程。
2.3 APPB濃度對緩蝕作用的影響及吸附熱力學分析
在300K,15%HCl中,采用失重法、極化曲線法和電化學阻抗譜考察了不同濃度APPB的緩蝕性能,結果分別見表5、圖5,極化曲線參數擬合結果見表6。從表6可見,在所研究的濃度范圍內,腐蝕電位變化不大。隨著體系中APPB濃度的增大,腐蝕電流明顯減小,陽極和陰極的塔菲爾斜率呈現上升的趨勢,陰極和陽極的緩蝕作用系數均小于1且隨APPB濃度增大而逐漸變小,這些均表明隨著APPB濃度的上升,緩蝕效果趨好,這與表5中失重法的結果是一致的,同時也可看出APPB是一種混合控制型緩蝕劑。

圖4 未加APPB和加入APPB(0.15mmol·L-1)后的Arrhenius曲線Fig.4 Arrhenius curves without APPB and with 0.15mmol·L-1 APPB
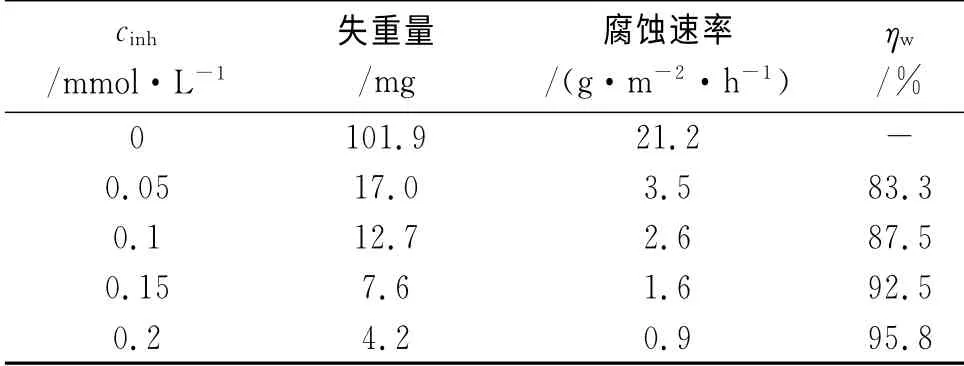
表5 不同濃度APPB的失重測試結果(300K)Tab.5 Results of weight loss in solutions with various concentrations of APPB(300K)
從圖5(b)可見,Nyquist曲線顯示為一個壓扁的半圓形單一容抗弧,因此可以采用單一時間常數的等效電路擬合相關參數[10],其中,Rs為溶液電阻,CPE為常相位角元件,由CPE-T(相當于雙電層電容)和CPE-P(彌散指數)組成,Rp為電荷轉移電阻,擬合結果見表7。從表中可見,隨著酸液中PAB和PPB濃度的升高,CPE-T減小,表明電極界面的雙電層電容減小。這是由于緩蝕劑分子取代了水分子吸附于A3鋼表面,而有機緩蝕劑分子的介電常數比水分子大,導致緩蝕劑吸附于A3鋼表面的界面電容要明顯小于水分子吸附于A3鋼表面的電容值[11]。CPE-P變化不大,表明電極反應過程仍為電化學控制過程[12]。Rp隨緩蝕劑濃度的上升而增大,表明加入APPB后腐蝕過程中電極反應的阻力增大。這與失重法和極化曲線得到的結論相符。根據幾何覆蓋效應緩蝕機理[13],用失重法所得到的緩蝕率ηw來代替覆蓋度θ,則Langmuir吸附等溫方程可用式(6)來表示:
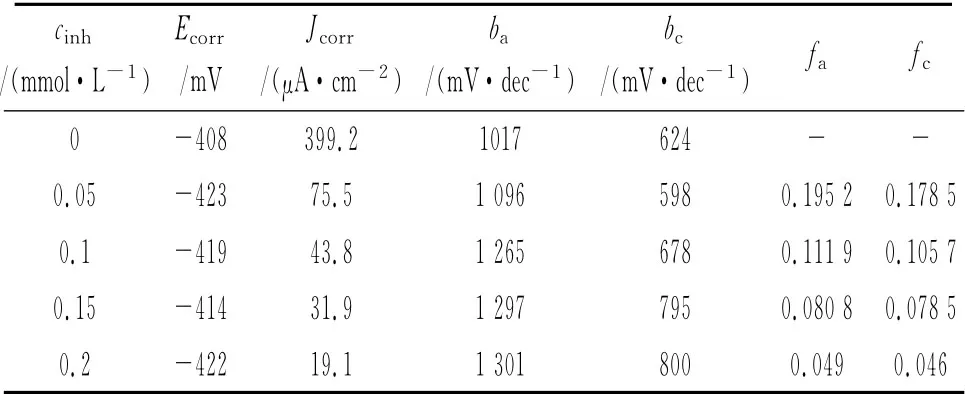
表6 不同濃度APPB條件下的極化曲線參數Tab.6 Polarization parameters in 15%HCl with various concentrations of APPB
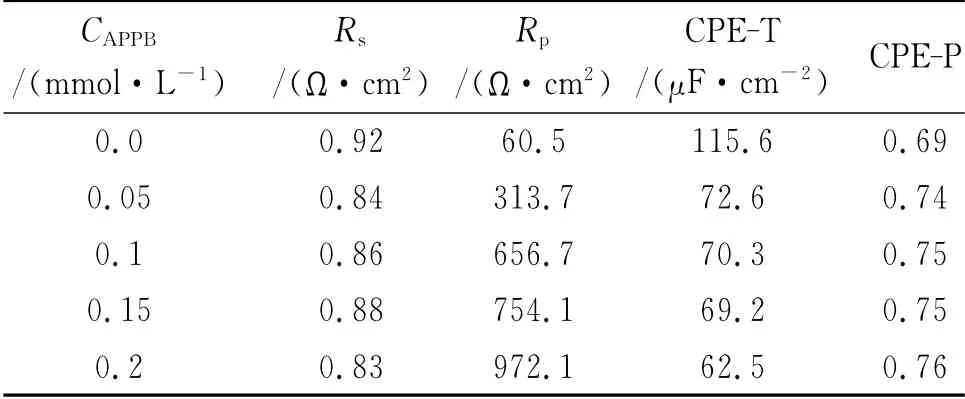
表7 不同濃度APPB條件下的交流阻抗參數Tab.7 Impedance parameters in 15%HCl with various concentrations of APPB
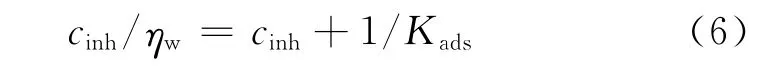
以cinh/ηw對cinh作圖,所得圖形如圖6所示。從圖6的擬合結果可見,cinh/ηw和cinh之間有著較好的線性關系,表明用Langmuir等溫方程來描述APPB與A3鋼在鹽酸中的吸附行為是合適的。根據圖中直線方程的截距,計算得到的吸附平衡常數Kads為78 186mol-1,再由關系式ΔGθads=-RTln(Kads),可算出吸附吉布斯自由能ΔGθads為-38.1kJ/mol。ΔGθads為負,表明APPB可自發吸附于A3鋼表面。一般認為,如果吸附自由能絕對值不超過20kJ/mol,則該吸附過程為物理吸附,如果吸附自由能達到40kJ/mol及以上,則說明該吸附過程為化學吸附[14-15]。因此,APPB在A3鋼表面的吸附除了物理吸附外,還存在著化學吸附。

圖6 吸附等溫線Fig.6 Langmuir isotherm adsorption of APPB at 300K
2.4 接觸角測定
圖7 為經過未加APPB的酸液和加入0.1mmol·L-1APPB的酸液浸泡后的A3鋼片與水之間的潤濕情況。從圖中可以看出,經過未加APPB的鹽酸溶液浸泡后,鋼片表面上的水滴塌陷程度大,其接觸角為38.7°;而經過加入0.1mmol·L-1APPB的鹽酸溶液浸泡后,鋼片表上的水滴塌陷程度較小,其接觸角為71.8°。可見,經加入APPB的酸液浸泡后,鋼片表面的潤濕性變差,其原因應是APPB能夠吸附于鋼片表面,形成了疏水膜。同時,這層疏水膜能降低腐蝕介質粒子與鋼片表面接觸的機會,從而起到對鋼片的緩蝕作用。
2.5 量子化學計算
采用Gaussian03W軟件,運用DFT/B3LYP方法,在6-31G*基組水平上對所研究分子進行幾何構型優化,并進行頻率分析,確保所得的結構均為勢能面上的極小點(無虛頻)[16],在同一基組水平上計算分子的前線軌道能量和分布。通過量子化學計算,APPB分子的HOMO能量EHOMO為-9.708eV,LUMO能 量ELUMO能 量 為-2.697eV,圖8為計算所得的APPB的HOMO和LUMO表面。從圖中可見,APPB分子HOMO主要分布在苯并咪唑環及其與之相連的苯胺N上,說明這一區域的電子云密度最大,有較強的供電子能力,可與Fe的3d空軌道形成配位鍵;LUMO軌道主要分布于丙烯基的雙鍵部位,說明這一區域可接受Fe成鍵軌道的電子形成反饋鍵。而且APPB分子HOMO與LUMO的這種非重疊分布還有利于分子以平行的方式吸附于Fe表面[17],從而增大對Fe表面的覆蓋面積,提高緩蝕效果。

圖7 A3鋼片與水的接觸角Fig.7 Contact angels between A3steel surface and water:(a)blank and(b)0.1mmol·L-1 APPB

圖8 APPB的前線軌道分布Fig.8 Frontier molecule orbital plots of APPB(a):HOMO,(b):LUMO
3 結論
(1)APPB對碳鋼的鹽酸腐蝕有良好的抑制作用,緩蝕作用隨APPB濃度的升高而增大。加入APPB后,提高了A3鋼片在鹽酸中發生腐蝕反應的活化能,使得腐蝕反應的進行需要克服更高的能壘,使腐蝕作用難以發生。
(2)APPB是一種混合控制型緩蝕劑,它可與Fe原子形成配位鍵和反饋鍵,能在鹽酸溶液中自發的吸附于A3鋼表面,這種吸附作用遵循Langmuir吸附等溫式,吸附過程兼具物理吸附和化學吸附的特點。
[1]宋力,張帆,王海平,等.2(4-吡啶基)苯并咪唑對碳鋼的緩蝕行為[J].腐蝕與防護,2013,34(2):142-146.
[2]POPOVA A,SOKOLOVA E,RAICHEVA S.AC and DC study of the temperature effect on mild steel corrosion in acid media in the presence of benzimidazole derivatives[J].Corrosion Science,2003,45(1):33-58.
[3]ZHANG F,TANG Y M,CAO Z Y.Performance and theoretical study on corrosion inhibition of 2-(4-pyridyl)-benzimidazole for mild steel in hydrochloric acid[J].Corrosion Science,2012,61(1):1-9.
[4]胡松青,米思奇,賈曉林.苯并咪唑類緩蝕劑的3DQSAR研究及分子設計[J].高等學校化學學報,2011,32(10):2402-2409.
[5]曹楚南.腐蝕電化學原理[M].北京:化學工業出版社,2004:201-203.
[6]吳蔭順,鄭家燊.電化學保護和緩蝕劑應用技術[M].北京,化學工業出版社,2006:496-497.
[7]ALJOURANI J,RAEISSI K,GOLOZAR M A.Benzimidazole and its derivativesas corrosion inhibitors for mild steel in 1MHCI solution[J].Corrosion Scienee,2009,51(8):1836-1843.
[8]王鳳平,康萬利,敬和平.腐蝕電化學原理、方法及應用[M].北京:化學工業出版社,2008:13-14.
[9]MORAD M A,EI-DEANA A M K.2,2′-Dithiobis(3-cyano-4,6-dimethylpyridine):A new class of acid corrosion inhibitors for mild steel[J].Corrosion Sciecce,2006,48(11):3398-3412.
[10]何橋,張勝濤,李偉華,等.酸性介質中新型三唑類緩蝕劑在碳鋼上的吸附行為[J].腐蝕與防護,2008,29(5):243-246.
[11]WANG X,YANG H,WANG F.An investigation of benzimidazole derivative as corrosion inhibitor for mild steel in 1MHCl solution[J].Corrosion Science,2009,51(5):1836-1843.
[12]宋偉偉,張靜,杜敏.新型不對稱雙季銨鹽緩蝕劑在HCl中對Q235鋼的緩蝕行為[J].化學學報,2011,69(16):1851-1856.
[13]LAGRENEE M,MERNARI B M,BOUANIS M,et al.Study of the mechanism and inhibiting efficiency of 3,5-bis(4-methylthiophenyl)-4H-1,2,4-triazole on mild steel corrosion in acidic media[J].Corrosion Science,2002,44(3):573-579.
[14]ALJOURANI J,RAEISSI K,GOLOZAR M A.Benzimidazole and its derivativesas corrosion inhibitors for mild steel in 1MHCI solution[J].Corrosion Science,2009,51(8):1836-1843.
[15]MARTINEZ S,STERN I.Inhibitory mechanism of low-carbon steel corrosion by mimosa tannin in sulphuric acid solutions[J].Journal of Applied Electrochemistry,2001,31(9):973-978.
[16]卑鳳利,陳海群,楊緒杰,等.苯并咪唑衍生物的合成-晶體結構及量子化學計算[J].有機化學,2004,24(3):300-305.
[17]張軍,趙衛民,郭文躍,等.苯并咪唑類緩蝕劑緩蝕性能的理論評價[J].物理化學學報,2008,24(7):1239-1244.

