具有AHL 降解能力的海洋微生物的篩選與鑒定
趙 晶,李 天,金黎明,權春善
(大連民族學院 生物技術與資源利用國家民委-教育部重點實驗室,遼寧 大連116605)
群體感應(quorum sensing,QS)是廣泛存在于細菌個體及種群之間的信息交流機制,細菌能夠感知自身合成信號分子的濃度變化,當信號分子濃度達到閾值時,能夠啟動一系列基因的表達,從而調控多種生物學功能,包括致病力、生物發光、抗生素的產生以及生物膜的形成等。酰基高絲氨酸內酯(acyl homoserine lactones,AHLs)是革蘭氏陰性細菌的主要信號分子[1-3]。對AHLs 進行生物降解,能夠有效抑制革蘭氏陰性細菌的群體感應[4-6],對于阻斷病原菌的發病機制、降低其致病性具有重要意義。
自從在革蘭氏陰性菌中發現AHL 調控的群體感應系統以來,研究者從陸生微生物中篩選、鑒定出多種具有AHL 降解能力的微生物[7-10]。但海洋中具有AHL 降解能力的微生物資源尚未得到充分開發。本研究從西南印度洋海泥中篩選具有AHL 降解能力的菌株,以豐富具有AHL 降解能力的微生物資源。
1 材料與方法
1.1 材料
1.1.1 海泥
本實驗所用的海泥樣品由中國大洋生物樣品館提供,采自西南印度洋海區,樣品編號分別為DY115 -20V-S16 -TVG6、DY115 -20V -S12 -TVG4、DY115 - 21IV - S1 - TVG1 和DY115 -21IV-S11 -TVG8,實驗室保藏。
1.1.2 報告菌株
報告菌株為紫色視桿菌Chromobacterium Violaceum 026,由新加坡分子與細胞生物學研究所Lianhui Zhang 教授饋贈。該指示菌為野生型紫色視桿菌的mini-Tn5 突變體,不能產生紫色色素。外源AHLs 能夠激活其QS 系統(CviI/R),使其產生紫色色素。
1.2 試劑
信號分子N - 己酰基高絲氨酸內酯(C6 -HSL)由本實驗室制備,合成方法按照參考文獻[11]進行。基因組DNA 提取試劑盒購自福際生物技術有限公司,PCR 用Taq 酶、dNTPs 等試劑及電泳用Marker、loading buffer 等試劑購自寶生物工程(大連)有限公司。
1.3 培養基
LB 培養基:蛋白胨10 g,酵母提取物5 g,NaCl 10 g,蒸餾水定容至1 L,pH 7.2。培養基中加入2 %瓊脂即為相應固體培養基。121 ℃滅菌15 min。
海洋微生物富集培養基:NaCl 1.0 g,KCl 0.5 g,MgCl20. 4 g,CaCl20. 1 g,Na2SO40. 15 g,K2HPO40.2 g,2 -嗎啉乙磺酸(MES)1.0 g,蒸餾水定容至1 L,pH 5.5,121 ℃滅菌15 min。滅菌后在無菌環境下加入己酰基高絲氨酸內酯(C6 -HSL)0.5 g。
MM 培養基:KH2PO44.5 g,(NH4)2SO42.0 g,MgSO4·7H2O 0.2 g,K2HPO410.5 g,蒸餾水定容至1 L,pH 5.5,121 ℃滅菌15 min。
1.4 方法
1.4.1 菌株富集及分離純化
以C6 -HSL 作為菌株生長的唯一碳源及能源,將制備的海洋微生物富集培養基分裝于直徑15 cm 的試管中,每管3 mL。將海泥樣品以3 %的接種量接種于富集培養基中,于30 ℃、130 r·min-1搖床震蕩培養1 周左右,連續3 次富集培養后的菌液在LB 瓊脂培養平板上利用稀釋涂布法和劃線分離法進行分離純化。
1.4.2 篩選菌株的AHL 降解能力檢測
分離純化后得到的菌株分別用接種環取一環,接于LB 培養基中,于30 ℃、180 r·min-1搖床震蕩培養。取7 mL 對數晚期培養液于無菌離心管中,4℃、8 000 r·min-1條件下離心5 min。取100 μL 上清液于無菌EP 管中,加等體積MM 培養基和1 μL 的信號分子C6 -HSL 溶液(0.2 mg·mL-1),30 ℃共培養4 h;同時,于離心后菌體沉淀中加入0.5 mL 無菌水使其充分懸浮。取100 μL 菌懸液于無菌EP 管中,加等體積MM 培養基和1 μL 信號分子溶液,30 ℃共培養4 h。報告菌株C. Violaceum 026 于LB 瓊脂培養平板劃線,30℃培養12 ~16 h。將LB 瓊脂培養平板用滅菌小刀切割成4 條,排列整齊。在平板一側點報告菌株C. Violaceum 026,菌株間隔為0.5 cm。在平板另一側,距離最近的報告菌株點樣1 cm 處按次序分別上樣:無菌水5 μL、上清液與AHL 共培養物5 μL、菌體懸浮液與AHL 共培養物5 μL、1μg·mL-1的AHL 溶液5 μL,30 ℃培養箱過夜培養。48 h 后觀察顯色反應。
1.4.3 菌株形態鑒定
將具有較強AHL 降解能力的菌株分別于LB瓊脂平板上劃線,30℃過夜培養。菌落形態觀察、革蘭氏染色及芽孢染色按照微生物實驗手冊進行。
1.4.4 16S rDNA PCR 擴增和序列分析
利用基因組DNA 提取試劑盒提取具有AHL降解能力的菌株基因組DNA,以其為模板進行16S rDNA PCR 擴增。采用細菌16S rDNA 擴增通用引物,正向引物16S -8f:5' - AGAGTTTGATCCTGGCTCAG - 3',反 向 引 物16S - 1525:5' -AAAGGAGGTGATCCAGCC - 3'。PCR 反 應 條 件為:95 ℃5 min;94 ℃30 s,50 ℃30 s,72 ℃1 min,30 個循環;72 ℃10 min。PCR 產物經電泳檢測后,由寶生物工程(大連)有限公司測序。將所測菌株的16S rDNA 序列與GenBank 核酸序列數據庫中的序列進行比對。利用MEGA 5 軟件進行同源性分析,建立系統發育樹。
2 結果與討論
2.1 樣品富集培養及菌株分離純化
利用富集培養基對海泥中微生物進行富集,一周后培養基變渾濁,證明海泥中存在能夠利用AHL 的微生物。分離純化后從西南印度洋海泥中共篩選出5 株可能具有C6 -HSL 降解活性的菌株,分別命名為S1、S2、S3、S4、S5(如圖1)。

圖1 分離純化菌株的形態特征
2.2 所篩菌株的AHL 降解能力檢測
將初篩所得的5 株海洋菌進行AHL 降解能力檢測,以C.Violaceum 026 為報告菌株,以無菌水為陰性對照、C6 -HSL 為陽性對照,采用瓊脂切條法進行AHL 降解能力確定(如圖2)。可見S1、S4、S5 3 株菌培養液進行離心后,其上清液與C6 -HSL 的共培養物和菌體懸浮液與C6 -HSL 的共培養物均能使報告菌株C. Violaceum 026 顯紫色,表明這3 株菌不能分泌降解C6 -HSL 的酶;相反地,S2、S3 的菌體懸浮液與C6 -HSL 的共培養物不能使報告菌顯紫色,其上清液與C6 -HSL 的共培養物則能夠使菌體顯紫色。結果表明,S2、S3 菌株的菌體懸浮液具有很強的C6 -HSL 降解能力,可能含有胞內AHL 降解酶。

圖2 菌株S1、S2、S3、S4、S5 AHL 降解能力鑒定
2.3 具有AHL 降解能力的菌株鑒定
2.3.1 形態特征鑒定
對S2、S3 菌株進行形態特征鑒定(見表1),確定這2 株菌均為革蘭氏陽性菌,屬芽孢桿菌。

表1 S2、S3 形態特征鑒定
2.3.2 16S rDNA PCR 擴增和系統發育分析
對菌株S2、S3 的基因組DNA 提取后進行瓊脂糖電泳(如圖3),以基因組為模板分別進行16S rDNA PCR 擴增(如圖4),電泳檢測得到二條約1 500 bp的產物,與預期的大小一致。對S2、S3 的16S rDNA 測序,分別得到1 467 bp 大小的序列。將菌株S2、S3 的16S rDNA 序列與GenBank 中已登記的16S rDNA 序列進行同源性比對,發現S2、S3 與芽孢桿菌屬的16S rDNA 自然類聚。

圖3 S2、S3 基因組DNA 電泳圖
圖4 S2、S3 的16S rDNA PCR 產物的電泳檢測
選取14 株與其同源性較高的序列,與菌株S2、S3 分別構建系統發育樹(如圖5)。可以發現S2、S3 與Bacillus amyloliquefaciens strain VJ -1 的親緣關系最近。
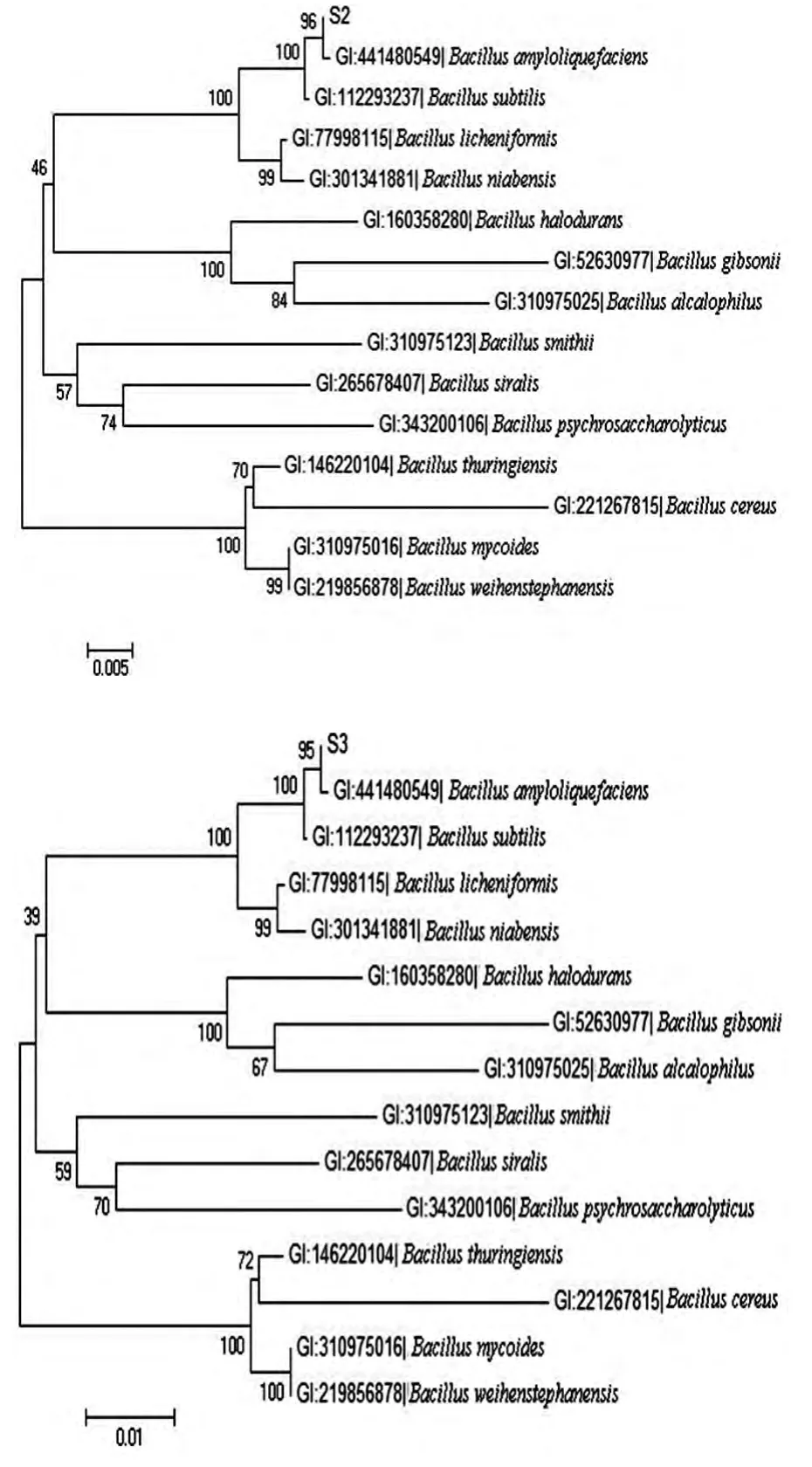
圖5 菌株S2、S3 以16SrDNA 為基礎的細菌系統發育樹
3 結 論
本研究主要對西南印度洋海泥中的AHL 降解菌進行篩選及鑒定。以C6 -HSL 為唯一碳源和能源對海泥中微生物進行富集,篩選得到5 株形態不同的菌株。采用瓊脂切條檢測法,利用紫色視桿菌C. Violaceum 026 對5 株菌進行AHL 降解能力檢測,確定菌株S2、S3 可能含有胞內AHL降解酶。經菌株形態和16SrDNA 序列分析,菌株S2、S3 均為芽孢桿菌屬。選取芽孢桿菌屬14 個種的16s rDNA 基因序列構建系統發育樹,菌株S2、S3 與B. amyloliquefaciens 的親緣關系最近,初步確定這2 株菌為解淀粉芽孢桿菌。
[1]WATERS C M,BASSLER B L. Quorum sensing:cellto - cell communication in bacteria[J]. Annu. Rev.Cell Dev. Biol.,2005,21:319 -346.
[2]李承光,賈振華,邱健,等. 細菌群體感應系統研究進展及其應用[J]. 生物技術通報,2006 (1):5 -8.
[3]NG W L,BASSLER B L. Bacterial quorum - sensing network architectures[J]. Annu. Rev. Genet.,2009,43:197 -222.
[4]DONG Y H,ZHANG L H. Quorum sensing and quorum- quenching enzymes[J]. J. Microbiol.,2005,43(spec. No.):101 -109.
[5]DONG Y H,WANG L H,ZHANG L H. Quorum -quenching microbial infections:mechanisms and implications[J]. Philos. Trans. R. Soc. Lond. B. Biol. Sci.,2007,362(1483):1201 -1211.
[6]CZAJKOWSKI R,JAFRA S. Quenching of acyl-homoserine lactone-dependent quorum sensing by enzymatic disruption of signal molecules[J]. Acta Biochim. Pol.,2009,56(1):1 -16.
[7]JAFRA S,VAN DER WOLF J M. Fast screening method for detection of acyl - HSL - degrading soil isolates[J]. J. Microbiol. Methods,2004,57(3):415 -420.
[8]CHAN K G,TIEW S Z,NG C C. Rapid isolation method of soil bacilli and screening of their quorum quenching activity[J]. As. Pac. J. Mol. Biol. Biotech.,2007,15(3):153 -156.
[9]邱健,賈振華,馬宏,等. 一株降解N-酰基高絲氨酸內酯酵母菌菌株的分離鑒定及其降解特性[J]. 微生物學學報,2007,47(2):355 -358.
[10]汪玲玲,龔偉倫,劉靄莎. 苜蓿內生菌中高效AHL降解菌的篩選和鑒定[J]. 華南農業大學學報,2010,31(2):68 -71.
[11]CHHABRA S R,STEAD P,BAINTION N J,et al. Autoregulation of carbapenem biosynthesis in Erwinia carotovora by analogues (3 - oxohexanoyl)- L - homoserine lactone[J]. J. Antibiot.,1993,46(3):441-454.

