伯氏疏螺旋體膜蛋白OspC研究進展
汪佳婕 寶福凱,2,3,4,5 柳愛華
1.昆明醫科大學病原生物學與免疫學系 熱帶醫學研究所,云南昆明 650500;2.昆明醫科大學云南省高校熱帶傳染病重點實驗室,云南昆明 650500;3.云南省熱帶病示范型國際科技合作基地,云南昆明 650500;4.云南省公共衛生與疾病防控協同創新中心,云南昆明 650500;5.昆明醫科大學生物化學與分子生物學系,云南昆明 650500
萊姆病(Lyme disease)作為一種蜱媒傳播的傳染性疾病, 在一些特殊人群和一些特別地區有很高的感染率。但到目前為止,缺少比較敏感和準確的診斷方法對萊姆病進行早期診斷。因此,要做到及時預防和及時治療,在世界范圍內還是個難題。經研究發現,萊姆病的致病病原體是一種叫做伯氏疏螺旋體(Borrelia Burgdorferi)的螺旋體,其外膜蛋白C(OspC)有非常強的抗原性和較強的免疫原性,機體在感染萊姆病的早期就可以產生特異性的IgM抗體,將這種抗體純化后,對動物模型進行免疫,結果發現,動物模型在免疫后很短時間內就可檢測到高濃度的IgM 抗體,目前,重組OspC 已用于萊姆病的臨床診斷中。
1 OspC的細胞定位與化學結構
在進行OspC 的抗原性研究之前,首先對其細胞定位與化學結構做一定的研究,才有可能全面的研究其抗原性機制。
那么,外膜脂蛋白C(OspC)是萊姆病螺旋體的主要外膜蛋白之一,作為一種外膜蛋白,OspC 廣泛存在于螺旋體細胞外膜中。從結構上來看,β-桶狀結構是其共有的結構特征,不同的β-桶狀結構由不同的偶數個β-折疊片組成,β-折疊的數量從8 ~ 22 個不等。在美國中西部、東北部等地區,發現25 種OspC 基因型的表達[1-2]。Elisabeth Baum 在其研究中指出,OspC 的179 氨基酸殘基至188 個殘基中的第五個C 末端折疊結構是OspC的特異性交互抗體結合的關鍵位置[3]。OspC 作為一個表面暴露的脂蛋白,可以引起早起的免疫反應[4-7]。在Elisabeth Baum 的研究中,得到了OspC的最大交互反應區域的3D 圖形。如圖1,在圖中,OspC 二聚體的兩條鏈分別被標以亮灰色與暗灰色。同時,在Elisabeth Baum 的研究中將OspC 二聚體中與抗體藥物關聯度最高的區域指出。其中,綠色部分代表與種OspC 有高關聯度,黃色部分表示與兩種OspC 蛋白有高關聯度,紅色部分表示與五種OspC 蛋白有高關聯[8]。
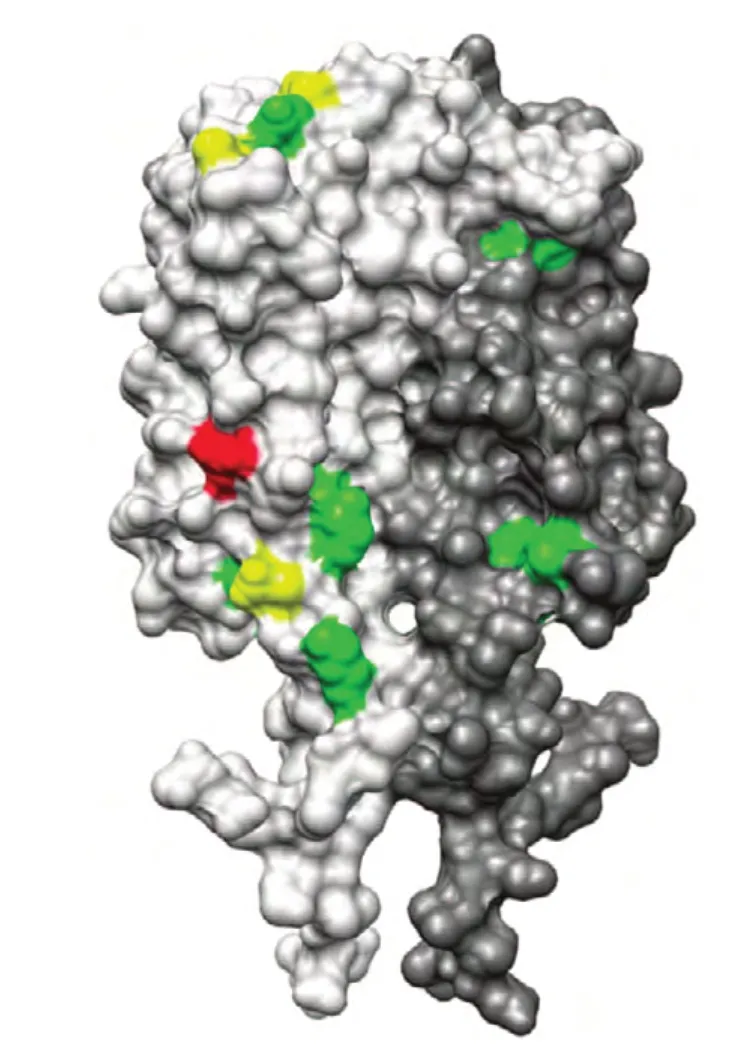
圖1 OspC 的最大交互反應區域的3D 圖形
2 OspC的表達調控
伯氏疏螺旋體特異性地調節其外膜脂蛋白OspC 的合成,以感染宿主細胞。為了適應哺乳動物體內的免疫環境,螺旋體首先利用OspC 在哺乳動物體內建立起其感染過程。伯氏疏螺旋體大量產生OspA 和OspB,而OspC 在硬蜱體內低表達,從蜱媒介傳播到哺乳動物吸血后則出現上調[9],以幫助伯氏疏螺旋體轉移到唾液腺[10],進而感染哺乳類動物[11-12]。感染一旦建立起來,OspC 的表達就會被抑制,以避免被宿主的免疫系統清除。同時伯氏疏螺旋體在人體內初期呈現一個高表達狀態[13],當抗體產生后殺死了OspC 一直出現一個低表達克隆[14]。在表達基因的啟動子中,反向重復序列的上游部分在調節OspC 的表達中起到關鍵作用。Dan Drecktrah 等[15]通過定點突變技術在分子水平上切割了OspC 表達基因操作子的末端反向重復序列,結果發現,打亂末端反向重復序列但保留鄰近的反向重復序列能夠阻止OspC 的合成。同時發現,溫度,pH 以及DNA 超螺旋對于OspC 的合成也起到重要影響。Schwan 等[16]發現,在溫度為32 ~ 37℃的條件下, OspC 的表達量大幅度地提高。由此說明,適宜的溫度是OspC 大量表達的重要條件, 在不適宜的溫度下,OspC 不表達或表達量很低。因此,近年來很多國外學者認為,pH 值、溫度以及其他因素或許會對OspC 的免疫效果起到關鍵的影響[17-20]。更重要的是,比起核苷酸的序列,末端反向重復序列的堿基互補配對的存在對于控制OspC 的表達更為重要。Dan Drecktrah 的結果顯示,順式作用元件在OspC 毒力因子的表達上有關鍵的作用。
3 OspC致病性的研究
在對伯氏疏螺旋體外表面膜蛋白(OspC)致病性進行研究時發現,用OspC 與Salp15 結合,一起感染哺乳類動物,可以幫助伯氏疏螺旋體在局部定居,并抵抗免疫殺傷。2OspC 作為一個有效的免疫靶,表達下調時幫助伯氏疏螺旋體免疫逃逸,對OspC 在早期的感染中起重要作用[13]。雖然OspC是伯氏疏螺旋體關鍵的毒力因子之一,但是它在伯氏疏螺旋體的感染中的具體作用目前還不清楚。為了確定在接種了各種不同類型的OspC 菌株后,OspC 是否會引起宿主反應, Antonara 等分別接種了野生型OspC 菌株,突變型菌株以及完全突變型菌株后,對巨噬細胞,中性粒細胞以及細胞因子的產生進行了測定。在21 種細胞因子的測定中發現巨噬細胞趨化蛋白(MCP-1),角質細胞起源趨化因子(KC, CXCL1)以及血管內皮生長因子(VEGF)在伯氏疏螺旋體的接種位點有表達量上升的趨勢。并且在接種一周內的多個時間點OspC 的表達量有不同的變化[21]。
4 OspC的診斷價值
到目前為止,缺少比較敏感和準確的診斷方法對萊姆病進行早期的診斷。因此,要做到及時診斷和治療,在世界范圍內還是個難題。經研究發現,萊姆病的致病病原體伯氏疏螺旋體外膜蛋白C(OspC)有較強的免疫原性,機體在感染萊姆病的早期就可以產生特異性的OspC IgM 抗體,將OspC 純化后,對動物模型進行免疫,結果發現,動物模型在免疫后很短時間內就可以檢測到高濃度的IgM 抗體。目前,重組OspC 已用于萊姆病的臨床診斷。
近年的研究表明,OspC 作為伯氏疏螺旋體的主要外膜蛋白之一,具有很強的抗原性。Gilmore等[17]利用OspC 免疫12 只初生小鼠, 然后利用伯氏疏螺旋體菌株感染這12 只獲得免疫的初生小鼠, 由此發現了OspC 能夠使動物產生高濃度的抗體, 使其具有抵抗伯氏疏螺旋體感染的能力。
目前有不少研究報道指出,OspC 在宿主體內可以引起早期免疫反應,因此有研究者致力于利用OspC 作為抗原用來診斷早期的萊姆病[22-24]。早年,Hauser 等[25]培養了大量不同萊姆病的菌株,并從中提取了大量的OspC 作為抗原,利用ELASA技術檢測了222 例萊姆病患者的血清和133 例對照供血者的血清。其結果顯示,有幾株菌株間的IgG 的檢測靈敏度非常相似。利用Western blot 技術驗證后發現,OspC 確實可以作為一種靈敏的萊姆病早期診斷抗原。在此之后,Rousselle 等[6]通過對比772 株狹義氏疏螺旋體的OspC 與14kD 鞭毛蛋白片段等其他細胞抗原平行應用于檢測萊姆病病人和無癥狀的對照組的IgG 與IgM, 結果發現IgM 抗體的差異性最大。另外, Hauser 等[26]又做了進一步的研究,利用WB 技術檢測了菌株PKo、PBi 與Pka2 的 靈 敏 度, 結 果 發 現OspC 對早期萊姆病感染的檢出靈敏度要遠遠高于其他抗原,并最終推薦了OspC 作為PKo 診斷的最敏感的抗原。
Jobe 等[27]的研究中發現,在人類萊姆病的早期階段中,ELISA 可以作為一種有效的方式來檢測OspC 抗體,同時也能為成功治療萊姆病作為一個重要的判斷依據。
目前看來,OspC 作為伯氏疏螺旋體的主要抗原之一, OspC 雖然具有比較大的差異, 但其具有很強的特異性。因此,在診斷學臨床應用中,將OspC作為診斷抗原,具有很大的臨床優勢。同時,如果將OspC 與其他的抗原相結合,進行配伍診斷,那么這種診斷方法不僅能夠提高診斷的靈敏度, 還能減少與其他病原體的交叉反應。這將在將來萊姆病的診斷中顯示出很強的優勢與潛力。預計在今后的萊姆病防治中也會發揮一定的作用。至于在伯氏疏螺旋體的致病性上的研究, 目前的研究主要涉及于T 細胞的免疫反應、病原體本身的作用以及不同基因型螺旋體的作用。預計在以后的研究中,將會把OspC 與其他蛋白的研究相結合,從而獲取更多的研究結果,在萊姆病的各方面獲取進一步的進展。
付鈺廣等[28]利用來自SZ 菌株的重組蛋白OspC,進行WB 實驗檢測顯示,重組的OspC 與陽性血清有較強的反應,同時SZ 菌株作為我國的流行菌株,若利用SZ 菌株的OspC 建立相對應的ELISA方法來檢測伯氏疏螺旋體,這對我國萊姆病的預防和控制有很大作用,并有助于消除世界范圍內萊姆病病患。同時,其研究的重組蛋白OspC(SZ 菌株)為建立羊體內的伯氏疏螺旋體抗體的ELISA 檢測方法奠定了重要的基礎。
目前在世界范圍內對于OspC 的研究已經有了初步結果,對OspC 的研究有助于對萊姆病的發病原因,發病機理和發病規律進行了解。并且已經初步建立了利用OspC 作為檢測抗原用來檢測早期的萊姆病。但對于OspC 的深入研究還遠遠不夠,還有待更深一步的實驗與臨床研究。
[1] Kramer VL,Beesley C.Temporal and spatial distribution of Ixodes pacificus and Dermacentor occidentalis(Acari:Ixodidae) and prevalence of Borrelia burgdorferi in Contra Costa County,California[J].J Med Entomol,1993,30(3):549-554.
[2] Barbour AG,Travinsky B.Evolution and distribution of the ospC Gene,a transferable serotype of Borrelia burgdorferi[J].MBio,2010,1(4)::e00153-10.
[3] Elisabeth Baum1,Arlo Z,Randall M,et al.Barbo.Inferring Epitopes of a Polymorphic Antigen Amidst Broadly Cross-Reactive Antibodies Using Protein Microarrays:A Study of OspC Proteins of Borrelia burgdorferi[J].PLoS ONE,2013,8(6):1-11.
[4] Kraiczy P,Hunfeld KP,Peters S,et al.Borreliacidal activity of early Lyme disease sera against complementresistant Borrelia afzelii FEM1 wild-type and an OspClacking FEM1 variant[J].J Med Microbiol,2000,49(10):917-928.
[5] Montgomery RR,Malawista SE,Feen KJ,et al.Direct demonstration of antigenic substitution of Borrelia burgdorferi ex vivo: exploration of the paradox of the early immune response to outer surface proteins A and C in Lyme disease[J].J Exp Med,1996,183(1):261-269.
[6] Rousselle JC,Callister SM,Schell RF,et al.Borreliacidal antibody production against outer surface protein C of Borrelia burgdorferi[J].J Infect Dis,1998,178(3):733-741.
[7] Jobe DA,Lovrich SD,Schell RF,et al.C-terminal region of outer surface protein C binds borreliacidal antibodies in sera from patients with Lyme disease[J].Clin Diagn Lab Immunol, 2003,10(4):573-578.
[8] Baum E,Randall AZ,Zeller M.,et al.Inferring epitopes of a polymorphic antigen amidst broadly cross-reactive antibodies using protein microarrays: a study of OspC proteins of Borrelia burgdorferi[J].PLoS One,2013,8(6):e67445.
[9] Eicken C,Sharma V,Klabunde T,et al.Crystal structure of Lyme disease antigen outer surface protein C from Borrelia burgdorferi[J].J Biol Chem,2001,276(13):10010-10015.
[10] Pal U,Yang XF,Chen M,et al.OspC facilitates Borrelia burgdorferi invasion of Ixodes scapularis salivary glands[J].J Clin Invest,2004,113(2):220-230.
[11] Ramamoorthi N,Narasimhan S,Pal U,et al.The Lyme disease agent exploits a tick protein to infect the mammalian host[J].Nature,2005,436(7050):573-577.
[12] Grimm D,Tilly K,Byram R,et al.Outer-surface protein C of the Lyme disease spirochete: a protein induced in ticks for infection of mammals[J].Proc Natl Acad Sci USA,2004,101(9):3142-3147.
[13] Seemanapalli SV,Xu Q,McShan K,et al.Outer Surface Protein C Is a Dissemination-Facilitating Factor of Borrelia burgdorferi during Mammalian Infection[J].PLoS ONE,2010,5(12):e15830.
[14] Xu Q,Seemanapalli SV,McShan K,et al.Constitutive expression of outer surface protein C diminishes the ability of Borrelia burgdorferi to evade specific humoral immunity[J].Infect Immun,2006,74(9): 5177-5184.
[15] Drecktrah D,Hall LS,Hoon-Hanks LL,et al.An inverted repeat in the ospC operator is required for induction in Borrelia burgdorferi[J].PLoS One,2013,8(7):e68799.
[16] Schwan TG,Piesman J,Golde WT,et al.Induction of an outer surface protein on Borrelia burgdorferi during tick feeding[J].Proc Natl Acad Sci USA,1995,92(7):2909-2913.
[17] Gilmore RD Jr,Mbow ML.Conformational nature of the Borrelia burgdorferi B31 outer surface protein C protective epitope[J].Infect Immun,1999,67(10):5463-5469.
[18] Wang G,van Dam AP,Dankert J.Evidence for frequent OspC gene transfer between Borrelia valaisiana sp.nov.and other Lyme disease spirochetes[J].FEMS Microbiol Lett,1999,177(2):289-296.
[19] Zhong W,Gern L,Stehle T,et al.Resolution of experimental and tick-borne Borrelia burgdorferi infection in mice by passive,but not active immunization using recombinant OspC[J].Eur J Immunol,1999,29(3):946-957.
[20] Wang IN,Dykhuizen DE,Qiu W,et al.Genetic diversity of ospC in a local population of Borrelia burgdorferi sensu stricto[J].Genetics,1999,151(1):15-30.
[21] Antonara S,Ristow L,McCarthy J,et al.Effect of Borrelia burgdorferi OspC at the site of inoculation in mouse skin[J].Infect Immun,2010,78(11):4723-4733.
[22] Wilske B,Habermann C,Fingerle V,et al.An improved recombinant IgG immunoblot for serodiagnosis of Lyme borreliosis[J].Med Microbiol Immunol,1999,188(3):139-144.
[23] Mathiesen MJ,Christiansen M,Hansen K,et al.Peptidebased OspC enzyme-linked immunosorbent assay for serodiagnosis of Lyme borreliosis[J].J Clin Microbiol,1998,36(12):3474-3479.
[24] Magnarelli LA,Flavell RA,Padula SJ,et al.Serologic diagnosis of canine and equine borreliosis:use of recombinant antigens in enzyme-linked immunosorbent assays[J].J Clin Microbiol,1997,35(1):169-173.
[25] Hauser U,Lehnert G,Wilske B.Validity of interpretation criteria for standardized Western blots (immunoblots) for serodiagnosis of Lyme borreliosis based on sera collected throughout Europe[J].J Clin Microbiol,1999,37(7):22411.
[26] Hauser U,Lehnert G,Wilsk E.B1Diagnost ic value of proteins of three Borrelia species(Borrelia burgdorferi sensu lato)and implications for development an d use of recombinant antigens for serodiagnosis of Lyme borreliosis in Europe[J].Clin Diagn Lab Immunol,1998,5(4):456-462.
[27] Jobe DA,Kowalski TJ,Bloemke M,et al.Rapid decline of OspC borreliacidal antibodies following treatment of patients with early Lyme disease[J].Clin Vaccine Immunol,2011,18(6):1034-1037.
[28] 付鈺廣,關貴全,牛慶麗,等.伯氏疏螺旋體外膜蛋白C 的表達及抗原性分析[J].中國獸醫科學,2011,41(7):661-665.

