堿性成纖維細胞生長因子在大鼠腮腺萎縮和再生過程中的表達及意義
堿性成纖維細胞生長因子在大鼠腮腺萎縮和再生過程中的表達及意義
劉士維,盧浩,柳康,張賜童,劉麒麟,孫賓,張偉*
(吉林大學口腔醫院 口腔頜面外科,吉林 長春130021)
頭頸部的放射治療、炎癥等常會引起涎腺分泌功能障礙,影響患者的生活質量,因此,治療涎腺萎縮,促進腺體功能恢復日益引起人們的重視。堿性成纖維細胞因子(bFGF)是目前公認的最強的促血管生成因子和促創傷修復因子之一[1],已有國外學者研究表明bFGF在大鼠下頜下腺中有表達并可以促進下頜下腺組織修復[2]。與下頜下腺相比,腮腺在組織結構以及功能上與其有一定的區別,雖有學者已證實bFGF存在于大鼠的腮腺組織中[3],但對bFGF在腮腺組織萎縮及再生過程中表達變化及生理功能的研究還未見報道,本實驗通過建立Wistar大鼠腮腺主導管結扎和再通模型[4],研究在此過程中bFGF的表達及與腮腺細胞增殖的線性關系。
1材料和方法
1.1實驗對象
7周齡SPF級雄性Wistar大鼠84只,體重約200-250 g,購于吉林大學動物實驗中心。84只Wistar大鼠隨機分為3組——空白對照組6只(不做任何處理)、腮腺主導管結扎組42只及主導管結扎再通組36只,常規飼養。
1.2腮腺創傷和再生模型的建立
結扎組和再通組大鼠10%水合氯醛3 mL·kg-1行腹腔麻醉,游離腮腺主導管和伴行的面神經頰支,用1號線雙重結扎主導管,皮膚對位縫合。術后給予200單位青霉素,回籠常規飼養。結扎組大鼠在術后1 d、3 d、5 d、7 d、14 d、28 d、60 d處死,沿腮腺主導管切取右側腮腺,立即放置4%多聚甲醛溶液中固定,再通組大鼠在導管結扎第14天取出結扎線,確保導管再通,分別于再通后1 d、3 d、5 d、7 d、14 d、28 d處死,同樣方法獲取腮腺標本。
1.3組織學觀察
腮腺標本置于4%多聚甲醛溶液中固定24h后,梯度乙醇脫水、二甲苯透明、浸蠟、包埋,制成4 μm切片,行蘇木精—伊紅(Hematoxylin-Eosin,HE)染色,置于光鏡下觀察組織學變化。
1.4免疫組織化學觀察
應用UltraSensitiveTM SP法免疫組織化學染色,DAB顯色,試劑:兔抗鼠多克隆抗體(bFGF)(購于武漢博士德公司,中國)、兔抗鼠多克隆抗體PCNA抗體(購于Immunoway公司,美國),抗體濃度稀釋1∶200。方法:蘇木精輕度復染、鹽酸酒精分化、氨水返藍,鏡下觀察bFGF、PCNA的表達變化。
1.5統計分析

2結果
2.1大鼠腮腺結扎后與再通后的形態學改變
結扎組:導管結扎1天后腺體體積較正常腺體增大,隨后2天有縮小趨勢,第3天大至恢復正常大小,第7天時腺體明顯萎縮,至28天時萎縮到正常腺體三分之二,顏色加深,質地變硬,腺小葉結構模糊。
再通組:主導管再通后,腺體顏色、體積、質地逐漸恢復正常,再通后14天時,腺體外觀已恢復至正常腺體相近。
2.2組織學觀察結果
2.2.1正常腮腺:腺體表面覆有被膜并且深入到腺體內,將腺體分隔開,形成許多腺葉和腺小葉,腺體是由腺泡細胞組成,腺泡細胞大小均勻,規則排列,其周圍廣泛散在有導管(包括閏管、紋管及排泄管)(見圖1A)。
2.2.2結扎組:第1天時可見導管稍有擴張,但腺體無實質性改變;3天時導管增多,腺泡減少,腺小葉出現結構紊亂;5天、7天時腺泡細胞繼續萎縮、減少,導管擴張,出現導管樣結構(見圖1B);14天時,導管樣結構更多,少數的腺泡細胞分布在小葉邊緣,大量淋巴細胞浸潤;28天時,腺泡細胞幾乎全部消失,腺體幾乎全部是導管樣結構,且相鄰導管間有發生融合的傾向(見圖1C)。
2.2.3再通組:第1天時萎縮的腺體未發生明顯改變,還可見大量擴張的導管(見圖1D);第3天時導管樣結構減少;5天時,腺小葉周圍出現新生的腺泡增多,且體積增大,導管樣結構明顯減少(見圖1D);7天時,新生的腺泡已占絕大多數,形態趨近正常,但排列不夠密實;14天、28天時腺泡細胞充盈,腺小葉結構恢復近似正常(見圖1F)。

圖1 大鼠腮腺主導管結扎及再通術后不同時間點的
2.3免疫組織化學染色結果
2.3.1bFGF免疫組化染色結果
①bFGF正常腮腺:在正常腺體中bFGF主要在導管上皮細胞和部分腺泡細胞中散在陽性表達(見圖2A)。
②結扎組:主導管結扎后bFGF的吸光度值增加,3天達峰值(0.177±0.010),主要在腺泡細胞的胞漿和基質中表達,隨后bFGF的表達漸平穩,7天后在腺泡細胞的基底膜和導管樣結構周圍表達。bFGF在各點的陽性表達情況見圖2B、C及表1,與正常腮腺相比較二者具有統計學意義。
③再通組:主導管再通1d后腺泡細胞吸光度值增加,3d達峰值(0.288±0.027),且主要在新生腺泡細胞的胞漿和導管內皮細胞中表達,7d后表達下降,導管細胞的bFGF表達維持在較恒定的水平。bFGF在各點的陽性表達情況見圖2D、E、F及表1,與正常腮腺相比較二者具有統計學意義。

圖2 大鼠腮腺主導管結扎及再通術后不同時間點的
2.3.2PCNA免疫組化染色結果
①結扎組:在結扎3天后PCNA的表達顯著上升,在腺泡和導管中都有表達,5天后腺泡細胞中PCNA達到峰值,隨后降低并保持穩定。PCNA在不同時間點的陽性表達情況見圖3A、B、C及表2。
②再通組:在導管再通1天PCNA的平均陽性表達上升,5天達到峰值,7天后降低并趨于平穩。PCNA在不同時間點的陽性表達情況見圖3D、E、F及表2。
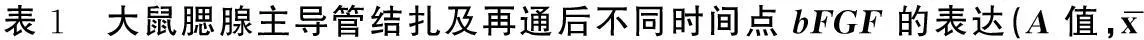
±s)
a:與0 d相比,P<0.05;b:與3 d相比,P<0.05; c:與5 d相比,P<0.05;*:Welch檢驗 #:Kruskal-Wallis檢驗

±s)
a:與0 d相比,P<0.05;b:與5 d相比,P<0.05;*:Welch檢驗

圖3 大鼠腮腺主導管結扎及再通術后不同時間點的PCNA
3討論
腮腺是口腔三大涎腺之一,其萎縮后的再生及功能的恢復較為復雜,本實驗通過對腮腺主導管進行結扎和再通,來建立腮腺萎縮和再生模型[4],在此過程中觀察到的典型變化為:主導管結扎后腮腺腺泡萎縮,數量減少、消失,導管樣結構增多,bFGF的吸光度值逐漸升高;主導管再通后導管樣結構減小,消失,腺泡細胞逐漸恢復正常,bFGF的吸光度值先升高再減低。對于腺體萎縮過程中,腺泡減少、消失,不同學者觀點不同,有人認為腺泡細胞分化成了導管樣結構[5-7]。有人認為是其自身凋亡所至,而半胱氨酸天冬氨酸蛋白水解酶在凋亡過程中起主要作用[8]。導管再通后腺泡細胞重新出現,對于新生的腺泡可能來源于殘留在萎縮腺體中的腺泡再分化,也可能來源于剩余導管細胞的增殖和再分化[4]。
堿性成纖維細胞生長因子(bFGF)是一種生物性極強的多肽因子,最早是1995年vanSettenGB在唾液中檢測到的。有研究證實[3]腮腺的腺泡細胞和導管上皮細胞可以產生bFGF,產生的bFGF存在于細胞外基質中。在正常狀態下并不活躍,一旦損傷刺激出現,其就被激活并大量釋放[9],且已存在的bFGF還會刺激分泌它的細胞產生更多的bFGF[10]。本研究觀察到腮腺主導管結扎1 d、3 d后,bFGF陽性表達增加,在第3天時達到峰值,隨后陽性表達降低但保持平穩,原因可能是因為當損傷刺激出現后,激發了細胞基質中bFGF的前體使其大量釋放,雖然產生bFGF的腺泡細胞的不斷萎縮,數量減少,但已經釋放出來的bFGF會刺激腺泡細胞產生更多的bFGF,但隨著大量腺泡細胞萎縮、消失,分泌功能降低,而導管上皮細胞分泌的bFGF較平穩,故總體bFGF表達下降。而主導管再通后隨著腺泡細胞的恢復、再生,分泌bFGF的量也增加,在導管再通3d時達到峰值,同時分泌的bFGF也為腺泡細胞的增生提供條件,但隨著損傷刺激去除的時間延長,腺體逐漸恢復正常,bFGF的表達也趨于穩定。主導管由結扎到再通,bFGF的表達部位由腺泡細胞的胞漿和基質,到腺泡細胞的基底膜和導管樣結構周圍,再到新生腺泡細胞的胞漿和導管內皮細胞,可能是由于腺泡細胞的萎縮凋亡,產生的導管樣結構作為分泌單位去分化的產物,在導管再通后又重新分化為腺泡和導管細胞[11]的緣故。
本實驗結果表明:主導管結扎1 d后,PCNA的表達開始有所增強,3 d后PCNA的陽性細胞數明顯增多,可看見大量細胞核有絲分裂像,在第5 d達到峰值,7 d后下降并保持穩定,而bFGF的分泌從1 d后開始增強,3 d達到峰值,隨后降低并保持穩定,說明bFGF能夠刺激細胞發生有絲分裂,是一種強絲裂原,并且可以調控和穩定細胞狀態,延長細胞存活期,這與Hom DB[12]和LObb RR[13]的觀點一致。主導管再通后,PCNA和bFGF的線性關系跟結扎組一致,筆者認為原因有可能是bFGF激發了導管樣結構向腺泡細胞轉化,刺激了新生腺泡細胞的增殖[10],還有可能是因為bFGF影響細胞周期,使更多量的細胞進入增殖狀態[14],但具體作用機制尚需進一步研究。值得一提的是,在上述過程中,高度分化的肌上皮細胞也發生有絲分裂,且數量逐漸增多,此與Redman的報道相一致[15]。
綜上,在腮腺主導管結扎和再通的過程中,腺泡細胞由萎縮、消失到再生、恢復正常狀態,腺泡細胞和導管樣結構相互轉化,bFGF與細胞增殖成正相關性。通過研究bFGF在腮腺萎縮及再生中的表達和意義,對唾液腺的萎縮治療提供新的指導意義。
參考文獻:
[1]Folkman J,klagskrun M.Angiogenic factors[J].Science,1987,235:442.
[2]Y Okazaki,H Kagami,T Hattori,et al.Acceleration of rat salivary glands tissue repair by basic fibroblast growth factor[J].Archives of Oral Biology,2000,45:911.
[3]Osamu Amano,Yoshino Yoshitake,Katsuzo Nishikawa,et al.Basic fibroblast growth factor in rat salivary glands[J].Cell Tissue Res,1993,273:467.
[4]Takahashi S,Schoch E,Walker NI.Origin of acinar cell regeneration after atrophy of the rat parotid induced by duct obstruction[J].Int J Exp Pathol,1998,79(5):293.
[5]Standish SM,Shafer WG.Serial histologic effects of rat submaxillary and sublingual salivary gland duct and blood vessel ligation[J].J Dent Res,1957,36(6):866.
[6]Tamarin A.Submaxillary gland recovery from obstruction.I.Overall changes andelectron microscopic alterations of granular duct cells[J].J Ultrastruct Res,1971,34(3):276.
[7]Tamarin A.Submaxillary gland recovery from obstruction.II.Electron microscopic alterations of acinar cells [J].J Ultrastruct Res,1971,34(3):288.
[8]Takahashi S,Gobe GC,Yoshimura Y,et al.Participation of the Fas and Fasligand systems in apoptosis during atrophy of the rat submandibular glands[J].Int J Exp Pathol,2007,88(1):9.
[9]Santiago FS,Lowe HC,Day FL,et al.Early growth response factor-1 induction by injury is triggered by release and paracrine activetion by fibroblast growth factor-2[J].Am J Pathol,1999,154:937.
[10]Schweigerer L,Neufeld G,Friedman J,et al.Capillary endothelial cells express basic flbroblast growth factor,a mitogen that promotes their owngrowth[J].Nature,1987(112):835.
[11]Takahashi S,Shinzato K,Nakamura S,et al.Cell death and cell proliferation in the regeneration of atrophied rat submandibular glands after duct ligation[J].Oral Pathol Med,2004,33(1):23.
[12]Hom DB,Maisel RH.Angiogenic growth factors:their effects and potential in soft tissue wound healing[J].Ann Otol Rhinol Laryngol,1992,101:349.
[13]LObb RR,Alderman ER,Fett JW.lnduction of angiongenesis bv bovine brain derived class heparinbinding growthfactor[J].Biochenistry,1985,24:49.
[14]周延沖,主編.多肽生長因子的基礎與臨床[M].北京:中國科學技術出版社,1992:26.
[15]Redman RS.Myoepithelium of salivary glands[J].Micros Res Tech,1994,27:25.
收稿日期:(2013-11-19)
文章編號:1007-4287(2015)03-0359-04
通訊作者*

