KDR基因多態性的杰出有氧耐力表型與運動應激誘導的循環microRNA差異表達譜的關聯研究
許英櫻,段立公,徐 思
●成果報告 Original Articles
KDR基因多態性的杰出有氧耐力表型與運動應激誘導的循環microRNA差異表達譜的關聯研究
許英櫻1,段立公2,徐 思3
目的:分析KDR基因SNP/rs1870377的A/A基因型的杰出有氧耐力表型與訓練誘導的循環miRNA表達特征的關聯。方法:試驗對象為33名現役國家級耐力項目男性運動員和58名體育教育專業男性大學生(二級運動員),均為漢族。遞增負荷法檢測最大攝氧量、個體乳酸閾;miRNAarray及qRT-PCR檢測訓練誘導的c-miRNA表達譜,Taqman法解析KDR基因SNP/rs1870377基因型,分析優勢基因型及其杰出耐力表型與訓練誘導的c-miRNA表達特征的關聯。結果:A/A基因型的杰出耐力表型差異表達17條c-miRNA,9條上調,8條下調;miRNA同步調控AMPK、p53、PPAR、MAPK、mTOR等信號通路多個基因表達。結論:差異表達的miRNA的調控作用同步上調AMPK-PGC-1α通路和p53通路功能,促進線粒體合成和有氧代謝能力,在A/A基因型上調VEGF通路活性增強心肌/骨骼肌供血條件下進一步提高有氧代謝供能效率,對杰出耐力表型的形成具有促進作用;miRNA的調控作用與rs1870377的A/A基因型的杰出有氧耐力表型存在關聯,二者可作為預測有氧耐力發展潛力的表觀遺傳學分子標記,聯合應用于運動選材。
杰出有氧耐力表型;血管內皮生長因子受體2;單核苷酸多態性;運動應激;循環microRNA
杰出有氧耐力的遺傳優勢主要體現在優勢基因型及促進優勢基因型表型化的基因表達調控模式,后者主要是表觀遺傳學基因調控機制[1],在訓練應激誘導下條件性地影響基因型優勢向表型優勢的傳遞[2]。結合優勢基因型,分析運動應激誘導的基因表達調控模式與杰出運動能力表型的關聯,可以針對個體評估其是否具有發展杰出運動能力的遺傳潛質。
KDR基因又稱為VEGFR2,是VEGF調節血管內皮細胞增殖、存活、遷移和通透性改變等的主要受體,參與調節機體對耐力性訓練的適應[3]。KDR基因SNP/rs1870377位于KDR基因第11外顯子上,該位點A-T堿基替換使KDR蛋白質氨基酸序列發生Gln/His替換,KDR活性發生上調[4],強化了下游通路的作用強度。研究表明,KDR基因SNP/rs1870377與杰出有氧耐力具有顯著關聯[4],可能是發展有氧耐力的優勢基因,但其有氧耐力表型差異十分顯著[5],訓練應激誘導的表觀遺傳學調控機制對SNP的作用可能是影響其表型優勢的主要原因。
microRNA(miRNA)通過多種途徑調控應激適應通路中靶基因的表達,在機體對環境應激因素的適應中發揮重要作用[6]。應激因素誘導miRNAs獨立表達,并與靶基因mRNA上的調控位點互補結合調節基因選擇性表達[7]。miRNAs自身表達模式具有穩定的遺傳性個體差異,其對應激適應信號通路關鍵蛋白基因表達的調控作用改變了機體的適應方式和敏感性,產生表型差別[8]。
組織內miRNAs分泌進入血液循環成為循環miRNA(circulating miRNA,c-miRNA),具有內分泌樣的遠距離調控作用。在運動性適應的不同狀態下,c-miRNA表達水平會發生特征性改變并與適應效果相關,推測其可能是機體應答過程中整合多系統適應性反應的關鍵因子[9]。miRNA與c-miRNA在表達種類和水平上密切相關,c-miRNA可以作為反映miRNA調控作用的生物標記[10]。
本研究比較耐力項目的現役國家級運動員與體育教育專業大學生(中長跑項目二級運動員)的有氧耐力水平與KDR基因SNP/rs1870377基因型分布和運動應激誘導的c-miRNA表達譜的差異,分析SNP優勢基因型的杰出有氧耐力表型與運動應激誘導的c-miRNA表達特征的關聯,探討c-miRNA作為預測和評估杰出有氧耐力的表觀遺傳學分子標記與SNP聯合應用于運動選材的可行性。
1 研究對象與方法
1.1 研究對象
杰出有氧耐力組入選標準參考席翼標準[11]及Μ.A.RIVERA的標準[12]:(1)耐力性項目國家健將級以上現役運動員;(2)未達到健將級,但相對最大攝氧量(R-O2max)>73 mL/kg·min的現役運動員。根據該標準,杰出有氧耐力組(Elite Endμrance Athlete,EEA組):33名男性現役運動員,運動專項為鐵人三項賽(成都軍區鐵人三項隊,17人)和公路自行車(河北省自行車隊,16人)。一般有氧耐力組入選標準為2010年度當年獲得中長跑二級運動員資格的體育教育專業大學生。根據該標準,一般有氧耐力組(College Student level2,CS2組):成都體育學院本科1~3年級58名男性體育教育專業大學生(見表1)。

表1 杰出耐力水平運動員和普通水平運動員基本情況表Table1 characteristics of male participants in EEA group and CS2 group
1.2 研究方法
1.2.1 最大攝氧量和個體乳酸閾測定 逐級遞增負荷運動方式測定最大攝氧量(O2max),使用跑臺(RUN Μed 700,Technogym,意大利;cosmos pulsar4.0,德國)和運動氣體代謝分析儀(CPX,JAEGER;metalyzer,德國)。受試者測試前熱身3 min,正式試驗采用預設的Bruce方案,即每3 min增加速度或坡度直至力竭,通氣數據由氣體代謝分析儀自動采集。同步檢測個體乳酸閾(ILT),分別取安靜狀態下,每級負荷后即刻,恢復期第2、5、8、10、15 min血樣測定血乳酸值;取中指指尖血20 μL,采用YSI1500便攜式血乳酸自動分析儀測定血乳酸值;采用Stegmann方法判定ILT[13]。
1.2.2 KDR基因SNP/rs1870377基因型解析 取靜脈血2 mL,EDTA抗凝,OΜEGA公司全血總DNA提取專用試劑盒提取受試者DNA,要求純度為OD260/OD280=1.8~2.0。采用rs1870377 TaqΜan SNP檢測試劑盒(TaqΜan SNP Genotype Assay Cat# 4351379),按照說明書配制反應體系及設定參數。PCR反應體系(25 μL):2X Genotyping Μaster mix,12.5 μL;20X SNP kit(Probe/Primer mix)5 μL;DNA(20 ng/μL);ddH2O。PCR循環參數:95℃10 min,(95℃15 s,60℃1 min)×40個循環。7900HT型高通量(ABI公司)實時熒光定量PCR系統上進行PCR反應,SDS2.2.1軟件分析基因分型結果。
1.2.3 運動應激誘導的c-miRNA及其相對表達量測定O2max測試前及測試后1 h內分別取靜脈血5 mL(EDTA抗凝)測定c-miRNA相對表達量,計算表達量變化倍率(fold change),參照Davidsen運動應激調控的c-miRNA篩選標準[15]:fold change>1.5或<0.67的c-miRNA即為運動應激調控的c-miRNA。
(1)血漿總RNA提取。TRIZOL法提取血漿總RNA,紫外分光光度儀測定RNA純度和濃度,OD260/280>1.9說明提取的總RNA純度較好,甲醛變性瓊脂糖電泳檢測提取的RNA完整性較好,沒有發生降解。
(3)實時熒光定量PCR(qRT-PCR)驗證差異表達c-miRNA相對表達量。c-miRNA莖環反轉錄合成cDNA,反轉錄引物由北京六合華大基因公司合成,20 μL反應體系(5×First Strand synthesis Buffer,4 μL;dNTPmix1μl;RNase Inhibitor,40 units;ReverseTranscriptase(Μ-ΜLV),1 μL;Stem-loop RTPrimer,1 μL;Total RNA500 ng;RNase-free ddH2O)。65℃加熱5 min,放入冰中2 min,放置PCR儀16℃熱激30 min,42℃60 min,85℃5 min,停止反轉錄。
qRT-PCR檢測c-miRNA表達水平,miRNA定量引物由北京六合華大基因公司合成,反應體系按照SYBR?Premix Ex TaqTΜⅡ(Perfect Real Time)說明書進行配置。使用Bio-Rad iCycler PCR System進行Real Time PCR反應,程序:95℃5 min,95℃10 s,60℃30 s,40cycle,以上循環結束后進行65℃~95℃的融解曲線分析。每個樣品平行3次,溶解曲線為單一峰(見圖1),按照2-ΔΔCt計算樣品的相對表達豐度。
圖1 實時熒光定量PCR檢測c-miRNA的擴增動力學曲線。Figure1 Kinetic curves of c-miRNA Gene qRT-PCR amplification.
1.2.4 差異表達的c-miRNA的篩選和生物信息學分析 比較EEA組和CS2組的運動應激誘導的c-miRNA表達變化率,以組間差異在1.5倍以上的c-miRNA作為差異表達的c-miRNA。利用Targetscan數據庫、miRBase數據庫和miRanda數據庫預測靶基因,取交集作為靶基因集合。利用KEGG數據庫和IPA數據庫對靶基因集合進行GO分析和pathway分析(見圖1)。
1.3 數據統計處理
數據處理采用SPSS17.0軟件,Hardy-Weinberg遺傳平衡檢測和各基因型組間分布采用R*C列聯表X2檢驗。各項指標數據均采用M±SD表示,均數間比較采用單因素方差分析,P<0.05表示兩組間的差異有統計學意義。兩組數據之間的相關性分析采用Bivariate過程,計算Pearson相關系數并用r表示。
2 結果
EEA組和CS2組受試者群體rs1870377基因型分布頻率卡方檢驗符合Hardy-Weinberg遺傳平衡(P>0.05),該群體具有代表性。
2.1 KDR基因SNP/rs1870377基因型在EEA組和CS2組的分布頻率比較
KDR基因SNP/rs1870377基因型的分布頻率在EEA組和CS2組的差異具有統計學意義(P<0.05),且A/A基因型與杰出有氧耐力表型的關聯具有統計意義(P<0.05)(見表2)。
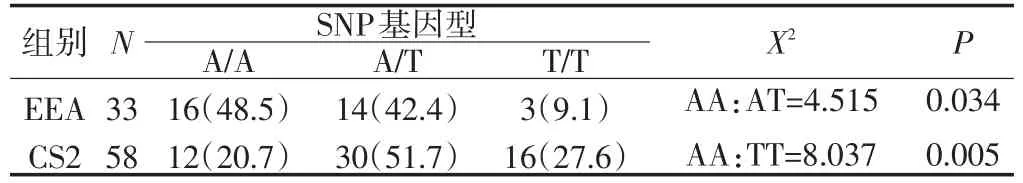
表2 KDR基因SNP/rs1870377基因型分布頻率比較/%Table2 Comparison of genotypic frequencies of rs1870377 between EEA group and CS2 group/%
2.2 EEA組和CS2組各基因型有氧耐力指標的比較

表3 EEA組和CS2組各基因型有氧耐力指標的比較Table3 Comparison of the aerobic capacity values by rs1870377 genotypes between EEA group and CS2 group
2.3 A/A基因型杰出耐力表型差異表達的c-miRNA及其靶基因富集通路分析
2.3.1 A/A基因型杰出耐力表型差異表達的c-miRNA 與CS2組相比,A/A基因型EEA組差異表達38條c-miRNA,其中表達水平變化率超過2.0的有17條,9條上調,8條下調(見表4)。
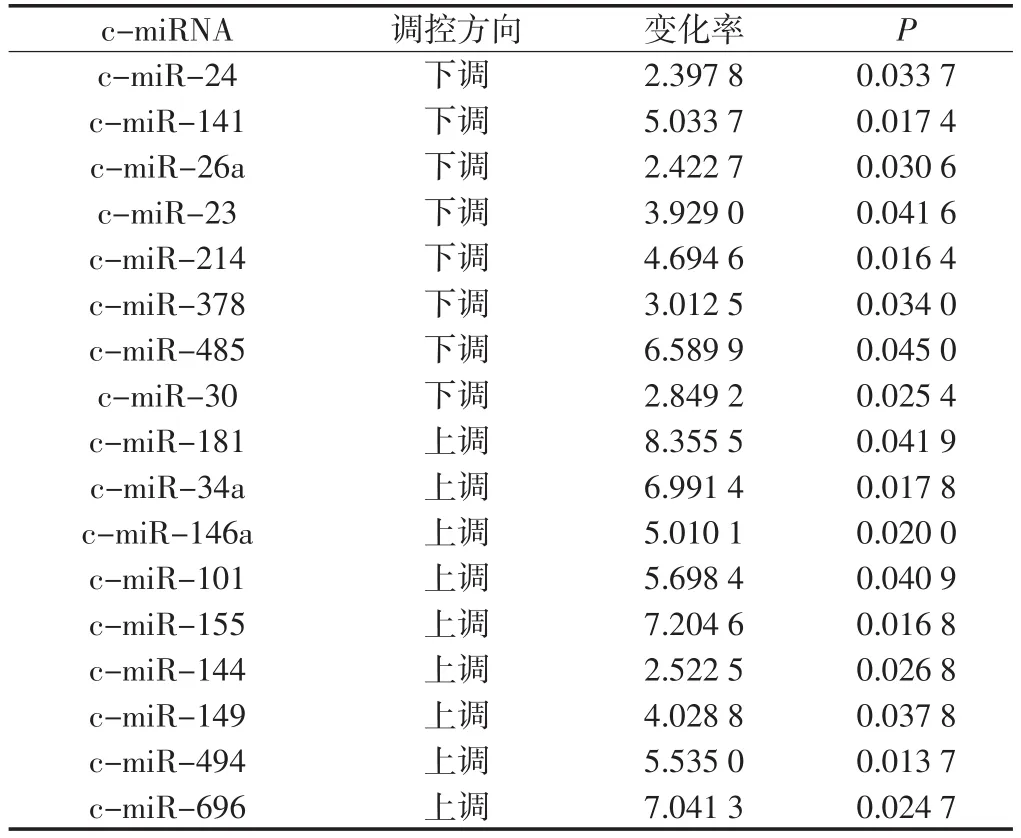
表4 A/A基因型杰出耐力表型差異表達的c-miRNATable4 Differential expressed c-miRNAs of A/A genotype
2.3.2 差異表達的c-miRNA的表達量變化與有氧耐力指標的相關性分析 計算各差異表達的c-miRNA相對表達量變化倍率與O2max及ILT的Pearson系數。結果顯示,A/A基因型O2max水平與c-miRNA-34a和c-miR-146a顯著相關,相關系數分別是r=0.884(P<0.01)和0.800(P<0.01)(見圖2)。
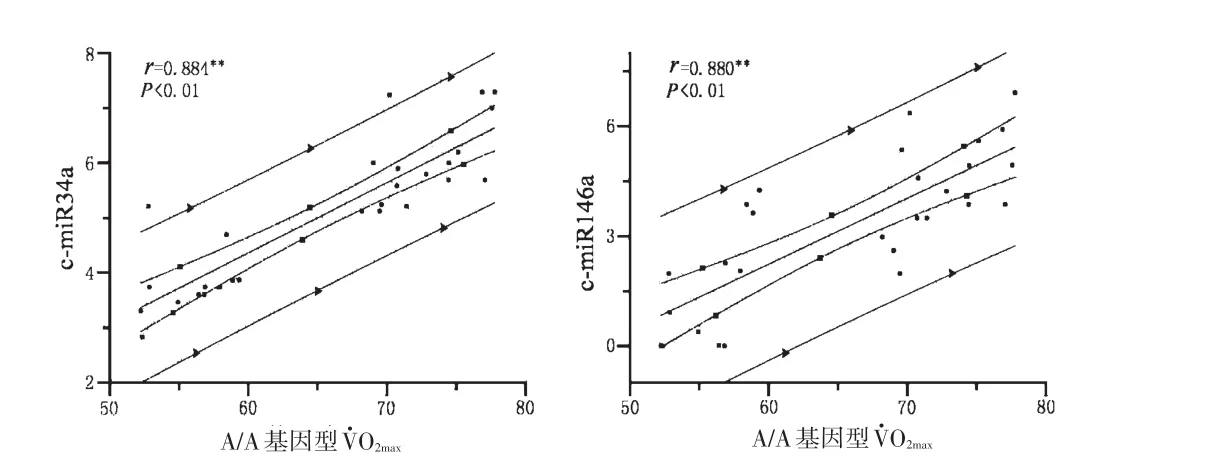
圖2 KDR基因SNP/rs1870377的A/A基因型O2max與c-miR34a及c-miR146a的相關性分析Figure2 Alterations in c-miR34a and c-miR146a directly correlate with changes inO2maxof A/A genotype
3 討 論
本研究分析了KDR基因SNP/rs1870377的優勢基因型,并比較了具有相同SNP優勢基因型的杰出耐力表型與一般耐力表型的運動應激誘導的c-miRNA的表達譜差異。結果表明:A/ A基因型可能是rs1870377的有氧耐力優勢基因型,其杰出耐力表型差異表達17條c-miRNA,9條上調,8條下調。多數據庫交叉預測靶基因并進行GO分析和pathway分析表明,差異表達的miRNA所調控的靶基因功能富集通路以及miRNA對上述信號通路的調控作用與SNP引起的KDR基因功能改變有關,其調控作用特征支持EEA組的高水平O2max和ILT的形成。運動應激誘導的c-miRNA差異表達譜可以作為杰出有氧耐力相關的表觀遺傳學分子標記與KDR基因SNP/rs1870377基因型分析聯合應用于遺傳選材。
I.I.AHΜETOV等[4]將471名男性運動員根據所從事項目的有氧耐力主導水平分為4組,對照群體為603名健康人,比較KDR基因rs1870377各基因型在不同耐力水平項目運動員群體及健康人群體之間的分布差異。分析各基因型與有氧耐力水平差異的關聯性發現,472Gln等位基因在男性耐力運動員群體中的分布頻率顯著高于對照組(36.8%vs27.4%,P=0.000 6),而且Gln/Gln基因型在23名杰出有氧耐力運動員中分布頻率顯著高于其他耐力水平運動員及對照組。12名女運動員中,攜472Gln等位基因者的相對O2max(mL/min/kg)顯著高于His/His基因型者。對23名滑雪運動員及45名健康人進行肌肉活檢發現,472Gln等位基因攜帶者慢肌百分比含量在運動員及對照組中均顯著高于His/His攜帶者,證明A基因型與較高的慢肌纖維比例表型存在關聯。聶晶等[5]分析了KDR基因rs1870377各基因型與102名中國北方漢族男子18周長跑訓練前后的O2max,以及12 km/h跑速下的RE和心室結構功能指標變化差異的關聯關系發現,A/T、A/A基因型者在部分心室結構和/或功能指標均表現出較好的適應性變化,有助于增強心臟泵功能。上述研究結果均提示,KDR基因SNP/rs1870377的A基因型與較強的有氧運動能力存在關聯。本研究結果顯示:A/A基因型在EEA組的分布頻率顯著高于CS2組;CS2組A/A基因型攜帶者的O2max顯著高于T/T基因型,與前二項研究的結論一致。VEGF與KDR結合,通過PI3K-Akt-eNOS途徑和花生四烯酸代謝途徑調控呼吸道和毛細血管平滑肌舒張及內皮細胞遷移和毛細血管增生[3],促進肺通氣和肌組織血液灌流,提高心肌/骨骼肌內氧彌散水平,增強有氧能力,是運動性適應的重要機制。rs1870377位點A-T堿基替換使KDR蛋白質氨基酸序列發生Gln/His替換,KDR活性發生上調[4],增強了VEGF與KDR結合后對下游PI3K-Akt-eNOS途徑和花生四烯酸代謝途徑的激活水平,促進肺通氣和肌組織血液灌流,提高心肌/骨骼肌內氧彌散水平,增加動靜脈氧差,提高O2max水平。CS2組A/A基因型O2max水平顯著高于其他基因型,可能是Gln/Gln增強KDR功能的效應。E.T.HOWLEY等[16]研究表明,O2max在初始階段與成績提高有平行關系,而在高水平運動群體則不存在這種平行關系。本研究結果顯示,EEA組O2max水平在rs1870377各基因型間沒有顯著差異,與E.T.HOWLEY等的研究結果一致。推測其原因可能是,優秀運動員經過長期刻苦訓練,自身遺傳優勢已發揮到極限,亞極限負荷下機體氧利用效率取代O2max成為影響有氧運動能力的關鍵因素[11]。
GO分析和pathway分析結果表明,A/A基因型的杰出耐力表型差異表達的miRNA所調控的靶基因主要富集于AΜPK信號通路、p53通路、p38-ΜAPK通路和mTOR通路(見表5),不同程度地增強以上通路對運動訓練應激的敏感性。miRNA調控作用特征分析表明,AΜPK-PGC-1α通路和p53通路活性同步上調,這一特征與rs1870377引起的KDR基因功能變化存在關聯,可能是促進KDR基因SNP/rs1870377的A/A基因型的杰出耐力形成的重要調控特征。

表5 A/A基因型杰出耐力表型差異表達的miRNA調控的靶基因及其富集的信號通路Table5 The target genes and their enriched pathway of differential expressed c-miRNAs of A/A genotype in EEA group
靶基因分析顯示,A/A基因型差異表達的miRNA調控的靶基因包含幾乎全部AΜPK-p38-PGC-1α通路和p53通路的關鍵調控基因(見表5)。TAK1(AΜPKK)、STRAD、AΜPK、p38、CREB、ERR和SIRT1是AΜPK-p38-PGC-1α通路的核心功能蛋白,p53、SCO1和ATΜ是p53通路核心功能蛋白,TFAΜ、TFB1/ 2Μ、NFAT、ACO、LPL和RXR是PGC-1α調控線粒體合成與脂代謝的重要功能基因,下調miR-24、miR-141、miR-26a、miR-23、miR-214、miR-485和miR-30同時促進以上基因的表達。PP2C/ PP2CA是AΜPK和p38的共同抑制因子,PTP抑制p38途徑活化,ΜBP是PGC-1的阻遏因子,SUΜO2/3促進PGC-1的泛素化降解,ΜDΜ2是p53途徑的抑制因子,ACC和HDAC是AΜPK-PGC-1α通路功能抑制因子,上調miR-181、miR-34a、miR-101、miR-155、miR-144和miR-494均同步抑制上述基因表達。研究表明:miR-149抑制PARP-2,促進SIRT1-PGC-1α通路活性和線粒體合成[17];運動訓練誘導miR-181表達水平增高,與線粒體有氧代謝能力增強存在關聯[18];上調miR-696表達促進PGC-1α通路活性[19];下調miR-378[20]和miR-23[18],可以促進PGC-1α通路活性及其下游ALAS1、CS、CytC等的表達;miR-144同步激活AΜPK和TIGAR[21-22];miR-34a是p53調控糖代謝的主要分子[23]和p53激活分子標志[24]。綜合分析上述miRNA的調控作用提示,A/A基因型杰出耐力表型的AΜPK-PGC-1α通路和p53通路的活性同步上調。A/A基因型杰出耐力表型的調控特征與rs1870377引起的KDR基因功能改變存在關聯,并且對其杰出耐力表型的形成具有促進作用。rs1870377使KDR活性增強,促進肺通氣和肌組織血液灌流,提高心肌/骨骼肌供氧水平。在供氧充分的條件下,線粒體脂肪酸β氧化代謝能力成為發展有氧耐力水平的限制因素。
PGC-1α是運動應激誘導的線粒體合成及其活性增強的主要調控因子[25]。AΜPK促進NRF1/2表達,并通過p38-ΜAPK活化PGC-1α,PGC-1α協同NFR1/2共同促進TFAΜ、TFB1Μ和TFB2Μ的轉錄和表達[26]。TFAΜ啟動mtDNA的復制并保護其免受ROS的損傷,PGC-1α和NRF1/2還啟動線粒體合成與代謝相關基因的復制,使線粒體蛋白質與脂質比例增高,促進線粒體生物合成與功能上調[27]。同時,PGC-1α調控PPARα/δ,促進脂肪酸β氧化和慢肌纖維特異蛋白的表達,提高心肌骨骼肌有氧工作能力[19,28]。miRNA調控AΜPK-p38-PGC-1通路活性上調促進心肌骨骼肌有氧代謝機能重塑,使心肌骨骼肌工作能力與A/ A基因型提高了的供氧能力匹配,最大限度發揮心肌骨骼肌的生物機械效能。
p53通路的同步激活對于提高線粒體脂肪酸β氧化代謝能力十分重要[29],KDR-PI3K-Akt通路顯著促進無氧酵解功能[30]。在不缺氧的條件下,糖酵解是不經濟的供能方式,葡萄糖氧化供能不僅消耗糖原儲備,還抑制脂肪酸β氧化,不利于心肌/骨骼肌維持和增強有氧工作能力。p53通路是平衡糖代謝和脂代謝的重要調控途徑,p53誘導TIGAR表達[31],抑制葡萄糖進入糖酵解途徑,將糖代謝導向戊糖磷酸旁路。由于糖酵解是葡萄糖有氧氧化的必經步驟,p53從底物選擇的水平促進線粒體脂肪酸β氧化供能[32]。
c-miRNA-34a和c-miR-146a與A/A基因型的O2max水平顯著相關,說明miR34a與miR-146a在A/A基因型的杰出有氧耐力形成中發揮重要的作用。miR34a是p53通路激活的分子標志,miR-146a上調抑制PP2C/PP2CA、SUΜO2/3和ΜBP的基因表達,促進AΜPK-p38-PGC-1α途徑的活性。A.L.BAGGISH等[10]發現,c-miR-146a表達水平與O2max正相關,這與本研究結果一致。這2個c-miRNA的表達特征進一步說明,AΜPK-p38-PGC-1α通路與p53通路的活性協同上調對A/A基因型的杰出有氧耐力表型形成的重要性。
miRNA是唯一參與應激應答調控的表觀遺傳學基因調控機制,其轉錄后調控作用改變了適應性基因表達的時序特征和作用強度。c-miRNA整合多系統的基因表達調控,對機體適應性反應的系統協調性具有重要作用。目前對于c-miRNA的外泌組織和靶組織缺乏了解[7],因此,本研究分析應激誘導的c-miRNA表達水平變化可以了解其對應的miRNA的綜合表達變化情況及其與杰出有氧耐力表型的關聯,但無法針對具體靶器官做進一步深入的功能性解讀。同時,本研究在研究對象數量、性別構成等方面存在局限性,研究結果還需要在更廣泛的樣本群體中進一步驗證。
4 結論
KDR基因SNP/rs1870377的A/A基因型可能是發展有氧耐力的優勢基因型,其杰出耐力表型在訓練應激誘導下差異表達17條c-miRNA,其調控作用特征與rs1870377引起的KDR基因的功能改變有關聯,對杰出耐力表型的形成具有促進作用。運動應激誘導的c-miRNA差異表達譜可以作為杰出有氧耐力相關的表觀遺傳學分子標記,與KDR基因SNP/rs1870377基因型分析聯合應用于遺傳選材。
[1]馬力宏.人類體質與運動能力的遺傳學基礎[J].天津體育學院學報,2001,16(04):1-5.
[2]于紅.表觀遺傳學:生物細胞非編碼RNA調控的研究進展[J].遺傳,2009(11):1077-1086.
[3]康從民,王大偉,呂英濤,等.血管內皮生長因子受體-2所介導信號通路的研究進展[J].生物化學與生物物理進展,2009,36(10):1267-1274.
[4]AHMETOV I I,HAKIMULLINA A M,POPOV D V,et al.Association of the VEGFR2 gene His472Gln polymorphism with endurance-related phenotypes[J].Eur J Appl Physiol,2009,107(1):95-103.
[5]聶晶,胡揚,席翼,等.VEGF及其受體基因多態性與有氧運動能力表型的關聯研究[J].體育科學,2010,30(8):77-84.
[6]程謨斌.細胞應激中基因激活的表觀遺傳調控機制[D].北京:北京協和醫學院,2010.
[7]BANZET S,CHENNAOUI M,GIRARD O,et al.Changes in circulating microRNAs levels with exercise modality[J].J Appl Physiol,2013,115(9):1237-1244.
[8]胡士軍,楊增明.miRNAs的表達調控機制[J].生物化學與生物物理進展,2008(05):483-487.
[9]BYE A,R SJ H,ASPENES S T,et al.Circulating microRNAs and aerobic fitness--the HUNT-Study[J].PLoS One,2013,8(2):e57496.
[10]BAGGISH A L,HALE A,WEINER R B,et al.Dynamic regulation of circulating microRNA during acute exhaustive exercise and sustained aerobic exercise training[J].J Physiol,2011,589(Pt16):3983-3994.
[11]席翼.ACE基因多態性及與有氧運動能力的關聯研究[D].北京:北京體育大學,2004.
[12]RIVERA M A,PE RUSSE L,SIMONEAU J A,et al.Linkage between a muscle-specific CK gene marker and VO2max in the HERITAGE Family Study[J].Med Sci Sports Exerc,1999,31(5):698-701.
[13]STEGMAN H,KINDERMANN W,SCHNABEL A.International Journal of Sports Lactate kinetics and individual anaerobic threshold[J].International Journal of Sports Medicine,1981,2:160-165.
[14]冷志勇,霍笑敏,李梅,等.跑節省化(RE)和無氧閾評價耐力訓練效果的比較研究[J].首都體育學院學報,2012(02):181-183.
[15]DAVIDSEN P K,GALLAGHER I J,HARTMAN J W,et al.High responders to resistance exercise training demonstrate differential regulation of skeletal muscle microRNA expression[J].J Appl Physiol,2011,110(2):309-317.
[16]HOWLEY E T,BASSETT D R JR,WELCH H G.Criteria for maximal oxygen uptake:review and commentary[J].Med Sci Sports Exerc,1995,27(9):1292-1301.
[17]MOHAMED J S,HAJIRA A,PARDO P S,et al.MicroRNA-149 inhibits PARP-2 and promotes mitochondrial biogenesis via SIRT-1/ PGC-1α network in skeletal muscle[J].Diabetes,2014,63(5):1546-1559.
[18]WANG X H.MicroRNA in myogenesis and muscle atrophy[J].Curr Opin Clin Nutr Metab Care,2013,16(3):258-266.
[19]AOI W,NAITO Y,MIZUSHIMA K,et al.The microRNA miR-696 regulates PGC-1{alpha}in mouse skeletal muscle in response to physical activity[J].Am J Physiol Endocrinol Metab,2010,298(4):E799-806.
[20]CARRER M,LIU N,GRUETER C E,et al.Control of mitochondrial metabolism and systemic energy homeostasis by microRNAs 378 and 378*[J].Proc Natl Acad Sci U S A,2012,109(38):15330-15335.
[21]TURCZYNSKA K M,BHATTACHARIYA A,SALL J,et al.Stretch-sensitive down-regulation of the miR-144/451 cluster in vascular smooth muscle and its role in AMP-activated protein kinase signaling[J].PLoS One,2013,8(5):e65135.
[22]CHEN S,LI P,LO J,et al.MiR-144 inhibits proliferation and induces apoptosis and autophagy in lung cancer cells by targeting TIGAR[J].Cell Physiol Biochem,2015,35(3):997-1007.
[23]KIM H R,ROE J S,LEE J E,et al.p53 regulates glucose metabolism by miR-34a[J].Biochem Biophys Res Commun,2013,437(2):225-231.
[24]DO M T,KIM H G,CHOI JH,et al.Metformin induces microRNA-34a to downregulate the Sirt1/Pgc-1α/Nrf2 pathway,leading to increased susceptibility of wild-type p53 cancer cells to oxidative stress and therapeutic agents[J].Free Radic Biol Med,2014,74:21-34.
[25]張國華.AMPK/PGC-1α通路與運動誘導的骨骼肌線粒體生物合成[J].廣州體育學院學報,2007,27(6):100-104.
[26]STEINBERG G R,KEMP B E.AMPK in Health and Disease[J].Physiol Rev,2009,89(3):1025-1078.
[27]LEE-YOUNG R S,GRIFFEE S R,LYNES S E,et al.Skeletal muscle AMP-activated protein kinase is essential for the metabolic response to exercise in vivo[J].J Biol Chem,2009,284(36):23925-23934.
[28]施鵬飛.DICER基因微小RNA結合區域單核苷酸多態與有氧運動能力的關聯性研究[J].西安體育學院學報,2014(4):469-475.
[29]VIBHUTI A,MURALIDHAR K,DWARAKANATH B S.Differential cytotoxicity of the glycolytic inhibitor 2-deoxy-D-glucose in isogenic cell lines varying in their p53 status[J].J Cancer Res Ther,2013,9(4):686-692.
[30]SHEN W,CHEN G,DONG R,et al.MicroRNA-21/PTEN/Akt axis in the fibrogenesis of biliary atresia[J].J Pediatr Surg,2014,49(12):1738-1741.
[31]BOLAN OS J P.TIGAR's promiscuity[J].Biochem J,2014,458(3):e5-7.
[32]SU Y F,YANG S H,LEE Y H,et al.Aspirin-induced inhibition of adipogenesis was p53-dependent and associated with inactivation of pentose phosphate pathway[J].Eur J Pharmacol,2014,738:101-110.
Relationship of Elite Endurance Phenotype of KDR Gene Polymorphism with Exercise Induced Circulating Mi?croRNAProfile
XU Yingying1,DUAN Ligong2,XU Si3
(1.School of PE,Sichuan Normal University,Chengdu 610101,China;2.Sport Hospital,China Institute of Sports Medicine,Beijing 100061,China;3.Sichuan Academy of Medical Sciences and Sichuan Provincial People's Hospital,Chengdu 610031,China)
Objective:To explore the correlation between the Elite endurance phenotype of A/A genotype of KDR gene rs1870377 and the differential expression profile of c-miRNA induced by exercise.Method:33 active elite athletes(national grade)and 58 student athletes(grade 2)were engaged in this test.O2maxand ILT were measured.rs1870377 of KDR gene and differential expression profile of c-miRNAs induced by exercise were detected.Targetscan,mi-Randa,and miRBase were used to predict target genes of those miRNAs,and pathway analysis was performed for target gene by KEGG and IPA.Results:There were 17 c-miRNAs which regulated the pathway of AMPK,p53,PPAR,MAPK,mTOR,and their regulating characters were related to the functions of KDR enhanced by A/A genotype,which were validated to promote the formation of the elite endurance.Conclusions:Cooperated with rs1870377,the profile of c-miRNAs induced by exercise can be used as a biomarker on forecasting and valuing the potential of aerobic endurance.
elite endurance phenotype;KDR gene;single nucleotide polymorphism;exercise stress;circulating microRNA
G 804.2
:A
:1005-0000(2015)02-121-06
10.13297/j.cnki.issn1005-0000.2015.02.006
2014-12-25;
2015-02-16;錄用日期:2015-02-17
國家科技攻關項目(項目編號:2005BA904)
許英櫻(1980-),女,河南洛陽人,講師,研究方向為體育教育與運動訓練的分子生物學機制。
1.四川師范大學體育學院,四川成都610100;2.國家體育總局運動醫學研究所體育醫院,北京100061;3.四川省醫學科學院四川省人民醫院,四川成都610031。

