乳腺癌髓系來源抑制細胞中吲哚胺2,3-雙加氧酶表達與Tregs分布關系及臨床意義*
黃亞瓊, 趙慶麗, 張鋒軍, 顧麗萍
(中國人民解放軍蘭州軍區總醫院乳腺科, 甘肅 蘭州 730050)
腫瘤的產生是多步驟、多因素參與的結果,其中腫瘤細胞使機體形成的免疫耐受在腫瘤的發生、發展中發揮著重要作用。正常組織細胞在發生惡性轉變的過程中都會出現一些異常物質表達或正常物質表達量的改變,而在機體免疫功能正常的情況下這些異常物質會激活免疫相關的特異性T細胞[1],以清除這些發生惡性轉化的細胞,維持內環境的穩態,防止腫瘤的發生。人體中幾乎所有的腫瘤均存在相應的逃避免疫監視機制[2],因此研究腫瘤免疫耐受產生機制,對于腫瘤的免疫治療、腫瘤預防有重大意義[3]。多項研究顯示[4],髓系來源抑制細胞中吲哚胺2,3-雙加氧酶(IDO)表達,可能參與腫瘤免疫耐受的形成,但對于髓系來源的抑制細胞是如何導致腫瘤免疫耐受產生的機制仍不甚了解。本研究分析腫瘤組織中免疫抑制細胞IDO表達與Foxp3+Tregs分布的關系,初步探索乳腺癌免疫耐受形成的相關可能機制。
1 材料與方法
1.1 實驗材料:選取我院腫瘤乳腺外科2009年6月至2012年9月病例120例,術后經病理證實為原發性導管侵潤癌,患者均為女性,年齡在30-64歲,平均48歲;絕經68例,未絕經52例;組織學分級:Ⅰ級24例,Ⅱ級50例,Ⅲ級46例;臨床分期:Ⅰ期20例,Ⅱ期74例,Ⅲ期26例;手術取樣,術前所有患者均未接受任何放療及化療治療。
1.2 方 法
1.2.1 免疫組化單染SP法:將獲得的乳腺癌標本石蠟包埋、切片。常規免疫組化染色,脫蠟后去除內源性過氧化物酶,沖洗后進行切片修復、暴露,依次滴加特異性一抗、二抗并孵育,最后在切片上滴加DAB顯色并用蘇木素復染。
1.2.2 免疫組化雙染SP法:采用免疫組化雙染技術,試劑來自美國 California Biotech Inc公司,對樣本CD33+MDSCs中IDO表達情況進行檢測,操作嚴格按照說明書進行。
1.2.3 免疫組化的結果評定:由兩位經驗豐富的病理科醫生分別雙盲閱片,在高倍鏡(400*)下隨機選取10個視野,每個視野計數100個細胞。按陽性細胞在所占細胞百分比計分:小于5%計0分;6%-25%計1分;26%-50%計2分;51%-75%計3分;大于75%計4分。規定0-2分為表達缺失,大于2分則為陽性表達。CD33定位于胞漿和胞核,Foxp3主要定位于胞核,如存在二者表達,則細胞呈現不同程度棕黃色。乳腺癌標本中,免疫組化雙染陽性細胞均呈現為胞漿淡紅色、胞核紫黑。CD33+MDSCs樣本中IDO的表達情況統計,仍按上述統計標準記錄。
1.3 統計學分析:采用統計學軟件SPSS16.0進行統計分析,計數資料、率的比較采用χ2檢驗,檢測水準設定為 0.05。
2 結果
2.1 乳腺癌癌組織中MDSCs IDO表達與臨床病理之間的聯系:癌組織中MDSCs IDO的表達與患者年齡、是否絕經、腫瘤大小和組織學分級無明顯相關性(P>0.05),但與腫瘤是否出現轉移有密切聯系(P<0.05)。見表1。
2.2 乳腺癌中CD33+MDSCs IDO表達與Foxp3+調節性T細胞(Tregs)分布的關系:癌組織中CD33+MDSCs IDO表達的樣本Foxp3+Tregs分布比例也較高,差別有統計學意義(P<0.05)。見表2。
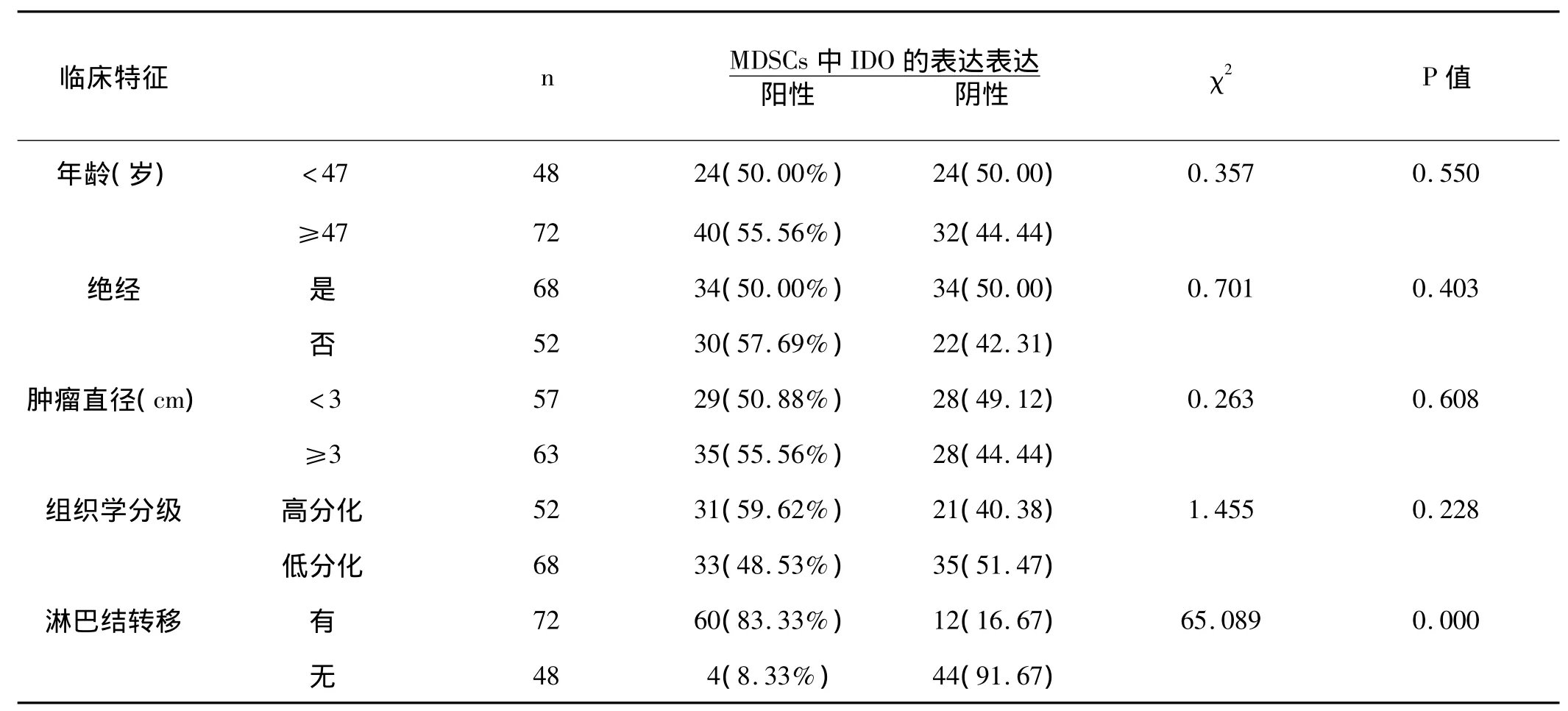
表1 乳腺癌中MDSCs中IDO表達與臨床病理之間的聯系 n(%)

表2 CD33+MDSCs IDO表達與Foxp3+Tregs分布之間的影響
3 討論
腫瘤對正常機體來說是一種異物,必然會引起特異性免疫反應,對腫瘤細胞的生長產生抑制作用。但許多研究表明[5],在腫瘤發生后機體的免疫系統并不針對腫瘤產生特異性免疫反應清除腫瘤細胞,這表明患者機體對腫瘤存在產生了免疫耐受。本研究前期觀察中我們發現,乳腺癌癌組織中CD33+MDSCs表達的IDO,能夠促進腫瘤細胞出現免疫抑制,且其表達水平的高低跟乳腺癌患者預后密切相關[6,7]。肝癌的相關研究[8]中也發現IDO表達高低與肝癌的不良預后密切相關,推測其可以作為判斷肝癌預后的指標之一。MDSCs細胞來源于骨髓中不同發育階段的抗原呈遞細胞,最早在老鼠體內發現[9],已有多項研究證明MDSCs能夠促進腫瘤細胞免疫耐受的產生。
IDO是存在于細胞內的一種免疫抑制酶,專門由樹突細胞及其他髓樣細胞表達,能夠降解特異性T細胞增值所必須的色氨酸,并生成一些具有細胞毒作用的中間產物,抑制機體免疫功能。前期研究表明,低濃度色氨酸會使特異性T細胞的增值留在G1期,防止特異性免疫反應激活,Inaba等在研究60例卵巢癌患者及體外小鼠腫瘤模型發現,加入IDO抑制劑1-甲基色氨酸后(1-MT)能明顯抑制腫瘤細胞的生長。Nakanura等通過研究子宮頸癌患者病理標本后發現,表達IDO的癌細胞具有更強的侵襲能力。癌組織中CD33+MDSCs IDO的表達明顯升高,這有利于降低癌組織局部色氨酸濃度,使機體對腫瘤細胞表達的相關抗原產生免疫耐受。這可能是腫瘤免疫耐受形成的重要機制之一。
本研究發現,Foxp3+Tregs高比例樣本中 CD33+MDSCs IDO表達水平也明顯升高,差別有統計學意義(P<0.05),表明癌組織中CD33+MDSCs IDO 表達,可能能夠募集調節性T細胞Foxp3+Tregs進入癌組織,介導腫瘤免疫耐受的產生。研究結果還顯示MDSCs中IDO表達水平在存在淋巴結轉移的乳腺癌中比例明顯升高(P<0.05),表明IDO的表達可能與乳腺癌的轉移有關,這與國外研究腺病毒轉移的IDO角化細胞侵蝕性明顯增強相一致。闡明乳癌中MDSCs中IDO表達跟腫瘤耐受產生的分子生物學機制,有助于明確乳癌的發病機制,為免疫治療、基因治療提供必要的理論依據,對乳癌患者預后的監測都有重要意義。
[1] Schreiber RD,Old LJ,Smyth MJ.Cancer immunoediting:integrating immunity’s roles in cancer suppression and promotion[J].Science,2011,331(6024):1565-1570.
[2] 余宗林,李中琴.乳腺癌微轉移的檢測及臨床意義[J].臨床和實驗醫學雜志,2009,8(1):134-136.
[3] 陸作潔.首發為血液系統表現的骨髓轉移癌39例分析[J].檢驗醫學與臨床,2013,10(7):841-842.
[4] Movahedi K,Guilliams M,Van den Bossche J,et al.Identification of discrete tumor-induced myeloid-derived suppressor cell subpopulations with distinct T cell-suppressive activity[J].Blood,2008,111(8):4233-4244.
[5] Jessiea B.Katz,Alexander J.Muller,GeorgeC.Prendergast Indoleamine 2,3-dioxygenasein Teell toleranee and tumoral imrnunee sea[J].Immunologieal Reviews,2008,(222):206-221.
[6] Baban B,Chandler PR,Sharma MD,et al.IDO activates regulatory T cells and blocks their conversion into Th17-like T cells[J].Immunol,2009,183(4):2475-2483.
[7] Godin-Ethier J,Hanafi LA,Piccirillo CA,et al.Indoleamine 2,3-dioxygenase expression in human cancers:clinical and immunologic perspectives[J].Clin Cancer Res,2011,17(22):6985-6991.
[8] 杜華勁,張月君,周彩云,等.Ki-67和p53在三陰性乳腺癌中的表達和意義[J].中華全科醫學,2013,11(9):1393-1395.
[9] Kusmartsev S,Su Z,Heiser A,et al.Reversal of myeloid cell-mediated immunosuppression in patients with metastatic renal cell carcinoma[J].Clin Cancer Res,2008,14(24):8270-8278.

