雷公藤內酯醇誘導人脈絡膜黑色素瘤株OCM-1凋亡的機制研究
李潮,劉曉溪,付海燕,杜紅陽
脈絡膜黑色素瘤(choroidal melanoma,CM)是成人最常見的眼內惡性腫瘤之一,在全球的發病率占眼內惡性腫瘤的首位,在我國占第二位[1]。CM惡性程度高,轉移早且廣泛,如不經治療,一般在出現癥狀后4~6個月內死亡。CM最常用的兩種治療方法是眼球摘除和放射性敷貼治療[2],其中以手術切除為首選。但大多數患者確診時已為中晚期,身體狀況較差,故尋求高效的抗腫瘤藥物是目前的研究熱點。本研究探討了雷公藤內酯醇(TPL)誘導人CM株OCM-1凋亡的機制。
1 材料與方法
1.1 主要材料、試劑及儀器 OCM-1(青島大學醫學院提供),胎牛血清(中國醫學科學院血液學研究所),TPL(廣州藥業公司),碘化丙錠(PI)、核糖核酸酶(RNase)、RPM I 1640培養基(法國賽墨菲公司),四甲基偶氮唑藍(MTT)、辣根過氧化物酶標記的羊抗兔二抗(碧云天生物技術研究所),兔抗人caspase-3、β-actin、survivin、Bcl-2及Bax抗體(北京博奧森有限公司),S-II倒置顯微鏡(日本O lympus公司),流式細胞儀(FACScalibur,美國BD公司)。
1.2 方法
1.2.1 MTT法檢測TPL對OCM-1細胞增殖的影響
將TPL用二甲基亞砜(DMSO)配制成10mmol/L儲存液,DMSO終濃度<0.01%(V/V),–20℃貯存,實驗前用PBS稀釋。收集對數生長期OCM-1細胞,置于10%胎牛血清中,調整細胞濃度為4×104個/m l,每孔180μl,接種于96孔細胞培養板,于37℃、5%CO2、飽和濕度培養箱中培養。細胞分為對照組和實驗組。實驗組于培養24h后加入20μl不同濃度的TPL,使其終濃度分別為5、10、20、40、80、160nmol/L,對照組加入等量的無血清RPM I 1640培養液,每組3個復孔,分別作用24、48、72h。每孔加入20μl MTT(5mg/m l)作用4h,棄上清,加入150μl DMSO,振蕩溶解結晶后,以空白對照校正零點,在酶標儀上測定不同濃度各孔在490nm波長處的吸光度(A)值,計算細胞增殖抑制率。增殖抑制率(%)=1–(實驗組A值-空白對照A值)/(對照組A值-空白對照A值)×100%。分別計算不同濃度TPL對OCM-1細胞的半數抑制濃度(IC50),并繪制相應的增殖抑制曲線。
1.2.2 瑞氏-吉姆薩染色觀察細胞形態 取80nmol/L TPL作用OCM-1細胞48h,胰酶消化并收集細胞,1000r/m in離心3m in,制成細胞涂片,用瑞氏-吉姆薩染液染色,光學顯微鏡下觀察細胞形態學變化。
1.2.3 流式細胞儀檢測TPL誘導的OCM-1細胞凋亡
取20、40、80nmol/L TPL作用OCM-1細胞72h,5%胰酶消化后收集細胞,1000g/m in離心5m in,棄上清,冷PBS洗滌,加入70%冷乙醇4℃過夜,冷PBS洗滌,再次離心,加入10μg/m l RNase,37℃孵育30min,加入終濃度10μg/m l PI,輕輕混勻,避光反應30min后,應用流式細胞儀檢測凋亡細胞百分率。
1.2.4 Western blotting檢測OCM-1細胞凋亡相關蛋白的表達 分別采用20、40、80nmol/L TPL誘導OCM-1細胞,24h后以RIPA裂解細胞,采用Low ry法進行蛋白定量。將蛋白樣品在凝膠中電泳,電轉至PVDF膜上,5%奶粉封閉后,分別加入Bax抗體(1:300)、survivin抗體(1:300)、Bcl-2抗體(1:300)、caspase-3抗體(1:1000)及β-actin抗體(1:5000),過夜;TBST洗3次,加入辣根過氧化物酶標記的二抗(1:3000)作用90m in。ECL法顯色,GIS凝膠圖像系統分析數據,以對照組蛋白表達量為1,計算OCM-1細胞Bax、Bcl-2、survivin、caspase-3蛋白的表達量。實驗重復3次。
1.3 統計學處理 采用SPSS 13.0軟件進行統計學分析,計量資料以表示,多組間比較采用單因素方差分析,組間兩兩比較采用Dunnett-t檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1 TPL對OCM-1細胞增殖的影響 MTT結果顯示,TPL可抑制OCM-1細胞增殖,且呈時間劑量依賴關系(圖1)。OCM-1細胞經TPL作用24、48、72h的IC50值分別為98.52、56.14、15.57nmol/L。
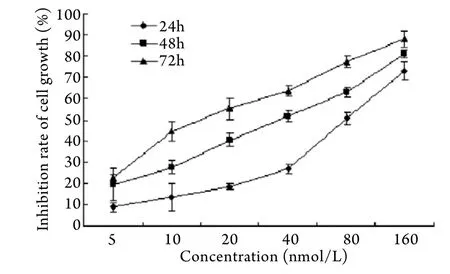
圖1 OCM-1細胞增殖曲線Fig.1 Proliferation curve of OCM-1 cells
2.2 瑞氏-吉姆薩染色觀察OCM-1細胞凋亡 在倒置顯微鏡下OCM-1細胞呈現梭形、多角形等多種形態,核可為雙核或多核,呈圓形或橢圓形。隨TPL濃度增加及作用時間延長,細胞增殖逐漸受到抑制,細胞逐漸變圓,脫壁,接觸松散,胞質中顆粒增大,細胞周圍出現碎片,部分細胞死亡后懸浮在培養液中,而空白對照組細胞貼壁生長,輪廓清楚,胞質中無異常顆粒出現,增殖旺盛。80nmol/L TPL作用于OCM-1細胞48h后,瑞氏-吉姆薩染色光鏡觀察可見典型細胞核碎裂現象(圖2)。
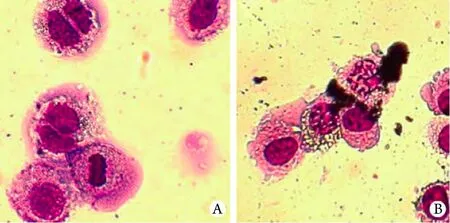
圖2 TPL對OCM-1細胞凋亡的影響(瑞氏-吉姆薩染色×200)Fig.2 OCM-1 cells apoptosis by TPL treatment (Wright-Giemsa's staining ×200)A. Control group;B. 80nmol/L TPL group
2.3 流式細胞術檢測OCM-1細胞凋亡率 檢測結果顯示,隨TPL濃度增加,sub-G1百分比由對照組的0.46%±0.23%分別增至2.59%±3.79%(20nmol/L TPL)、18.43%±2.63%(40nm o l/L TPL)及24.62%±5.71%(80nmol/L TPL),與對照組比較差異有統計學意義(P<0.01,圖3)。
2.4 Western blotting檢測OCM-1細胞凋亡相關蛋白表達 經20、40、80nmol/L TPL誘導后,OCM-1細胞Bc l-2蛋白表達量分別為89.32%±6.51%、68.30%±5.19%、57.23%±1.61%,survivin蛋白表達量分別為81.73%±3.67%、69.31%±2.28%、4 9.8 0%±6.1 1%,Ba x蛋白表達量分別為56.61%±4.21%、78.35±7.38%、87.21%±3.62%,與對照組比較差異均有統計學意義(P<0.01)。20nmol/L TPL作用OCM-1細胞未檢測到caspase-3蛋白活化,40nmol/L及80nmol/L作用后檢測到大小17kD的活性亞基(圖4)。
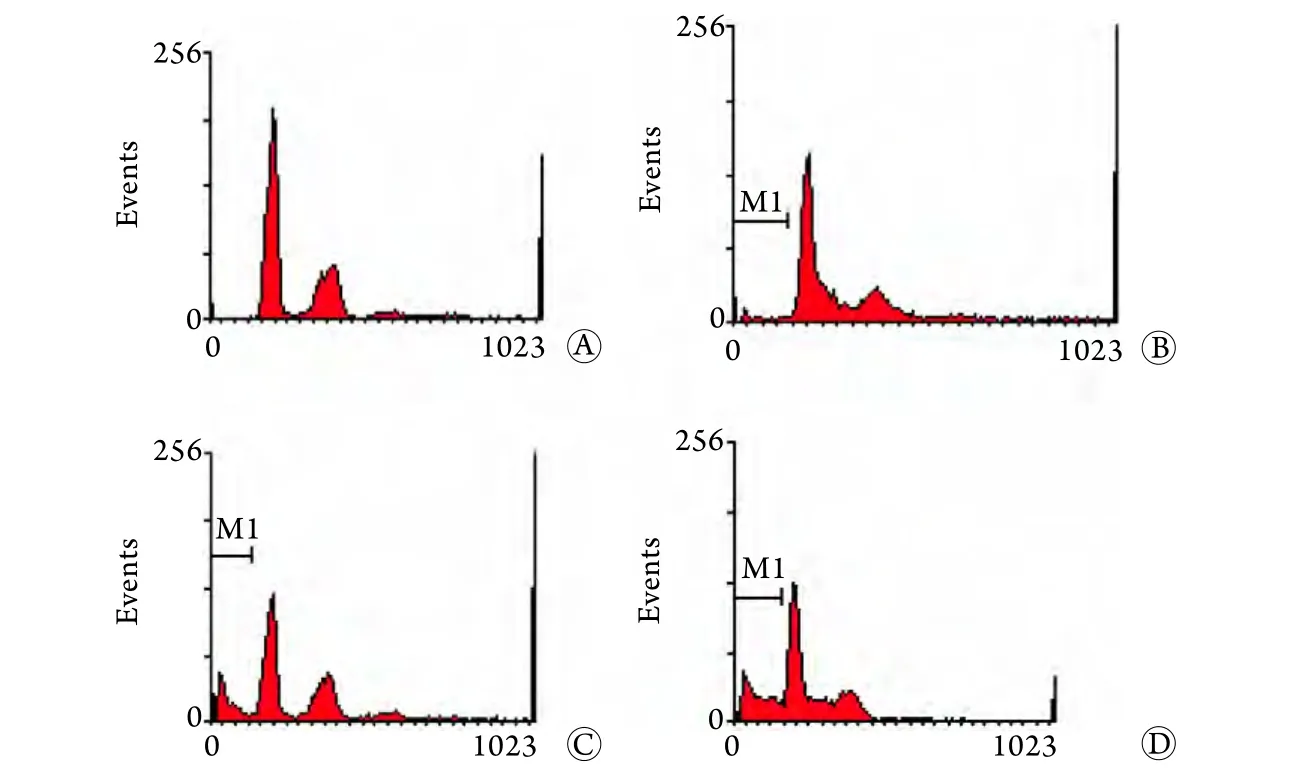
圖3 流式細胞術檢測OCM-1細胞凋亡率Fig.3 The apoptosis rate of OCM-1 cells (FCM)A. Control group; B. 20nmol/L TPL group; C. 40nmol/L TPL group; D. 80nmol/L TPL group
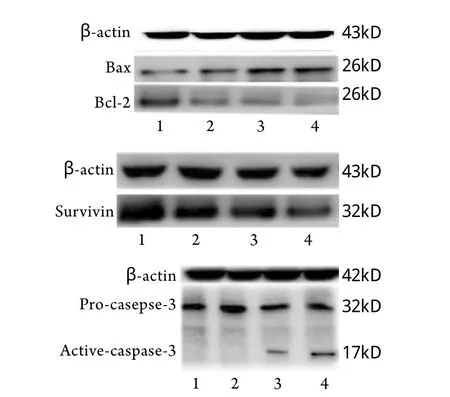
圖4 Western blotting檢測OCM-1細胞凋亡相關蛋白表達Fig.4 Expression of apoptosis related protein in OCM-1cells(Western blotting)Bax/Bcl-2; B. Survivin; C. caspase-3; 1. Contro l group; 2.20nmol/L TPL; 3. 40nmol/L TPL; 4. 80nmol/L TPL
3 討 論
TPL是雷公藤的主要有效成分之一,其相關效價比雷公藤總甙高100~200倍,臨床上已廣泛應用于自身免疫性疾病的治療[3]。近來研究發現TPL具有廣泛且高效的抗腫瘤作用,對人白血病、淋巴瘤等60多種腫瘤細胞均具有很好的抑制作用[4-7]。TPL對黑色素瘤細胞同樣具有抑制作用,但有關TPL對CM的作用仍需進一步研究。
Bcl-2蛋白家族以Bcl-2和Bax為代表,該家族成員可通過線粒體內外膜上的蛋白間接或直接影響線粒體途徑凋亡的發生[8]。當細胞受到凋亡因子的誘導時,Bcl-2家族蛋白發生轉位,調節線粒體中促凋亡因子的釋放。相關研究表明,Bax/Bcl-2比值決定了細胞對凋亡信號的反應[9-10]。本研究中,不同濃度TPL作用于人CM株OCM-1 24h,可使Bax蛋白表達上調,Bcl-2蛋白表達下調,表明TPL誘導人CM細胞株OCM-1凋亡可能與調節Bax及Bcl-2的表達水平有關。Survivin是凋亡抑制蛋白(inhibitor of apoptosis proteins,IAPs)家族的抗凋亡蛋白,在人CM細胞株OCM-1中表達率較高,與人CM的發生、進展以及原發性、繼發性耐藥的產生存在直接關聯[11]。Survivin可抑制caspases級聯激活,抑制細胞凋亡,其中對caspase-3的活化抑制最為重要。本研究發現,TPL可使OCM-1細胞survivin蛋白表達水平下調,且呈濃度依賴性關系。
細胞凋亡主要通過死亡受體途徑和線粒體途徑,caspases家族為最終執行者,在細胞凋亡過程中通過對骨架蛋白的剪切,引起細胞核固縮、碎裂等復雜的形態學變化,其中caspase-3是以上兩種途徑的共同交匯點,是caspase級聯反應中的終末執行分子[12-13]。研究證實,caspase-3的活性表達與細胞凋亡途徑關系密切[14]。本研究中20nmol/L TPL作用于OCM-1細胞后,檢測到的caspase-3為非活化狀態,但濃度升高至40nmol/L及80nmol/L時則可檢測到caspase-3的活性亞基,且隨著濃度升高,caspase-3活化增強,提示caspase-3可能參與了TPL誘導OCM-1細胞凋亡。caspase-3的活化受多方面因素的調控,本研究結果表明,TPL在誘導OCM-1細胞凋亡的過程中通過調節Bax與Bcl-2蛋白的表達水平,影響線粒體內細胞色素C、Smac/DIABLO、survivin等凋亡蛋白及凋亡抑制蛋白的釋放,其中凋亡抑制蛋白survivin表達下調,促進凋亡發生,導致caspase-3活化,促使凋亡相關事件的發生,從而間接證實了TPL在誘導OCM-1凋亡中的作用可能是通過線粒體凋亡途徑所引發。
總之,凋亡途徑異常復雜,凋亡與否取決于促凋亡蛋白及相關凋亡蛋白的動態平衡。本實驗結果證實TPL可通過調節凋亡蛋白與促凋亡蛋白的表達而誘導OCM-1細胞凋亡,為進一步開展相關實驗提供了理論基礎。
[1] Zhao GQ. Ophthalmology subjects[M]. Beijing: Peop le's Medical Publishing House, 2006. 318-319. [趙桂秋主譯. 眼科學總論[M]. 北京:人民衛生出版社, 2006. 318-319.]
[2] Finger PT, Zhou D, Kalach N,et al. 103Pd versus 125I ophthalm ic plaque brachytherapy: preoperative comparative radiation dosimetry for 319 uveal melanomas[J]. J Radiat Oncol,2014, 3(4): 409-416.
[3] Zhou HY, Li BM, Yin P,et al. Effect of triptolide on protection of neurons in the hippocampus of epileptic rats induced by lithium chloride-pilocarpine[J]. J Shandong Univ (Health Sci), 2012,50(5): 20-24, 31. [周海燕, 李保敏, 尹蘋, 等. 雷公藤內酯醇對匹羅卡品致癇大鼠海馬神經元的保護性研究[J]. 山東大學學報(醫學版), 2012, 50(5): 20-24, 31.]
[4] Shi JR, Zhao JX, Zhang H,et al. Effect of triptolide on the proliferation and apoptosis of gallbladder carcinoma cell line GBC-SDin vitro[J]. Med J Chin PLA, 2010, 35(12): 1462-1464.[史繼榮, 趙建勛, 張寰, 等. 雷公藤內酯醇對膽囊癌GBCSD細胞株增殖與凋亡的影響[J]. 解放軍醫學雜志, 2010,35(12): 1462-1464.]
[5] Liu L, Jiang Z, Liu J,et al. Sex differences in subacute toxicity and hepatic m icrosomal metabo lism of triptolide in rats[J].Toxicology, 2010, 271(1-2): 57-63.
[6] Liang X, Zhou H, Liu X,et al. Effect of local hypertherm ia on lym phangiogenic factors VEGF-C and -D in a nude m ouse xenograft model of tongue squamous cell carcinoma[J]. O ral Oncol, 2010, 46(2): 111-115.
[7] Ning WX, Zhou Y, Gu JH,et al. Effects of triptolide on human cervical cancer CaSki cells: anin vitrostudy[J]. Med J Chin PLA, 2011, 36(3): 225-227. [寧維翾, 周英, 顧江紅, 等. 雷公藤內酯醇對人宮頸癌 CaSki細胞株的體外作用研究[J]. 解放軍醫學雜志, 2011, 36(3): 225-227.]
[8] Fang M, Wang XD. M itochondrial apop tosis pathway[J]. J Peking Univ (Health Sci), 2002, 34(1):1-10. [方敏, 王曉東.細胞凋亡的線粒體通路[J]. 北京大學學報(醫學版), 2002,34(1): 1-10.]
[9] Takahashi M, Elbarbary RA, Nakashima A,et al. A naked RNA heptamer targeting the human Bcl-2 mRNA induces apoptosis of HL60 leukem ia cells[J]. Cancer Lett, 2013, 328(2): 362-368.
[10] Zhang W, Ju J. Odontob last-targeted Bcl-2 overexpression p romotes dentine damage repair[J]. Arch O ral Bio l, 2012,57(3): 285-292.
[11] Ku JH, Seo SY, Kwak C,et al. The role of survivin and Bcl-2 in zinc-induced apoptosis in prostate cancer cells[J]. Urol Oncol,2012, 30(5): 562-568.
[12] Wang HL, Li Y, Tian J,et al. Effects of exhaustive exercise on renal tubular apoptosis and HIF-1α expression in rats and result of total ginsenoside intervention[J]. Med J Chin PLA, 2014,39(2): 161-166. [王會玲, 李燕, 田軍, 等. 力竭運動對大鼠腎小管凋亡和缺氧誘導因子-1α表達的影響及人參總皂苷干預研究[J]. 解放軍醫學雜志, 2014, 39(2): 161-166.]
[13] Yu GY, Song XF, Zhao SH,et al. Induction effect of benzene on apoptosis of mouse bone marrow cells through m itochondrialdependent apoptosis pathway and its mechanism[J]. J Jilin Univ(Med Ed), 2014, 40(5): 943-946, 1128. [于光艷, 宋祥福, 趙淑華, 等. 苯通過激活線粒體凋亡通路對小鼠骨髓細胞凋亡的誘導作用及其機制[J]. 吉林大學學報(醫學版), 2014, 40(5):943-946, 1128.]
[14] Rubio N, Garcia-Segura LM, Arevalo MA. Survivin prevents apoptosis by binding to caspase-3 in astrocytes infected with the BeAn strain of Theiler's murine encephalomyelitis virus[J]. J Neurovirol, 2012, 18(5): 354-363.

