吲哚菁綠在乳腺癌前哨淋巴結活檢中的應用觀察
寇德強,邱鏡丹,王全勝,王建東
乳腺癌的發(fā)病率占女性惡性腫瘤的第一位,且呈逐年上升的趨勢[1]。近年來隨著檢查手段的進步,早期乳腺癌的檢出率明顯增加,治療模式也發(fā)生了相應變化,更強調在外科手術切除的同時兼顧患者生活質量。腋窩淋巴結清掃(axillary lymph node dissection,ALND)是乳腺癌手術的重要組成部分,旨在徹底清除病變,降低局部復發(fā)率[2-3]。研究顯示,早期乳腺癌腋窩淋巴結(axillary lymph node,ALN)轉移率很低,對早期乳腺癌患者實施ALND屬于過度治療[4]。目前認為未發(fā)生轉移的淋巴結仍有正常的防御功能,對于ALN陰性患者,ALND并不能提高生存率,卻可能導致上肢水腫、肩關節(jié)活動障礙、疼痛等一系列術后并發(fā)癥[5]。因此對沒有發(fā)生ALN轉移的乳腺癌患者,保腋手術和保乳手術一樣是當前乳腺外科的發(fā)展方向。
前哨淋巴結(sentinel lymph node,SLN)是乳腺癌向腋窩轉移的第一站淋巴結,SLN活檢可準確評估腋窩淋巴結狀態(tài),循證醫(yī)學Ⅰ級證據顯示SLN陰性患者可不行ALND[6-8]。研究顯示,未接受ALND的SLN陰性患者腋窩復發(fā)率無明顯提高,但術后軀體和心理并發(fā)癥的發(fā)生率明顯降低[9]。2010年《NCCN乳腺癌臨床實踐指南》推薦對有適應證的Ⅰ、Ⅱ期乳腺癌必須先行SLN活檢[10]。目前,SLN活檢已經成為歐美國家早期乳腺癌的標準治療模式,美國2005年接受SLN活檢的乳腺癌患者已占65%左右[11],而受傳統(tǒng)觀念和技術手段的影響,接受SLN活檢的比例在我國目前仍較低。
乳腺癌SLN活檢的常用方法主要包括染色法、核素法以及二者聯(lián)合的方法。染色法存在檢出率低、過度依賴學習曲線、手術具有盲目性、創(chuàng)傷大等缺點。核素法檢出率較高,但依賴于專業(yè)的儀器設備,且因放射性安全問題,操作復雜,費用較高,在國內的應用尚處于臨床研究階段。因此,尋找一種便于開展、效果穩(wěn)定可靠的SLN活檢方法具有重要臨床意義。解放軍總醫(yī)院普通外科2014年7-12月對72例乳腺癌患者分別采用吲哚菁綠(indocyanine green,ICG)和亞甲藍實施SLN活檢,通過對比研究探討ICG單獨應用于乳腺癌SLN活檢的可行性及應用前景,現報告如下。
1 資料與方法
1.1 一般資料 納入2014年7-12月在解放軍總醫(yī)院普外科接受手術切除的72例女性乳腺癌患者,年齡33~67歲,中位年齡50歲。納入標準為:①女性患者;②既往無腋窩手術史;③術前經穿刺活檢、麥默通旋切或開放手術切除活檢診斷為乳腺癌;④臨床無ALN轉移證據;⑤非妊娠、哺乳期乳腺癌;⑥非炎性乳腺癌;⑦術前未接受過乳腺區(qū)放療或新輔助化療。排除標準為:①多中心或多病灶的乳腺癌;②炎性乳腺癌;③妊娠、哺乳期乳腺癌;④既往有嚴重過敏史或對ICG過敏者;⑤無人身自由及獨立民事行為能力者。
1.2 方法
1.2.1 實驗分組及儀器試劑 將入選患者隨機分為兩組,實驗組(n=35)使用ICG作為示蹤劑實施SLN活檢,對照組(n=37)使用亞甲藍作為示蹤劑實施SLN活檢。ICG購自丹東醫(yī)創(chuàng)藥業(yè)有限責任公司,光學分子影像手術導航系統(tǒng)(surgical navigation system,SNS)為中國科學院自動化研究所自主研發(fā)。亞甲藍注射液購自江蘇濟川制藥有限公司。
1.2.2 示蹤劑的注射方法 全麻成功后,常規(guī)消毒鋪巾。實驗組使用2m l注射器抽取濃度為2.5mg/m l的ICG 0.2m l,于患側乳腺外上象限乳暈區(qū)多點皮內注射,局部按摩30s。對照組使用5m l注射器及22G針頭,于患側乳腺外上象限乳暈區(qū)皮內注入1%亞甲藍注射液1m l,局部按摩15m in。
1.2.3 SLN定位及活檢 實驗組:①注射ICG后于乳暈區(qū)局部按摩30s,用SNS行患側乳腺外上象限區(qū)域淋巴管引流實時顯像,將淋巴管消失點遠側1~2cm處確定為SLN的位置,拍照并行體表標記;②取腋窩下端SLN活檢切口,逐層切開皮膚及皮下組織,使用SNS進行實時熒光導航,高亮信號處為SLN所在位置;③找到SLN后拍照記錄,然后行常規(guī)手術切除,使用SNS探查術野,檢查是否有遺漏的發(fā)光淋巴結;④切除SLN后剔除表面脂肪組織,將各淋巴結分別剖開,使用SNS分別記錄發(fā)光情況,送快速冰凍病理檢查。
對照組:亞甲藍注射成功后15m in,取腋窩下端SLN活檢切口,逐層切開皮膚及皮下組織,向胸壁解剖,同時注意觀察藍染的淋巴管,沿淋巴管追蹤至藍染淋巴結,此為亞甲藍法確定的SLN。常規(guī)切除SLN后送快速冰凍病理檢查。
快速冰凍病理檢查示SLN陰性的患者不行ALND,陽性者即刻行ALND。手術方式按術前討論方案進行,包括乳腺癌改良根治術、單純乳腺切除術、保留乳頭乳暈復合體皮下腺體切除術(保皮手術)、乳腺癌局部擴大切除術(保乳手術)等。接受保皮手術的患者同時行一期假體置入。切除的乳腺組織及ALN送常規(guī)病理檢查。
1.2.4 ALN有無轉移的判斷 手術切除的標本均行常規(guī)HE染色病理切片,以下情況視為ALN轉移:①SLN和ALN同時發(fā)現轉移;②SLN轉移而ALN未發(fā)現轉移;③SLN無轉移而ALN發(fā)現轉移。
1.2.5 SLN活檢技術標準 按美國Louisville大學SLN活檢技術評價標準[12]對結果進行統(tǒng)計分析。檢出率=檢出SLN的例數/接受活檢的例數×100%;準確率=(SLN真陽性+真陰性例數)/SLN活檢總例數×100%;靈敏度=SLN真陽性例數/(真陽性例數+假陰性例數)×100%;假陰性率=SLN假陰性例數/(真陽性例數+假陰性例數)×100%。
1.3 統(tǒng)計學處理 采用SPSS 10.0軟件進行統(tǒng)計分析,兩組成功檢出的SLN個數比較采用t檢驗,檢出率、準確率、靈敏度、假陰性率的比較采用χ2檢驗,P<0.05為差異有統(tǒng)計學意義。
2 結 果
實驗組35例患者行體外淋巴管示蹤全部成功(100%),其中33例成功實施SLN活檢,活檢成功率94.3%,未成功實施SLN活檢的2例患者按SLN陽性給予ALND,后證實ALN無轉移,按2例假陽性納入統(tǒng)計結果。35例患者中13例發(fā)現ALN轉移轉移率37.1%,ICG法均找到并證實SLN轉移(真陽性率100%)。對照組37例患者有34例于皮下發(fā)現藍染淋巴管(91.9%),34例全部成功實施SLN活檢,活檢成功率100%,未成功實施SLN活檢的3例患者按SLN陽性給予ALND,后證實ALN無轉移,按3例假陽性納入統(tǒng)計結果。37例患者共有14例發(fā)現ALN轉移,轉移率37.8%,其中13例使用亞甲藍法找到并證實SLN轉移(真陽性率92.9%),亞甲藍法出現1例假陰性。ICG法實施SLN活檢檢出率為94.3%,成功檢出SLN 111個,平均每例檢出3.2個SLN,準確率為94.3%,靈敏度為100%,假陰性率為0%;亞甲藍法檢出率為91.9%,檢出SLN 78個,平均每例檢出2.1個SLN,準確率為89.2%,靈敏度為92.9%,假陰性率為7.7%。統(tǒng)計學分析結果顯示,實驗組(ICG法)平均檢出個數明顯高于對照組(亞甲藍法),假陰性率明顯低于對照組(P<0.05),而兩組檢出率、準確率、敏感度比較差異無統(tǒng)計學意義(P>0.05,表1),淋巴管示蹤成功率和SLN活檢成功率差異亦無統(tǒng)計學意義(P>0.05)。
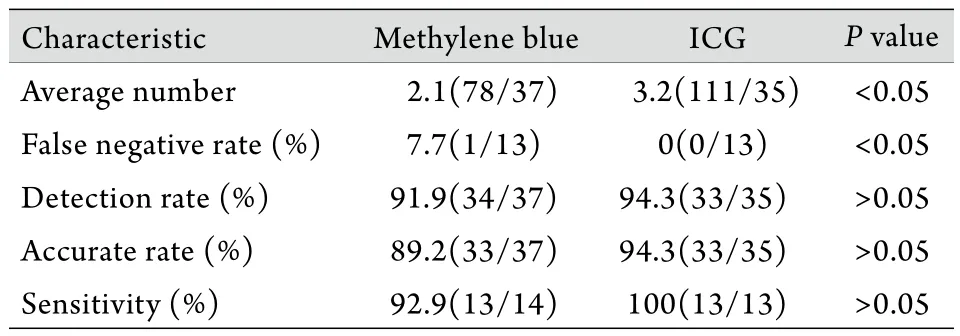
表1 兩種方法檢出結果比較Tab. 1 Comparison of detection results between the two methods
3 討 論
臨床上選擇SLN活檢方法的原則是高檢出率和低假陰性率,同時兼顧操作的簡便性和可重復性。決定SLN活檢成功率的兩個主要因素是術者的經驗和示蹤劑的選擇[13]。豐富的手術經驗和良好的團隊協(xié)作可縮短甚至消除學習曲線[14]。對于藍染法示蹤劑的選擇,國外多使用專利藍和異硫藍,國內普遍使用亞甲藍,檢出率基本相似,均可達90%以上,且較少引起超敏反應和其他嚴重并發(fā)癥[15]。但染色法手術操作具有盲目性,對術者的操作經驗要求較高,且檢出率相對較低。本研究結果顯示只有找到藍染的淋巴管,才能成功地找到SLN,提示手術技巧對藍染法的成功率具有重要影響。核素法常使用99mTc標記的硫膠體作為示蹤劑,檢出率較藍染法高[16],但在國內的使用仍受到各種因素的限制。
光學分子影像技術是目前乳腺外科研究的新熱點,其優(yōu)點在于可通過體外影像設備在體外定位SLN,并提供可視化手術導航,使手術操作精確性更高,避免了傳統(tǒng)手術的盲目性。有研究顯示ICG法的準確率高達97%以上,相較于傳統(tǒng)的藍染法和核素法具有明顯的優(yōu)勢[17-20]。本研究在患側乳腺外上象限乳暈區(qū)多點皮內注射0.5mg ICG,術中熒光顯影效果滿意,結果顯示該方法較傳統(tǒng)方法簡單快捷,易于掌握,手術導航系統(tǒng)穩(wěn)定性高,SLN活檢手術時間穩(wěn)定在10m in左右,檢出率94.3%,假陰性率0%,優(yōu)于傳統(tǒng)方法亞甲藍法,與國外報道相似。
有學者認為一種SLN活檢方法如果可以檢出2個以上SLN,則提示該種方法實施SLN活檢的準確性可達98%左右[21-22]。本研究中,ICG法平均每例檢出SLN 3.17個,高于亞甲藍法的2.1個。事實上由于ICG對淋巴組織的高親和力,在對腋窩淋巴結轉移的患者實施ALND的過程中我們發(fā)現,第二站、第三站淋巴結也發(fā)生了熒光顯影,進一步降低了漏診和誤診的概率,提示ICG在SLN活檢中具有獨特的優(yōu)勢。
SLN活檢的假陰性率是評估治療準確性的一個重要指標。如果遺漏轉移淋巴結,將會導致對病情的誤判,從而影響治療的有效性。聯(lián)合應用放射性核素和藍色染料的綜合法可以進一步提高SLN檢出率,同時降低假陰性率,目前已被多數專家共識所推薦[23-24]。在歐美國家綜合法已基本取代藍染法和核素法,其檢出率高于單用藍染法和核素法,并可進一步降低2.5%左右的假陰性率[25]。本課題組在初期研究中采用ICG聯(lián)合亞甲藍實施39例SLN活檢,檢出率為95%,假陰性率為0%,考慮到ICG和亞甲藍成像機制的不同,光學分子成像技術很大程度上改變了手術操作的方式,在手術過程中可能存在相互影響,反而增加了手術難度。本研究單獨使用ICG法實施SLN活檢,檢出率和假陰性率維持在較優(yōu)水準,預示了ICG法獨立應用于乳腺癌SLN活檢的可能性。
本研究在對ICG法的探索過程中發(fā)現,肥胖在一定程度上影響了SLN活檢的成功率。由于設備對組織的穿透力有限,對肥胖患者淋巴結的顯像不理想,延長了手術操作時間,而過多的手術操作導致術野內ICG示蹤劑外滲,對成像造成干擾,從而導致2例患者SLN活檢失敗。這也是ICG法體外淋巴管示蹤成功率為100%,而SLN活檢的成功率只有94.3%的原因,表明ICG法對設備的依賴程度要高于對手術經驗的依賴。先前39例聯(lián)合法的研究給了我們一些啟示,對于肥胖患者,亞甲藍和ICG聯(lián)合有助于提高活檢的成功率,如果ICG熒光顯影不良,那么尋找肉眼可見的藍染淋巴管可作為必備的補救措施。
綜上所述,ICG法實施乳腺癌SLN活檢檢出率高,評估ALN狀態(tài)結果準確,創(chuàng)傷小,且不增加患者的診療費用,容易被醫(yī)生熟練掌握,有望取代傳統(tǒng)的藍染法而單獨應用于乳腺癌的SLN活檢。基于光學分子成像原理的手術導航是適合于體表惡性腫瘤尤其是乳腺癌的外科治療方法,有助于乳腺癌微創(chuàng)治療的進一步開展,具有良好的臨床應用前景。
[1] Jemal A, Siegel R, Xu J,et al. Cancer statistics, 2010[J]. CA Cancer J Clin, 2010, 60(5): 277-300.
[2] Fu T, Zhang S, Zhang HP,et al. Evaluation on feasibility of SLNB in breast cancer patients after neoadjuvant chemotherapy[J]. J Jilin Univ (Med Ed), 2014, 40(4): 866-869. [付彤, 張湜, 張海鵬, 等. 新輔助化療后乳腺癌患者前哨淋巴結活檢的可行性評價[J]. 吉林大學學報(醫(yī)學版), 2014, 40(4): 866-869.]
[3] Ge J, Cao XC. New progress in breast cancer patients withearly treatment of axillary[J]. Tianjin Med J, 2013, 41(10): 1031-1034. [葛潔, 曹旭晨. 早期乳腺癌患者腋窩處理方式的新進展[J]. 天津醫(yī)藥, 2013, 41(10): 1031-1034.]
[4] Chen JX, Wang H, Zhang HW. Sentinel lymph node biopsy of breast cancer[J]. Chin J Surg, 2002, 3(3): 164-167.[陳君雪, 王紅, 張宏偉. 乳腺癌前哨淋巴結活檢技術[J]. 中華外科雜志,2002, 3(3): 164-167.]
[5] Harlow SP, Krag DN. Sentinel lym ph node:why study it:implications of the B-32 Study[J]. Sem in Surg Oncol, 2001,20(3): 224-229.
[6] Veronesi U, Viale G, Paganelli G,et al. Sentinel node biopsy in breast cancer: ten-year results of a random ized controlled study[J]. Ann Surg, 2010, 251(3): 595-600.
[7] M ansel RE, Fallow field L, Kissin M,et al. Random ized multicenter trial of sentinel node biopsy versus standard axillary treatment in operable breast cancer: The ALMANAC Trial[J]. J Natl Cancer Inst, 2006, 98(9): 599-609.
[8] Giulianno AE, Hunt KK, Baliman KV,et al. Axillary dissectionvsno axillary a random ized clinical trial[J]. JAMA, 2011, 305(4):569-575.
[9] Wang YS, Ouyang T, Wang QT,et al. The latest data report of the sentinel lymph node biopsy multi-center collaborative research CBCSG-001 in China[J]. Chin J Breast Dis (Electr Ed), 2009,3(3): 265-272.[王永勝, 歐陽濤, 王啟堂, 等. 中國前哨淋巴結活檢多中心協(xié)作研究CBCSG-001最新資料報告[J]. 中華乳腺病雜志(電子版), 2009, 3(3): 265-272.]
[10] Zuo WS, Yang L, Yu ZY. Clinical practice in the operation area of the breast cancer surgery[J]. Chin J Breast Dis (Electr Ed),2012, 6(2): 117-124.[左文述, 楊莉, 于志勇. 可手術的乳腺癌區(qū)域外科的臨床實踐[J]. 中華乳腺病雜志(電子版), 2012,6(2): 117-124.]
[11] Chen AY, Halpern MT, Schrag NM,et al. Disparities and trends in sentinel lymph node biopsy among early-stage breast cancer patients (1998-2005)[J]. J Natl Cancer Inst, 2008, 100(7): 462-474.
[12] Creager AJ, Geisinger KR. Intraoperative evaluation of sentinel lymph nodes for breast carcinoma: current methodologies[J].Adv Anat Pathol, 2002, 9(4): 233-234.
[13] Kopec JA, Colangelo LH, Land SR,et al. Relationship between arm morbidity and patient-reported outcomes following surgery in women with node-negative breast cancer: NSABP protocol B-32[J]. J Support Oncol, 2013, 11(1): 22-30.
[14] Kim T, Giu liano AE, Lyman GH. Lymphatic m apping and sentinel lymph node biopsy in early-stage breast carcinoma: a meta analysis[J]. Cancer, 2006, 106(1): 4-16.
[15] Thevarajah S, Huston TL, Simmons RM. A comparison of the adverse reactions associated with isosulfan blue versus methylene blue dye in sentinel lymph node biopsy for breast cancer[J]. Am J Surg, 2005, 189(2): 236-239.
[16] Takei H, Suemasu K, Kurosum i M,et al. Added value of the presence of blue nodes or hot nodes in sentinel lymph node biopsy of breast cancer[J]. Breast Cancer, 2006, 13(2): 179-185.
[17] Aoyama K, Kam io T, Ohchi T,et al. Sentinel lymph node biopsy for breast cancer patients using fluorescence navigation with indocyanine green[J]. World J Surg Oncol, 2011, 9: 157.
[18] Verbeek FP, Troyan SL, M ieog JS,et al. Near-in frared fluorescence sentinel lymph node mapping in breast cancer:a multicenter experience[J]. Breast Cancer Res Treat, 2014,143(2): 333-342.
[19] Sugie T, Sawada T, Tagaya N,et al. Com parison of the indocyanine green fluorescence and b lue dye m ethods in detection of sentinel lymph nodes in early-stage breast cancer[J].Ann Surg Oncol, 2013, 20(7): 2213-2218.
[20] Samorani D, Fogacci T, Panzini I,et al. The use of indocyanine green to detect sentinel nodes in breast cancer: a prospective study[J]. Eur J Surg Oncol, 2015, 41(1): 64-70.
[21] Kennedy RJ, Kollias J, Gill PG,et al. Removal of two sentinel nodes accurately stages the axilla in breast cancer[J]. Br J Surg,2003, 90(11): 1349-1353.
[22] Zakaria S, Degnim AC, Kleer CG,et al. Sentinel lymph node biopsy for breast cancer: how many nodes are enough[J]. J Surg Oncol, 2007, 96(7): 554-559.
[23] East JM, Valentine CS, Kanchev E,et al. Sentinel lymph node biopsy for breast cancer using methylene blue dye manifests a short learning curve among experienced surgeons: a prospective tabular cumulative sum (CUSUM) analysis[J]. BMC Surg, 2009,9: 2.
[24] Martin RC 2nd, Chagpar A, Scoggins CR,et al. Clinicopathologic factors associated with false-negative sentinel lymph-node biopsy in breast cancer[J]. Ann Surg, 2005, 241(6): 1005-1015.
[25] Varghese P, Abdel-Rahman AT, Akberali S,et al. Methylene blue dye -- a safe and effective alternative for sentinel lymph node localization[J]. Breast J, 2008, 14(1): 61-67.

