通心絡對低壓低氧性肺動脈高壓大鼠HIF-1α及相關因子的作用*
周曉玲 潘 磊 馬婷婷 郭 蕊 江 宏 姚小燕,4 高志敏 王 勇,#
通心絡對低壓低氧性肺動脈高壓大鼠HIF-1α及相關因子的作用*
周曉玲1,2潘 磊1,2馬婷婷1,2郭 蕊1,2江 宏1,2姚小燕1,2,4高志敏3王 勇1,2,#
目的:探討通心絡對低壓低氧性肺動脈高壓大鼠缺氧誘導因子-1α(HIF-1α)及相關因子的影響。方法:30只體重200-250g的SD雄性大鼠,隨機分為常壓常氧對照組(對照組)、低壓低氧模型組(模型組)、低壓低氧+通心絡干預組(通心絡干預組),每組10只。采用低壓低氧艙模擬海拔5 000m的高原環境(大氣壓50kp,氧濃度10%)。模型組和通心絡干預組大鼠每日入艙8h,其余時間為常壓常氧環境。通心絡干預組每天入艙前給予通心絡1.2g生藥/kg灌胃1次,對照組于同一實驗室的常壓常氧環境中飼養。4周后比較各組大鼠平均肺動脈壓(mPAP)、右心室(RV)肥厚指數以及血清HIF-1α、血管內皮生長因子(VEGF)、內皮素-1(ET-1)等因子水平。結果:4周后,與對照組相比,模型組大鼠mPAP、RV肥厚指數及HIF-1α、VEGF、ET-1等因子水平顯著升高(P<0.05)。與模型組相比,通心絡干預組大鼠mPAP、RV肥厚指數及血清HIF-1α、VEGF、ET-1等因子水平均顯著降低(P<0.05),且RV肥厚指數及血清HIF-1α、ET-1水平與對照組水平差異無統計學意義(P>0.05)。結論:通心絡可能通過降低HIF-1α水平等干預低壓低氧性肺動脈高壓的發生發展。
通心絡;低壓低氧性肺動脈高壓;缺氧誘導因子-1α;大鼠
低壓低氧性肺動脈高壓是高原病的表現類型之一,也是高原心臟病的基礎,其發生和發展嚴重威脅著高原地區人群的健康[1,2],因此防治低壓低氧性肺動脈高壓具有重要意義。低壓低氧性肺動脈高壓發病機制復雜,有效的靶向治療藥物有限,治療效果也不確切[3,4]。而中醫中藥的作用研究有助于尋找新的治療途徑。
通心絡是根據中醫絡病理論研制而成的中藥復方制劑,由人參、水蛭、全蝎、土鱉蟲、蜈蚣、蟬蛻、赤芍、降香、乳香、冰片等組成。具有改善內皮功能、抗氧自由基、抗動脈粥樣硬化,減輕心肌缺血-再灌注損傷等作用[5.6]。目前不僅廣泛用于心腦血管疾病治療[7,8],而且對慢性肺源性心臟病的肺動脈高壓也有一定的療效,但鮮見對低壓低氧性肺動脈高壓防治的研究報道。本研究采用低壓低氧艙建立高原肺動脈高壓大鼠模型,觀測通心絡對大鼠血流動力學、缺氧誘導因子-1α(HIF-1α)及相關因子水平的影響,為通心絡防治低壓低氧性肺動脈高壓提供依據。
1 材料與方法
1.1 藥品與試劑
通心絡超微粉由石家莊以嶺藥業股份有限公司生產(批號:090226)。大鼠HIF-1α ELISA試劑盒(批號:201310)、大鼠內皮素-1(ET-1)ELISA試劑盒(批號:201310)、大鼠血管內皮生長因子(VEGF)ELISA試劑盒(批號:201310)均購自北京鑫方程生物技術有限公司。
1.2 主要儀器
低壓低氧艙由濰坊華信鍋爐氧艙制造有限公司生產(型號:DSF-II動物實驗負壓艙)。動物呼吸機(型號:HX-300S)、肺動脈壓力測定儀(型號:BL-420/820)均購自成都泰盟科技有限公司。聚乙烯塑料微導管(長20cm,直徑約2mm)由上海泰爾茂醫療有限公司提供。
1.3 實驗動物及分組
雄性SPF級SD大鼠30只(由北京維通利華實驗動物中心提供),體重200-250g。應用隨機數字表法分為常壓常氧對照組(對照組)、低壓低氧模型組(模型組)、低壓低氧+通心絡干預組(通心絡干預組),每組各10只。通心絡干預組大鼠每天入艙前給予通心絡灌胃1次[參照相關研究結果[9],通心絡干預劑量為1.2g生藥/kg/天。用0.5%羧甲基纖維素鈉(CMC-Na) 將其配制成濃度為0.12g生藥/ml混懸液,每次按0.1ml/10g體重灌胃]。對照組與模型組大鼠每天給予等量0.5%CMC-Na灌胃1次,共28天(次)。參照李娟等[10]低壓低氧性大鼠肺動脈高壓模型的建立的方法,每天灌胃后模型組與通心絡干預組大鼠同時置于低壓低氧艙,每天8h,模擬海拔5 000m高原環境(大氣壓50kp,氧濃度10%),持續4周。對照組于同一實驗室內的常壓常氧環境飼養4周。實驗期間各組大鼠均無死亡。
1.4 大鼠平均肺動脈壓(mPAP)測定
4周后,各組大鼠腹腔注射戊巴比妥鈉(40mg/kg),麻醉后接動物呼吸機(呼吸頻率30次/min,潮氣量10ml/kg)。自大鼠右側頸外靜脈插入直徑2mm肝素化 (0.9%氯化鈉溶液+肝素10U/ml)的聚乙烯塑料微導管,導管的另一端與微型壓力傳感器連接以監測壓力變化,在壓力波形的引導下,導管經上腔靜脈進入右房、三尖瓣口、右室,最后進入肺動脈干,測定mPAP。當大鼠mPAP>35mmHg時,形成顯著的肺動脈高壓[11]。對照組大鼠mPAP水平為19.24±3.75mmHg(15.00-25.00mmHg)。模型組大鼠mPAP水平為45.46±3.17mmHg(40.00-48.00mmHg),均形成肺動脈高壓。通心絡干預組大鼠mPAP水平為29.01±4.96mmHg(22.00-35.06mmHg),僅1只大鼠形成了肺動脈高壓。
1.5 血清HIF-1α、VEGF、ET-1檢測
制模結束后從大鼠左頸總動脈采全血2ml,3 000r/min離心10min,制備血清。應用ELISA法測定各組大鼠血清HIF-1α、VEGF、ET-1水平,操作嚴格按照試劑盒說明書。
1.6 右心室(RV)肥厚指數測定
大鼠采血后頸動脈放血法處死大鼠,剖胸取出大鼠心臟,觀察心臟結構,剪去心房組織。沿室間隔邊緣分離出RV和左心室(LV)+室間隔(S),用濾紙吸干水分后稱量RV和LV+S重量,以RV/(LV+S)比值表示RV肥厚程度。
1.7 統計學處理
2 結 果
2.1 各組mPAP和RV肥厚指數
三組間mPAP和RV肥厚指數的差異均具有統計學意義(F值分別為97.21和14.24,P均<0.05)。模型組大鼠mPAP和RV肥厚指數較對照組顯著升高 (t值分別為15.74和4.29,均P<0.05)。通心絡干預組大鼠mPAP和RV肥厚指數較模型組明顯下降 (t值分別為8.35和3.60,均P<0.05);其RV肥厚指數與對照組差異無統計學意義(t=0.83,P>0.05)。見表1。
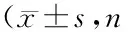
表1 各組大鼠mPAP和RV肥厚指數比較均=10)
注:與對照組比較,1)P<0.05;與模型組比較,2)P<0.05
2.2 各組大鼠血清HIF-1α、VEGF、ET-1水平
三組間血清HIF-1α、VEGF、ET-1水平差異具有統計學意義(F值分別為38.93、 95.32和 37.66,均P<0.01)。模型組大鼠血清HIF-1α、VEGF和ET-1水平較對照組明顯升高 (t值分別為12.86、18.98和11.12,均P<0.05);通心絡干預組與模型組比較,HIF-1α、VEGF及ET-1水平顯著下降(t值分別為6.78、4.76和6.13,均P<0.05),其HIF-1α、ET-1兩指標水平與對照組差異無統計學意義(t值分別為0.37和0.30,均P>0.05)。見表2。

表2 各組大鼠血清HIF-1α、VEGF、ET-1水平比較均=10)
注:與對照組比較,1)P<0.05;與模型組比較,2)P<0.05
3 討 論
在慢性缺氧條件下,機體會出現缺氧性肺血管收縮(Hypoxe Pulmonary Vasoconstriction, HPV)及肺血管重構,形成持續缺氧性肺動脈高壓,進而導致右心室后負荷增加和右心室肥大,嚴重者可進一步發展為右心衰竭[12,13]。HIF-1α是缺氧條件下最重要的調節因子,可編碼多種血管收縮因子,導致VEGF、ET-1等在內的血管收縮因子水平升高,不僅引起肺血管收縮和壓力升高,而且促進細胞有絲分裂,增強肺血管重塑[14,15]。本研究發現在模擬海拔5 000m的高原環境下,模型組大鼠mPAP和RV肥厚指數均明顯升高,血清HIF-1α、VEGF和ET-1水平也顯著上調,進一步驗證了低壓低氧性肺動脈高壓的形成機制。
有研究[16]表明,通心絡改善內皮功能、抗氧自由基、減輕組織缺血-再灌注損傷的作用可能與其能影響HIF-1α的生物學效應有關。本研究發現,與模型組大鼠相比,通心絡干預組大鼠mPAP和RV肥厚指數均顯著下降,表明通心絡能有效降低低壓低氧性肺動脈高壓大鼠mPAP,減輕右室重構。另外,通心絡干預組大鼠血清HIF-1α、VEGF及ET-1水平明顯降低,提示通心絡可能通過下調HIF-1α的表達,抑制HIF-1α對下游靶基因產物VEGF、ET-1水平的上調作用,減少缺氧對內皮細胞的損害,糾正血管收縮/舒張因子的動態失衡,減輕血管收縮和肺血管平滑肌增殖,抑制肺血管重構,降低肺動脈壓,從而有效遏制低壓低氧性肺動脈高壓的發生發展[14,15]。
本研究結果提示通心絡可能通過降低血清HIF-1α及其相關血管收縮因子水平,干預低壓低氧性肺動脈高壓的發生或進程,但其更多的作用機制和安全性等有待進一步探討。
?
本文第一作者簡介:
周曉玲(1982-),女,漢族,醫學博士,研究方向:老年醫學與腎臟疾病、低氧醫學
1 Maripov A, Mamazhakypov A, Karagulova G, et al. High altitude pulmonary hypertension with severe right ventricular dysfunction[J]. Int J Cardiol,2013,168(3): e89-90.
2 Xu XQ, Jing ZC. High-altitude pulmonary hypertension[J]. Eur Respir Rev, 2009,18(111):13-17.
3 Xu Y, Liu Y, Liu J, et al. Meta-analysis of clinical efficacy of sildenafil, a phosphodiesterase type-5 inhibitor on high altitude hypoxia and its complications[J]. High Alt Med Biol, 2014,15(1):46-51.
4 Bates MG, Thompson AA, Baillie JK, et al. Sildenafil citrate for the prevention of high altitude hypoxic pulmonary hypertension: double blind, randomized, placebo-controlled trial[J].High Alt Med Biol, 2011,12 (3):207-214.
5 Cheng YT, Yang YJ, Zhang HT, et al. Pretreatment with Tongxinluo protects porcine myocardium from ischaemia/reperfusion injury through anitricoxide related mechanism[J]. Chin Med J(Engl),2009,122(13): 1 529-1 538.
6 Yao EH, Wang HJ, Xu CS. Effects of tongxinluo on the neointima formation and expression of inflammatory cytokines in rats after carotid artery balloon injury[J]. Indian J Pharmacol,2014,46(5): 510-514.
7 徐貴成, 高榮林, 吳以嶺, 等. 通心絡膠囊治療冠心病心絞痛的臨床研究[J].中國中西醫結合雜志, 1997,17(7):414-416.
8 尤士杰, 陳可冀, 楊躍進, 等.通心絡膠囊干預急性心肌梗死早期血運重建后自發性改善的臨床研究[J].中國中西醫結合雜志,2005,25(7):604-607.
9 吳士珍, 吳相鋒, 袁國強,等. 缺氧大鼠血管內皮功能的變化及通心絡超微粉的干預作用[J]. 疑難病雜志,2009,8(3):131-134.
10 李 娟,孫 新, 畢 輝, 等. 低壓低氧性大鼠肺動脈高壓模型的建立[J]. 臨床心血管雜志, 2008,4(4):297-301.
11 Ryan J, Bloch K, Archer SL. Rodent models of pulmonary hypertension: harmonisation with the world health organisation’s categorisation of human PH[J]. Int J Clin Pract, 2011,65(172 Suppl):15-34.
12 Humbert M, Morrell NW, Archer SL, et al. Cellular and molecular pathobiology of pulmonary arterial hypertension[J]. J Am Coll Cardiol,2004,43(12 Suppl S):13S-24S.
13 Wang Z, Chesler NC. Pulmonary vascular mechanics: important contributors to the increased right ventricular afterload of pulmonary hypertension[J]. Exp Physiol,2013,98(8):1 267-1 273.
14 Ortmann B, Druker J, Rocha S. Cell cycle progression in respose to oxygen levels[J]. Cell Mol Life Sci,2014,71(18):3 569-3 582.
15 Niu G, Briggs J, Deng J, et al. Signal transducer and activator of transcription is required for hypoxia-inducible factor-1 alpha RNA expression in both tumor cells and tumor associated myeloid cells[J].Mol Cancer Res,2008,6(7):1 099-1 105.
16 吳相春,吳相峰,賈振華,等.通心絡對小鼠反復缺氧耐受性的影響[J].中華醫學雜志,2010,90(22):1 571-1 573.
The Effect of Tongxinluo on HIF-1α and Related Factors Level in Rats with Hypobaric and Hypoxia Pulmonary Hypertension
ZHOU Xiao-ling1,2, PAN Lei1,2, MA Ting-ting1,2, GUO Rui1,2, JIANG Hong1,2, YAO Xiao-yan1,2,4, GAO Zhi-Min3, WANG Yong1,2,#
1Department of Geratology;2Hypoxia Laboratory;3Labor of Animal Experiment, Beijing Shijitan Hospital, Capital Medical University, Beijing 100038, China;4The Ninth Clinical Hospital of Peking University,Beijing 100038,China;#
Objective: To study the effect of Tongxinluo on HIF-1α in rats with hypobaric and hypoxia pulmonary hypertension.Method: 30 male SD rats weighing 200-250g were randomly divided into three groups: control group with normal pressure and normal oxygen(control group), pulmonary hypertension group with low-pressure and low-oxygen (model group), and the group treated by Tongxinluo in low-pressure and low-oxygen condition (Tongxinluo intervention group). Each group included 10 rats. Auto-modulating hypobaric and hypoxic cabin was used to simulate 5000m high altitude environment (air pressure 50kpa, oxygen concentration 10%). Tongxinluo (1.2g/kg crude drug) was given by gastrogavage to rats in Tongxinluo intervention group once daily. Control group were exposed to normal-pressure and normal-oxygen in the same laboratory environment. 4 weeks later, the mean pulmonary arterial pressure (mPAP) and right ventricular (RV) mass index were measured. Concentrations of HIF-1α, VEGF and ET-1 in blood were detected.Results: Compared with control group, mPAP, RV mass index and the levels of HIF-1α, VEGF, ET-1 in model group were significantly increased (P<0.05). Compared with model group, rats of Tongxinluo intervention group showed lower mPAP and RV mass index, and the levels of HIF-1α, VEGF and ET-1 decreased remarkably (P<0.05). There was no significant difference between control group and Tongxinluo intervention group in right ventricular hypertrophy index and the levels of serum HIF-1α and ET-1 (P> 0.05). Conclusion: Tongxinluo may influence the occurrence and development of hypobaric and hypoxia pulmonary hypertension by downregulated the level of HIF-1α.
Tongxinluo; Hypobaric and hypoxia pulmonary hypertension; Hypoxia-inducible factor-1α; Rat
北京市中醫藥科技項目(JJ2013-10)
首都醫科大學附屬北京世紀壇醫院, 北京 100038;1老年醫學科;2低氧實驗室;3動物實驗中心;4北京大學第九臨床醫學院,北京 100038;#
,E-mail:wangyong7096@aliyun.com
本文2015-01-14收到,2015-02-15修回
R285.5
A
1005-1740(2015)02-0008-04

