脊髓損傷大鼠的學習記憶功能與海馬病理改變
馮東亮,南偉,伍亞民,王莉,江龍,周開升,朱彥東,汪靜,洪有建,龍在云,張海鴻
脊髓損傷大鼠的學習記憶功能與海馬病理改變
馮東亮1,2,南偉1,2,伍亞民3,王莉3,江龍3,周開升1,2,朱彥東1,2,汪靜1,2,洪有建3,龍在云3,張海鴻1,2
[摘要]目的探究脊髓損傷后大鼠學習記憶功能與海馬病理變化特點及關系。方法36只成年雌性Sprague-Dawley大鼠隨機分為假手術組(n=18)和損傷組(n=18)。用Allen法打擊T10脊髓制備脊髓損傷模型,打擊強度為10 g×25 mm。損傷后1 d、3 d及1~5周每周1次行BBB后肢功能評分;術后5周時檢測運動誘發電位,行Morris水迷宮測試;術后1周、3周、5周各組分別取4只大鼠行HE染色,檢測海馬細胞形態變化。結果術后每個時間點,損傷組BBB評分均低于假手術組(P<0.05)。術后5周,損傷組運動誘發電位N1、P1波潛伏期顯著長于假手術組(P<0.001),振幅顯著低于假手術組(P<0.001)。Morris水迷宮測試,損傷組到達平臺潛伏期顯著長于假手術組(P<0.001),在目標象限的探索時間顯著少于假手術組(P<0.001),且多以系統定位或環形定位方法尋找目標平臺,而假手術組則以空間定位方法為主。HE染色顯示,1周時,損傷組海馬組織有少量細胞形態異常;隨著時間延長,海馬內形態異常細胞逐漸增多,存活細胞逐漸減少;假手術組HE染色基本正常。結論脊髓損傷可引起大鼠學習記憶功能障礙,可能與海馬細胞損傷有關。
[關鍵詞]脊髓損傷;學習記憶功能;海馬;病理;大鼠
[本文著錄格式]馮東亮,南偉,伍亞民,等.脊髓損傷大鼠的學習記憶功能與海馬病理改變[J].中國康復理論與實踐, 2015, 21(11): 1267-1272.
CITED AS: Feng DL, Nan W, Wu YM, et al. Learning and memory impairment and pathology in hippocampusin ratswith spinal cord injury [J]. Zhongguo Kangfu LilunYu Shijian, 2015, 21(11): 1267-1272.
脊髓損傷分為原發性和繼發性脊髓損傷。原發性脊髓損傷主要為損傷后即刻發生的損傷;繼發性損傷持續時間較長,包括一系列復雜的病理過程,是引起機體功能損傷的主要原因。關于脊髓損傷后脊髓自身發生的一系列病理變化過程已有大量研究。本文主要探究脊髓損傷后大腦海馬結構的變化及其與認知功能障礙的關系。
1 材料與方法
1.1實驗動物及分組
36只成年Sprague-Dawley大鼠,雌性,體質量200~230g,由第三軍醫大學大坪醫院野戰外科研究所動物中心提供(許可證號:SYXK(渝)2012-0010)。實驗前1周,動物在實驗室飼養,自然晝夜采光,自由飲水及飲食,室溫25~28℃。動物飼養及實驗過程均遵守實驗動物管理及保護的有關規定。
將動物編號,隨機數字法分為假手術組和損傷組,每組18只。
1.2主要儀器和試劑
HE染色試劑盒:北京索萊寶生物科技有限公司,批號G1120。戊巴比妥鈉:德國進口分裝,北京化學試劑公司,批號100808。ST-7立體定位儀:日本Narishige公司。多道生理記錄儀:澳大利亞AD instruments公司,型號ML408。Allen打擊器:美國新澤西州大學,型號RM2007。RM2000R石蠟切片機:LEICA公司。病理組織漂烘儀:中威PHY-111。
1.3模型建立
大鼠術前禁食12 h。1%戊巴比妥鈉4 ml/kg腹腔注射,角膜反射消失表明麻醉成功。俯臥位固定于手術臺上,剃去背部皮毛,碘伏及酒精術區皮膚消毒。定位T10,以T10為中心在背部正中切一長約2 cm的切口,鈍性分離棘突上的肌肉,咬開T9-11椎板,顯露脊髓(未損傷硬脊膜)。用Allen打擊器打擊T10脊髓,打擊強度10g×25mm,打擊后立即移開打擊棒。造模成功的標準:打擊后大鼠后肢發生不同程度抽搐之后癱軟,尾巴發生痙攣性擺動。假手術組僅咬開椎板,不打擊。
逐層縫合肌肉和皮膚,放回籠中,置于25~28℃動物房內。術后予青霉素1.6×105U肌肉注射,連續3 d;每天3次按摩膀胱排尿,直至恢復自主排尿。
1.4檢測指標
1.4.1行為學評分
造模后1 d、3 d、1周、2周、3周、4周、5周,采用Basso-Beattie-Bresnahan (BBB)評分法[1]評估大鼠后肢行為學功能。1 d、3 d評分時,偏離平均值2分以上者剔除,重新造模補充。評分由2名熟悉BBB評分方法的非本組實驗人員進行,將大鼠逐一放入曠場內,觀察其活動4min,評估其后肢功能。
1.4.2運動誘發電位
造模后5周檢測各組大鼠的運動誘發電位(motor evoked potential, MEP)。刺激電極為直徑約2 mm的單極銀球電極。用腦立體定位儀固定大鼠頭部,在矢狀線旁3.5 mm,人字縫下2.5 mm處,用牙科鉆開一直徑約3 mm的小孔。微電極操縱器將銀球電極推至大腦皮層運動區,與硬腦膜保持良好接觸,但不損傷腦組織。圓盤銀片置于硬腭下。刺激頻率4 Hz,波寬0.2ms,強度5mV。
記錄電極為雙極銀針,插入小腿腓腸肌,兩極間距約5 mm。采集信號經放大器輸送至電腦進行處理分析。放大器放大倍數10萬倍,計算機疊加64次后平均。每只大鼠記錄3次,取平均值。
1.4.3 Morris水迷宮檢測
造模后5周行Morris水迷宮檢測。在圓形水箱內加入自來水,水溫(24±1)℃,水面超過平臺約2 cm,加入墨汁使液面呈黑色增加對比度。先行航行訓練,每天將每只老鼠從不同象限各訓練1次,連續4 d,每天第1次訓練時均從目標象限的對側象限放入,一次一只,記錄大鼠每天第1次找到平臺的潛伏期[2]。第5天取出平臺,將大鼠從對側象限放入水迷宮內,行空間探索實驗,記錄其通過目標象限的時間及其探索目標象限的路線方式。
依據文獻[3],搜索目標的定位方式分3種:①空間定位為直接朝向平臺或目標象限游去,路線中不多于1個環形;②系統定位為主要在水箱中央往返運動,路線沒有特殊形狀,不能很快找到目標;③環形定位為主要圍繞水桶邊緣做密封的環形循環運動。統計5 d中大鼠運動的路線方式,計算每組大鼠每種運動形式的百分比。
全部數據用Smart 2.0軟件(Panlab公司)分析。
1.4.4形態學檢測
造模后1周、3周、5周時,每組各取4只動物,用0.01 mol/L PBS從左心室快速灌注,至右心耳流出液體變清亮后,改用4%多聚甲醛灌注固定。取出大腦組織,4%多聚甲醛灌后固定2 d。酒精梯度脫水,石蠟包埋,冠狀面連續石蠟切片。每隔15片取1片,每只大鼠取5片,切片厚5 μm,脫蠟行HE染色,觀察大鼠海馬內病理變化情況。每張切片取不重復的5個視野計數存活細胞數目,計算所占比例。
1.5統計學分析
所有數據均用(xˉ±s)表示,采用SPSS19.0軟件進行統計分析。BBB評分值和誘發電位潛伏期及波幅采用獨立樣本t檢驗,水迷宮數據、HE染色的細胞計數數據采用單因素方差分析(One-Way ANOVA)。顯著性水平α=0.05。
2 結果
2.1一般情況
損傷組大鼠蘇醒后,精神不佳,雙下肢運動功能喪失,出現尿潴留;72 h內,部分大鼠出現血尿和腹部脹氣現象,之后慢慢好轉,1周左右基本恢復排尿。術后2周內,損傷組體質量下降10~15 g,之后逐漸恢復,部分大鼠后肢有輕微肌肉萎縮。假手術組大鼠蘇醒后即可有部分運動,1周后基本恢復正常。
2.2BBB評分
損傷組3 d內所有大鼠評分均為0~3分;術后2~3周功能恢復最迅速,3周后功能恢復基本穩定。損傷組各時間點大鼠評分均低于假手術組(P<0.05)。見圖1。
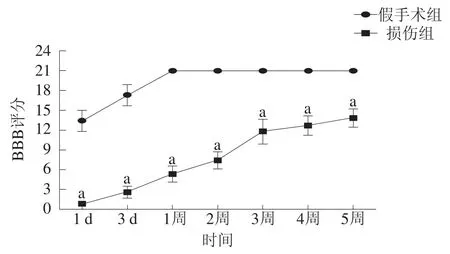
圖1 術后兩組各時間點BBB評分比較
2.3MEP
損傷組MEP的N1和P1波潛伏期均顯著長于假手術組(P<0.001),振幅顯著低于假手術組(P<0.001)。見圖2、圖3。
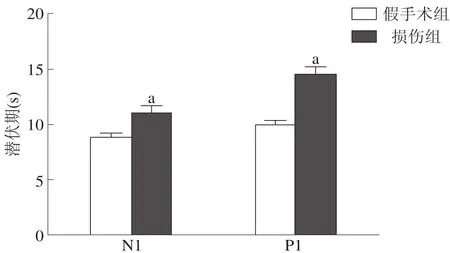
圖2 兩組大鼠MEPN1和P1波潛伏期比較
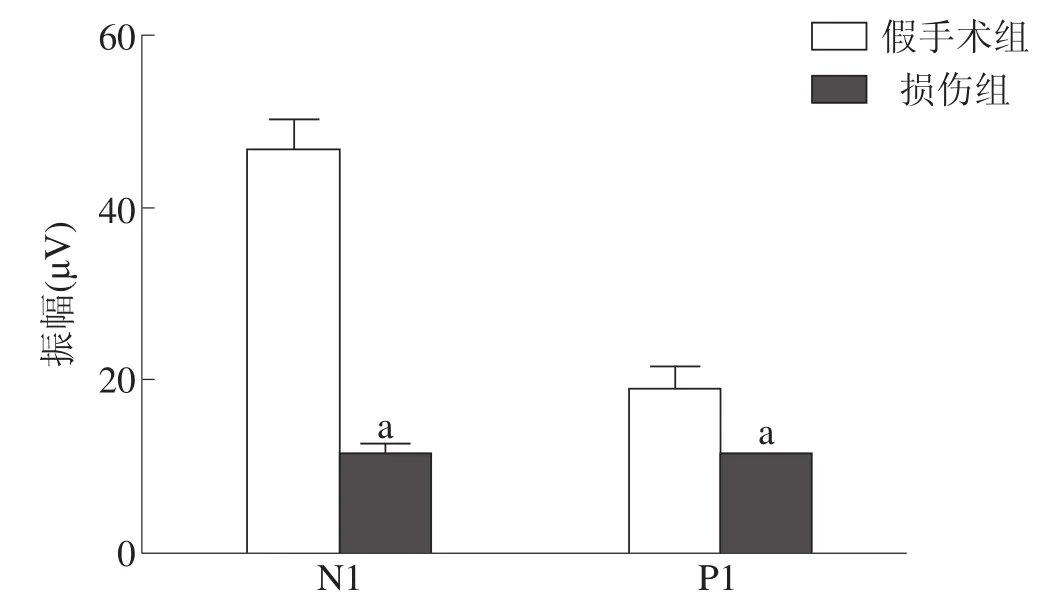
圖3 兩組大鼠MEPN1和P1波振幅比較
2.4Morris水迷宮
損傷組和假手術組找到平臺的潛伏期均隨著訓練時間的增加而降低;各時間點損傷組的潛伏期顯著長于假手術組(P<0.001)。見圖4。
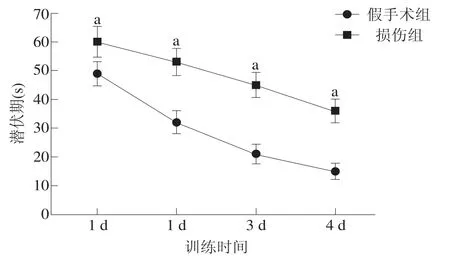
圖4 兩組大鼠到達平臺潛伏期比較
探索實驗時,損傷組經過目標象限的時間顯著低于假手術組(P<0.001)。假手術組找尋平臺的路線77%是空間定位,顯著高于損傷組的48%。見圖5、圖6。
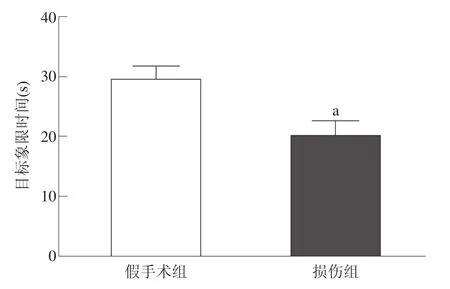
圖5 兩組大鼠經過目標象限時間比較
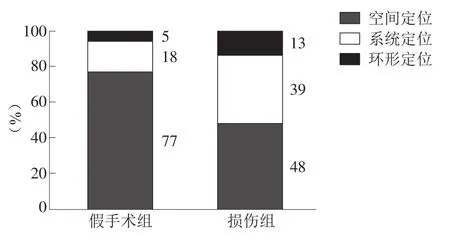
圖6 兩組大鼠搜尋平臺方式比較
2.5海馬病理
假手術組齒狀回顆粒細胞排列整齊結構緊密,形態完整,細胞核飽滿、核仁清晰。損傷組海馬內病理變化主要以齒狀回細胞為主:1周時可見齒狀回顆粒細胞排列較稀疏、紊亂,有少量細胞形態不規則,呈三角形、胞膜皺縮、胞核固縮、破裂、濃染,核仁模糊或消失;3周、5周時細胞排列更稀疏,形態異常細胞逐漸增多,正常存活細胞逐漸減少。見圖7。
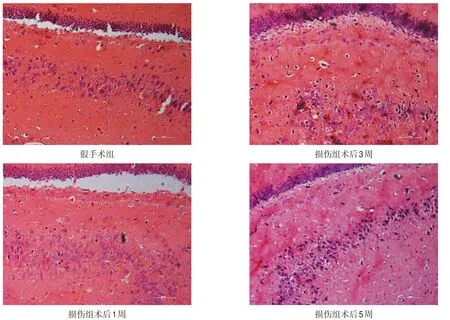
圖7 不同時間點大鼠海馬齒狀回病理變化(HE染色,200×)
損傷組存活細胞比例少于假手術組(P<0.05),并隨著時間推移逐漸減少。見圖8。
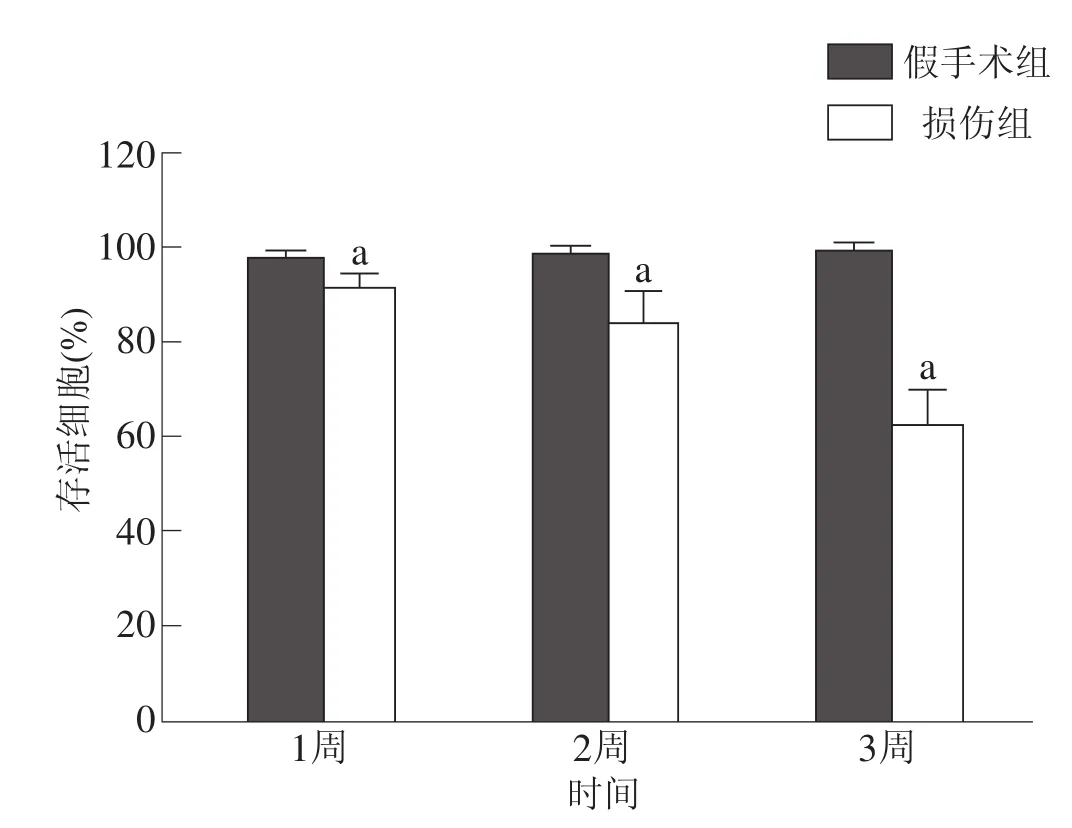
圖8 術后兩組各時間點海馬齒狀回存活細胞百分比比較
3 討論
脊髓損傷的致癱率極高,一直是神經科學領域研究的熱點、難點。長期以來,人們主要關注脊髓本身或其傳入和傳出通路的研究,對脊髓損傷后腦部結構及功能變化的研究較少。隨著研究進展,人們發現脊髓損傷后腦內重要組織的結構和功能也會發生改變。
脊髓損傷后幾分鐘內就可引起大腦皮質網絡結構發生廣泛改變,為早期大腦皮層萎縮與重塑的基礎[4-5]。臨床及基礎研究均證實,脊髓損傷能夠引起大腦皮層發生結構及功能重塑[6-7],可能為脊髓損傷后上行神經傳導阻滯所致[8]。脊髓損傷早期補充外源性神經營養因子,可以減少大腦皮質萎縮,促進神經功能恢復與重塑[9]。
海馬是脊髓損傷后最易損傷的腦部結構,可能與脊髓損傷能夠選擇性引起海馬內腦源性神經營養因子(brain-derivedneurotrophicfactor, BDNF)變化有關[10-11]。
Morris水迷宮測試是大鼠學習記憶功能的常用方法之一[3]。分析找尋目標的路線方式,可以排除運動功能障礙對結果的影響,從而更客觀地評價其空間記憶能力[12]。本研究沒有評估通過平臺次數、運動路程及速度等指標,也是為了降低運動功能障礙對實驗結果的影響。本研究顯示,脊髓損傷后大鼠的空間學習記憶功能受損。
MEP主要用來評估腦部到脊髓傳導通路是否正常。運動皮層的前半部分控制上肢運動,后半部分控制下肢運動。波幅大小可以反映放電神經元的數量及功能狀態,波幅下降說明神經元的興奮性降低[13]。N1波潛伏期與神經傳導速度及傳導路徑中所經歷的突觸數和突觸延擱時間有關[14-16]。相同條件下,N1波潛伏期可以反映腦內細胞損傷的嚴重程度。本研究顯示,脊髓損傷后,腦內重要結構發生損傷。
海馬是參與學習、記憶等高級腦功能的重要結構成分,海馬損傷嚴重影響學習記憶功能[17]。本研究顯示,脊髓損傷后,海馬齒狀回細胞發生病理變化。成年海馬齒狀回的顆粒細胞存在再生功能,終生保持生成新神經元的能力,這種新生神經元對海馬功能的維持至關重要[18]。在學習記憶時,主要依靠海馬齒狀回新生神經元形成新的突觸聯系,將不同的時間及空間信息連接起來。同時,齒狀回新生神經元具有一定的可塑性,與海馬突觸的長時效應密切相關,也是學習記憶的重要機制。脊髓損傷后,海馬齒狀回顆粒細胞發生病理改變,可能引起其認知功能障礙。
引起海馬病理改變的機制還不清楚。大鼠脊髓損傷后,可通過激活細胞周期蛋白活化小膠質細胞,從而引起腦內炎癥反應,誘導海馬結構及功能變化,導致其認知功能障礙[19-20]。脊髓損傷誘導腦內炎癥反應的具體途徑及機制推測可能與腦內神經遞質變化或促炎細胞因子及神經毒素分子有關[21-22]。也有學者認為可能與慢性社會心理應激有關[23]。這些假設尚需進一步深入研究驗證。
脊髓損傷可引起腦內重要組織發生結構及功能改變。這對于臨床治療脊髓損傷及進一步探究脊髓損傷的完整機制有指導意義。提示臨床治療脊髓損傷患者時,不能僅關注脊髓功能,也要對腦給予足夠重視。
[參考文獻]
[1] Basso DM, Beattie MS, Bresnahan JC. A sensitive and reliable locomotor rating scale for open field testing in rats [J]. J Neurotrauma, 1995, 12(1): 1-21.
[2]趙中興,伍亞民.一種新的大鼠創傷后應激障礙模型的建立及其行為學檢測[J].第三軍醫大學學報, 2012, 34(10): 928-932.
[3] Zhao Z, Loane DJ, Murray MG 2nd, et al. Comparing the predictive value of multiple cognitive, affective, and motor tasks after rodent traumatic brain injury [J]. JNeurotrauma, 2012, 29 (15): 2475-2489.
[4] Aguilar J, Valera DH, Calvino EA, et al. Spinal cord injury immediately changes the state of the brain [J]. J Neurosci, 2010, 30(22): 7528-7537.
[5] Zhu L, Wu G, Zhou X, et al. Altered spontaneousbrain activity inpatients with acute spinal cord injury revealed by resting-statefunctional MRI [J]. PLoSOne, 2015, 10(3): 1-11.
[6] Lau BY, Foldes AE, Alieva NO, et al. Increased synapsin expression and neurite sprouting in lamprey brain after spinalcordinjury [J]. Exp Neurol, 2011, 228(2): 283-293.
[7] Zhang K, Zhang J, Zhou Y, et al. Remodeling the dendritic spines in the hindlimb representation of the sensory cortex after spinal cord hemisection in mice[J]. PLoSOne, 2015, 10(7): 1-16.
[8] Freund P, Weiskopf N, Ward NS, et al. Disability, atrophy and cortical reorganization following spinal cord injury [J]. Brain, 2011, 134(Pt 6): 1610-1622.
[9] Ramu J, Bockhorst KH, Grill RJ, et al. Cortical reorganization in NT3-treated experimental spinal cord injury: functional magneticresonanceimaging[J]. Exp Neurol, 2007, 204(1): 58-65.
[10] Fumagalli F, Madaschi L, Caffino L, et al. Acute spinal cord injury reduces brain derived neurotrohic factor expression in rat hippocampus[J]. Neuroscience, 2009, 159(3): 936-939.
[11] Gomez-Pinilla F, Ying Z, Zhuang Y. Brain and spinal cord interaction: protectiveeffectsof exerciseprior to spinal cord injury [J]. PLoSOne, 2012, 7(2): 1-8.
[12] Wu JF, Stoica BA, Luo T, et al. Isolated spinal cord contusion in ratsinduceschronic brain neuroinflammation, neurodegeneration, and cognitive impairment [J]. Cell Cycle, 2014, 13(15): 2446-2458.
[13] Amorim A, Pereira L. Prosand consin theuseof SNPsin forensic kinship investigation: a comparative analysis with STRs[J]. Forensic Sci Int, 2005, 150(1): 17-21.
[14]孟素峰,李有清,王啟明.體感誘發電位監測脊髓缺血再灌注損傷的實驗研究[J].南方醫科大學學報, 2010, 30(1): 76-83.
[15]伍亞民,王正國,朱佩芳.缺血損傷脊髓運動誘發電位的變化及其意義[J].中華物理醫學與康復雜志, 2000, 22(5): 294-296.
[16] Lee KH, Kim UJ, Park YG, et al. Optical imaging of somatosensory evoked potentials in the rat cerebral cortex after spinal cordinjury [J]. JNeurotrauma, 2011, 28(5): 797-807.
[17] Meyers RA, ZavalaAR, Neisewander JL. Dorsal, but not ventral, hippocampal lesions disrupt cocaine place conditioning[J]. Neuroreport, 2003, 14(16): 2127-2131.
[18] Drapeau E, Mayo W,Aurousseau C, et al. Spatial memory performances of aged rats in the water maze predict levels of hippocampal neurogenesis [J]. PNAS, 2003, 100(24): 14385-14390.
[19] Wu JF, Zhao ZR, Stoica BA, et al. Spinal cord injury causes brain inflammation associated with cognitive and affective changes: role of cell cycle pathways [J]. J Neurosci, 2014, 34 (33): 10989-11006.
[20] Kumar A, Loane DJ. Neuroinflammation after traumatic brain injury: opportunities for therapeutic intervention [J]. Brain Behav Immun, 2012, 26(8): 1191-1201.
[21] Wecht JM, Bauman WA. Decentralized cardiovascular autonomic control and cognitive deficits in persons with spinal cordinjury [J]. JSpinal Cord Med, 2013, 36(2): 74-81.
[22] Zhang B, Huang Y, Su Z, et al. Neurological, functional, and biomechanical characteristics after high-velocity behind armor blunt trauma of the spine [J]. J Trauma, 2011, 71(6): 1680-1688.
[23] Dranovsky A, Hen R. Hippocampal neurogenesis: regulation by stress and antidepressants [J]. Biol Psychiatry, 2006, 59 (12): 1136-1143.
作者單位:1.蘭州大學第二臨床醫學院骨科,甘肅蘭州市730030;2.甘肅省骨關節疾病研究重點實驗室,甘肅蘭州市730030;3.第三軍醫大學大坪醫院野戰外科研究所三室,創傷燒傷與復合傷國家重點實驗室,重慶市400042。作者簡介:馮東亮(1989-),男,河南駐馬店市人,碩士研究生,主要研究方向:脊柱脊髓損傷。通訊作者:張海鴻,主任醫師,副教授,碩士研究生導師,主要研究方向:脊柱外科。E-mail: zhanghaihong1968@sina.com。
Learningand Memory Impairment and Pathologyin Hippocampusin Ratswith Spinal Cord Injury
FENG Dong-liang1,2, NAN Wei1,2, WU Ya-min3, WANG Li3, JIANG Long3, ZHOU Kai-sheng1,2, ZHU Yan-dong1,2, WANGJing1,2, HONGYou-jian3, LONGZai-yun3, ZHANGHai-hong1,2
1. Department of Orthopedics, Second Clinical Medical College of Lanzhou University, Lanzhou, Gansu 730030, China; 2. Key Laboratory of Orthopedics of Gansu Province, Lanzhou, Gansu 730030, China; 3. Department 3 of Research Instituteof Surgery, Daping Hospital, Third Military Medical University, State Key Laboratory of Trauma, Burns and Combined Injury, Chongqing400042, China
Abstract:Objective To explore the learning and memory impairment and pathology in hippocampus in rats after spinal cord contusion. Methods36 adult female Sprague-Dawley rats were randomly divided into sham group (n=18) and spinal cord injury group (n=18). Spinal cord injury model at T10was established with modified Allen's technique (10 g×25 mm). The hindlimbs behavior of rats was rated with Basso-Beattie-Bresnahan (BBB) scoresonceaweek for 5 weeks. They weretested with motor evoked potentials(MEP) and Morriswater maze5 weeksafter injury. Thepathology of hippocampuswasdetected with HE staining 1 week, 3 weeksand 5 weeksafter injury, 4 rats in agroup, repectively. ResultsTheBBB scoresweresignificantly lower in thespinal cord injury group than in thesham group at each time point (P<0.05). The latencies of both N1 and P1 wave of MEPwere significantly longer in the spinal cord injury group than in the sham group(P<0.001), whiletheamplitudesweresignificantly less(P<0.001). For theMorriswater maze, thelatency of arrival platformweresignificantly longer in the spinal cord injury group than in the sham group (P<0.001), and the time in target was significantly less (P<0.001), with moresystematic positioning or annular positioning, whilethesham group with morespace-based positioning. Morphologically abnormal cellsin hippocampusgradually increased sincethefirst week after injury, with thedecreaseof cellssurvival, whileit wasnormal in the sham group. Conclusion Spinal cord contusion can causelearning and memory impairment in rats, which may berelated to injury in hippocampus.
Keywords:spinal cordinjury; learningandmemory; hippocampus; pathology; rats
(收稿日期:2015-08-04修回日期:2015-08-28)
DOI:10.3969/j.issn.1006-9771.2015.11.007
[中圖分類號]R651.2
[文獻標識碼]A
[文章編號]1006-9771(2015)11-1267-06

