RNA干擾沉默Fra-1基因對膀胱癌T24細胞侵襲和遷移的影響
謝海峰,張宏波,喬慶東,馬小芳,孟翔宇(.河南省新鄉市中心醫院泌尿外一科,河南新鄉45000;.鄭州大學基礎醫學院解剖學教研室,河南鄭州45000;.鄭州大學基礎醫學院基礎腫瘤學教研室,河南鄭州45000)
RNA干擾沉默Fra-1基因對膀胱癌T24細胞侵襲和遷移的影響
謝海峰1,張宏波2,喬慶東1,馬小芳3,孟翔宇2
(1.河南省新鄉市中心醫院泌尿外一科,河南新鄉453000;2.鄭州大學基礎醫學院解剖學教研室,河南鄭州450001;3.鄭州大學基礎醫學院基礎腫瘤學教研室,河南鄭州450001)
摘要:目的研究RNA干擾沉默Fra-1基因表達對人膀胱癌T24細胞侵襲及遷移能力的影響。方法設計合成Fra-1特異性siRNA并轉染人膀胱癌T24細胞。實驗設空白對照組(轉染時只加脂質體)、陰性對照組(無關序列siRNA轉染)和干擾組(Fra-1特異siRNA轉染)。采用RT-PCR檢測Fra-1、MMP-2及MMP-9 mRNA水平。Western blot檢測Fra-1、MMP-2、MMP-9、STAT3及磷酸化STAT3(p-STAT3)蛋白表達水平,Transwell小室法和劃痕實驗檢測細胞侵襲和遷移能力。結果干擾組T24細胞Fra-1、MMP-2及MMP-9 mRNA水平較其他兩組明顯降低(P<0.01),并且其MMP-2、MMP-9及p-STAT3蛋白表達受到明顯抑制(P< 0.01)。干擾組T24細胞侵襲力和遷移力較其他兩組明顯下降(P<0.01)。結論RNA干擾可有效抑制T24細胞中Fra-1基因的表達,降低細胞侵襲及遷移能力,其機制可能與STAT3/MMPs信號通路有關。
關鍵詞:膀胱腫瘤;RNA干擾;轉染;Fra-1;STAT3;MMPs
Fra-1基因定位于染色體11q13,編碼長度為1.7 kb的成熟mRNA,其表達產物Fra-1蛋白由271個氨基酸組成,作為核轉錄因子AP-1家族中Fos亞家族的成員之一,其可通過亮氨酸拉鏈結構域與Jun蛋白形成異源二聚體,調控靶基因轉錄,介導細胞的生長、發育、分化及凋亡[1]。Fra-1在多種腫瘤組織中高表達,參與腫瘤發生、發展及侵襲轉移[1-3]。本研究中,筆者采用RNA干擾技術抑制膀胱移行細胞癌T24細胞中Fra-1基因的表達,觀察對T24細胞侵襲及遷移能力的影響并探討其分子機制,為以Fra-1為靶點的膀胱癌基因治療提供理論和實驗依據。
1 材料與方法
1.1細胞和試劑
人膀胱移行細胞癌T24細胞株購自中國科學院上海生命科學研究院細胞資源中心,RT-PCR試劑盒為大連TaKaRa生物公司產品,兔抗人Fra-1、MMP-2、MMP-9及β-actin多克隆抗體購自Santa Cruz公司,鼠抗人STAT3,p-STAT3及Matrigel基質膠購自BD公司,HRP標記的羊抗兔及羊抗鼠二抗購自北京中杉金橋公司,Transwell小室購自Costar公司;Lipofectin2000購自Invitrogen公司。
1.2Fra-1 siRNA設計及制備
根據人Fra-1基因(NM_005438.3)設計序列:正向引物5'-GUUCCGAGCGGACGGGUCCUU-3',反向引物3'-GGACCCGUCCGCUCGGAACUU-5'。siRNA序列均由廣州銳博公司合成并純化。為了避免可能偏靶,采用嚴格BALST進行比對,GenBank中證實Fra-1 siRNA僅與Fra-1基因存在相應的匹配位點,無關序列dsRNA與任何已知哺乳動物基因無匹配。
1.3細胞培養及siRNA轉染
采用無抗生素、含體積分數10%FBS的RPMI 1640培養液,在37℃、體積分數為5%二氧化碳CO2條件下培養T24細胞。調整細胞濃度,接種至6孔板,每孔約1×106個細胞。實驗分成3組,空白對照組(轉染時只加脂質體)、陰性對照組(無關序列siRNA轉染)和干擾組(Fra-1特異siRNA轉染)。待細胞生長至70%~80%時,采用脂質體Lipofe-ctamine 2000轉染,轉染步驟嚴格按照說明書進行。
1.4轉染效率觀察
細胞轉染48 h后,使用480 nm波長藍光激發,熒光顯微鏡下觀察細胞,判斷轉染效率。
1.5RT-PCR檢測Fra-1、MMP-2及MMP-9 mRNA水平
細胞轉染48 h后收集細胞,PBS洗滌2、3次,按Trizol說明書操作提取細胞總RNA,取2μg總RNA用MMLV逆轉錄酶將其逆轉錄為cDNA。以2μl的cDNA為模板進行PCR擴增,β-actin為內參照。引物由上海英駿生物技術有限公司合成(見附表)。PCR擴增條件:94℃預變性5 min,然后94℃變性30 s,57℃退火30 s,72℃延伸10 s,總共30個循環,最后72℃延長5 min。PCR產物經2%瓊脂糖凝膠電泳。紫外線透射觀察儀觀察并照相。

附表RT-PCR引物序列
1.6Western blot檢測Fra-1、MMP-2,MMP-9、STAT3及p-STAT3蛋白表達
轉染48 h后收集細胞,使用預冷的裂解液對細胞進行裂解,按說明書操作提取蛋白,Bradford法進行蛋白質定量。SDS-PAGE(8%分離膠,5%濃縮膠)電泳后,蛋白質濕轉至PVDF膜上。5%脫脂奶粉封閉,分別加入稀釋的一抗37℃孵育2 h,TBST洗膜后,加入相應的辣根酶標記的二抗37℃孵育1 h,TBST洗膜。化學發光增強液與膜充分接觸,暗室曝光顯影,沖洗膠片,凝膠成像系統掃描成像。
1.7Transwell侵襲實驗
用50 mg/L Matrigel(1∶8)稀釋液包被Transwell小室底部膜的上室面,4℃風干,37℃水化30 min,取轉染48 h細胞,用100μl含0.1%BSA的無血清培養基調整細胞密度至1×106個細胞/ml并將懸液加入Transwell小室,下室加入600μl完全培養基作為趨化劑,培養24 h。取出上室,用棉簽擦去上室中未侵襲細胞,PBS浸洗1遍。10%甲醇固定30 s,PBS連續洗3遍。用0.2%結晶紫染色10 min,用棉簽擦去多余結晶紫,PBS再洗3遍。光鏡下觀察濾膜下表面的細胞,隨機選取5個視野的細胞計數,取平均值。
1.8劃痕實驗
收集對數生長期細胞,以1×106個/孔密度接種于6孔培養板。24 h后進行細胞轉染,步驟同1.3。轉染6 h后,用無菌Tip頭(規格200μl)在單層細胞上做“1”字形劃痕,寬度和長度在1 mm×20 mm左右,每組設3個復孔。用無血清培養基輕輕吹打劃痕附近,吸去培養基,反復3次,盡量將刮掉的細胞沖洗干凈。加入不含雙抗無FBS的RPMI 1640培養液繼續培養,于24和48 h觀察并拍照,顯微鏡下計數單位面積劃痕區內遷移的細胞數。
1.9統計學方法
采用SPSS17.0軟件進行數據分析,實驗數據用均數±標準差(±s)表示,組間比較用單因素方差分析,以P<0.05為差異有統計學意義。
2 結果
2.1細胞轉染效率
T24細胞轉染48h后,熒光顯微鏡下觀察,陰性對照組和干擾組90%以上細胞可見綠色熒光(見圖1)。
2.2siRNA對T24細胞Fra-1、MMP-2及MMP-9 mRNA水平的影響
由圖2顯示,Fra-1 siRNA轉染可有效抑制T24細胞Fra-1、MMP-2及MMP-9 mRNA的表達,其抑制率分別為51.5%、47.3%和35.6%(P<0.01)。陰性對照組與空白對照組比較,差異無統計學意義(P> 0.05)。
2.3siRNA對T24細胞Fra-1、MMP-2、MMP-9、STAT3及p-STAT3蛋白表達的影響
由圖3顯示,與空白對照組比較,干擾組細胞Fra-1、MMP-2、MMP-9及p-STAT3蛋白表達明顯下調(P<0.01),其下調量分別為65.4%、53.7%、47.0%和81.0%,而總STAT3蛋白表達無明顯變化(P>0.05)。空白對照組與陰性對照組比較差異無統計學意義(P>0.05)。
2.4siRNA對T24細胞體外侵襲和遷移能力的影響
Transwell侵襲實驗結果見圖4,空白對照組、陰性對照組及干擾組中穿透Matrigel膜的細胞數分別為(505.7±51.6)、(496.5±49.7)和(307.5±47.1)。干擾組細胞侵襲能力較空白對照組和陰性對照組分別減少39.2%(P<0.01)和38.1%(P<0.01),而空白對照組與陰性對照組間比較,差異無統計學意義(P>0.05)。
劃痕實驗結果見圖5,劃痕處理24 h后,空白對照組、陰性對照組及干擾組中遷移細胞數分別為(32.7±0.3)、(31.5±0.5)和18.3±0.6)。劃痕處理48 h后,以上3組中遷移細胞數分別為(53.6±1.8),(51.3±2.1)和(29.5±1.5)。在兩個時間點,干擾組分別與其他兩組比較,差異有統計學意義(P<0.01),而空白對照組與陰性對照組比較,差異無統計學意義(P>0.05)。
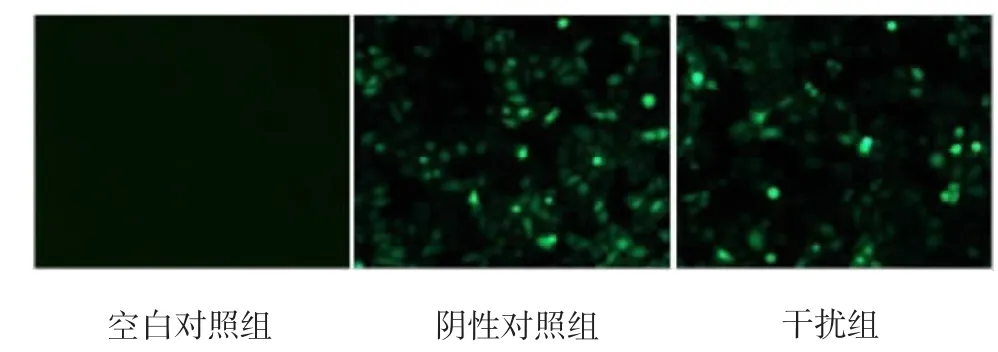
圖1 T24細胞轉染48 h后熒光顯微鏡觀察結果
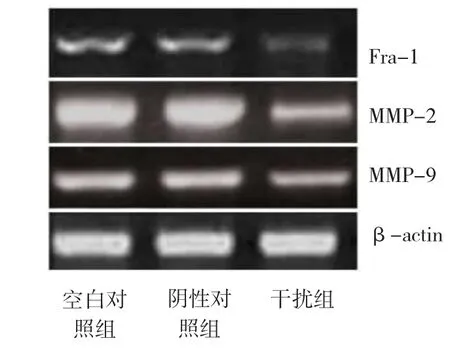
圖2 RT-PCR檢測T24細胞Fra-1、MMP-2 和MMP-9 mRNA水平
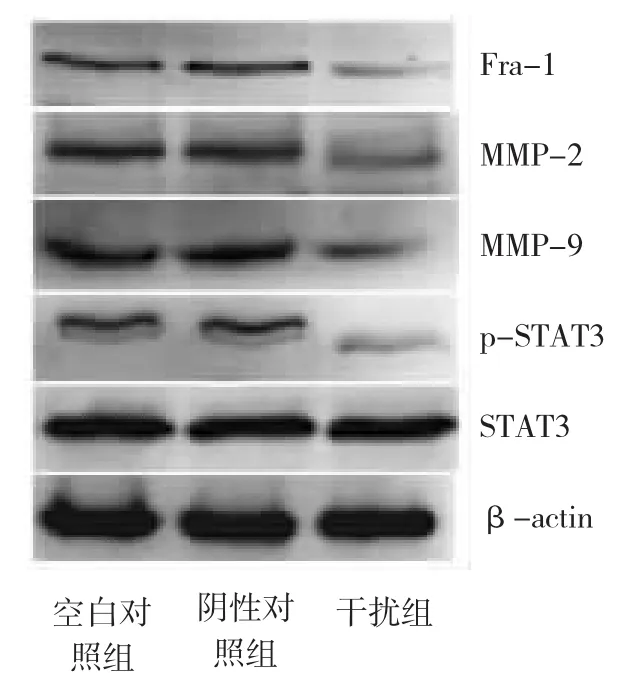
圖3 Western blot檢測T24細胞Fra-1、MMP-2、MMP-9、STAT3及p-STAT3蛋白表達

圖4 Transwell小室法檢測T24細胞的侵襲能力

圖5 劃痕實驗檢測T24細胞的遷移能力
3 討論
膀胱癌是我國最常見的泌尿系腫瘤,占全部惡性腫瘤的3.2%,具有惡性程度高、浸潤發展、易轉移及復發率高等特點,其中侵襲和轉移是臨床上導致膀胱癌治療失敗的主要原因。本實驗以T24細胞為研究對象,該細胞株來源于轉移性人膀胱移行細胞癌,適合膀胱癌的侵襲轉移研究。
Fra-1在腫瘤組織的高表達與腫瘤的侵襲能力密切相關。DESMET等[3]發現RNA干擾Fra-1后乳腺癌細胞的體內侵襲能力顯著降低,認為Fra-1與腫瘤轉移及復發密切相關,可作為乳腺癌預后的指標。SAYAN等[4]亦發現80%侵襲性膀胱癌中Fra-1呈高表達,Fra-1可通過直接上調受體酪氨酸激酶AXL影響膀胱癌細胞的侵襲能力。本實驗中,筆者亦證實膀胱癌T24細胞表達Fra-1,siRNA轉染后Fra-1 mRNA水平及蛋白表達量均明顯下調,并且細胞的遷移及侵襲能力顯著減弱。
MMP-2和MMP-9是基質金屬蛋白酶類(matrix metallopmteinase,MMP)家族中的重要成員,能夠降解Ⅳ型、Ⅴ、Ⅵ及Ⅹ型膠原等多種細胞外基質成分[5]。臨床研究表明[6],膀胱癌的惡性程度、侵襲轉移能力及預后與MMP-2及MMP-9異常高表達密切相關。ADISESHAIAH等[7]發現,Fra-1可通過誘導MMP-1、MMP-9活性及EGFR信號途徑活化增強肺癌上皮細胞的侵襲能力。KIMURA等[8]亦發現骨肉瘤143B細胞中MMP-1的基因表達依賴于Fra-1激活。SCHR魻ER等[9]發現宮頸癌細胞中,STAT3可通過間接誘導單核細胞趨化蛋白-1而上調MMP-9的表達。本實驗中,通過RNA干擾下調T24細胞Fra-1基因表達后發現,細胞MMP-2及MMP-9 mRNA水平和蛋白表達量均明顯下調,說明RNA干擾下調Fra-1表達可影響侵襲相關基因MMP-2及MMP-9表達,從而抑制膀胱癌細胞的侵襲能力。
細胞因子或生長因子與相應的受體結合后可募集JAKs催化受體的酪氨酸殘基磷酸化并活化STAT3,使之轉運到細胞核內與特定DNA序列結合,調控基因轉錄[10]。已有研究表明[11-12],STAT3信號通路可在增殖、分化、侵襲、轉移、血管形成及抗凋亡等多方面參與腫瘤的發生、發展。ZUGOWSKI等[13]發現AP-1可激活Stat3,上調其下游基因MMP-1表達,增強結腸癌細胞的侵襲能力。此外,LUO等[14]還發現Fra-1可活化乳腺癌細胞Stat3信號途徑,上調MMP9、VEGF及TGF-β表達,從而增強腫瘤細胞的侵襲和轉移能力。本實驗發現干擾組中p-STAT3蛋白表達下調81%,說明RNA干擾可明顯抑制T24細胞中STAT3磷酸化,從而阻斷STAT3活化,有效地調控其下游的侵襲相關基因MMP-2及MMP-9的表達。
本實驗研究初步證實RNA干擾沉默Fra-1基因可有效抑制T24細胞中Fra-1基因表達,降低T24細胞的侵襲及遷移能力,其分子機制可能與STAT3/ MMPs信號通路有關,提示Fra-1可作為膀胱腫瘤基因治療的理想靶點。
參考文獻:
[1] YOUNG MR, COLBURN NH. Fra-1 a target for cancer prevention or intervention[J]. Gene, 2006, 379: 1-11.
[2] USUI A, HOSHINO I, AKUTSU Y, et al. The molecular role of Fra-1 and its prognostic significance in human esophageal squamous cell carcinoma[J]. Cancer, 2012, 118(13): 3387-3396.
[3] DESMET CJ, GALLENNE T, PRIEUR A, et al. Identification of a pharmacologically tractable Fra-1/ADORA2B axis promoting breast cancer metastasis [J]. Proc Natl Acad Sci USA, 2013, 110 (13): 5139-5144.
[4] SAYAN AE, STANFORD R, VICKERY R, et al. Fra-1 controls motility of bladder cancer cells via transcriptional upregulation of the receptor tyrosine kinase AXL [J]. Oncogene, 2012, 31 (12): 1493-1503.
[5]SHUMANMOSSLA,JENSEN-TAUBMANS, STETLER-STEVE-NSON WG. Matrix metalloproteinases: changing roles in tumor progression and metastasis[J]. Am J Pathol, 2012, 181(6): 1895-1899.
[6] OFFERSEN BV, KNAP MM, HORSMAN MR, et al. Matrix metalloproteinase-9 measured in urine from bladder cancer patients is an independent prognostic marker of poor survival [J]. Acta Oncol, 2010, 49(8): 1283-1287.
[7] ADISESHAIAH P, VAZ M, MACHIREDDY N, et al. A Fra-1-dependent, matrix metalloproteinase driven EGFR activation promotes human lung epithelial cell motility and invasion[J]. J Cell Physiol, 2008, 216(2): 405-412.
[8] KIMURA R, ISHIKAWA C, ROKKAKU T, et al. Phosphorylated c-Jun and Fra-1 induce matrix metalloproteinase-1 and thereby regulate invasion activity of 143B osteosarcoma cells[J]. Biochim Biophys Acta, 2011, 1813(8): 1543-1553.
[9] SCHR魻ER N, PAHNE J, WALCH B, et al. Molecular pathobiology of human cervical high-grade lesions: paracrine STAT3 activation in tumor-instructed myeloid cells drives local MMP-9 expression[J]. Cancer Res, 2011, 71(1): 87-97.
[10] JOHNSTON PA, GRANDIS JR. STAT3 signaling: anticancer strategies and challenges[J]. Mol Interv, 2011, 11(1): 18-26.
[11] WANG XH, LIU BR, QU B, et al. Silencing STAT3 may inhibit cell growth through regulating signaling pathway, telomerase, cell cycle, apoptosis and angiogenesis in hepatocellular carcinoma: potential uses for gene therapy[J]. Neoplasma, 2011, 58(2): 158-171.
[12] ERNST M, PUTOCZKI TL. Stat3: linking inflammation to (gastrointestinal) tumourigenesis [J]. Clin Exp Pharmacol Physiol, 2012, 39(8): 711-718.
[13] ZUGOWSKI C, LIEDER F, M譈LLER A, et al. STAT3 controls matrix metalloproteinase-1 expression in colon carcinoma cells by both direct and AP-1-mediated interaction with the MMP-1 promoter[J]. Biol Chem, 2011, 392 (5): 449-459.
[14] LUO YP, ZHOU H, KRUEGER J, et al. The role of proto-oncogene Fra-1 in remodeling the tumor microenvironment in support of breast tumor cell invasion and progression[J]. Oncogene, 2010, 29(5): 662-673.
(申海菊編輯)
Effects of Fra-1 gene silencing by small interfering RNA on invasion and metastasis of bladder cancer T24 cells
Hai-feng XIE1, Hong-bo ZHANG2, Qing-dong QIAO1, Xiao-fang MA3, Xiang-yu MENG2(1. Department of Urology, Xinxiang Central Hospital, Xinxiang, Henan 453000, P.R. China; 2. Department of Anatomy, 3. Department of Basic Oncology, School of Basic
Medicine, Zhengzhou University, Zhengzhou, Henan 450001, P.R. China)
Abstract:【Objective】To investigate the effects of Fra-1 gene silencing by small interfering RNA (siRNA) on invasion and migration of bladder cancer T24 cells in vitro.【Methods】The Fra-1 siRNA was constructed and then transfected into T24 cells in vitro. The blank control group, negative control group and siRNA transfection group were designed in this study. The expression level of Fra-1, MMP-2 and MMP-9 mRNAs were detected by RT-PCR. The expressions of Fra-1, MMP-2, MMP-9, total STAT3 and p-STAT3 proteins were detected by Western blot. The invasion and migration capabilities were evaluated by using Transwell chamber migration assay and scratch wound healing assay, respectively.【Results】The levels of Fra-1 mRNA, MMP-2 and MMP-9 mRNAs in the siRNA transfection group were significantly decreased compared with that in other groups (P< 0.01), so were the expressions of MMP-2, MMP-9 and p-STAT3 proteins (P< 0.01). In the siRNA transfection group, the invasion and migration capabilities of T24 cells were also significantly decreased compared with those in other groups (P< 0.01).【Conclusions】Small interfering RNA can efficiently inhibit the expression of Fra-1, which results in decreased capacities of invasion and migration of T24 cells. The mechanism may be involved in STAT3/MMPs signaling pathway.
Key words:bladder tumor; small interfering RNA; transfection; Fra-1; STAT3; matrix metalloproteinase
[通信作者]張宏波,E-mail:zhanghb@zzu.edu.cn
收稿日期:2014-11-28
文章編號:1005-8982(2015)23-0023-05
中圖分類號:R737.14
文獻標識碼:A

