大鼠原代神經(jīng)細(xì)胞放射性損傷敏感性與ROS含量關(guān)系及依達(dá)拉奉的保護(hù)作用
高 晨,田立樁,朱文霞,劉玉虎,吳信篤,趙 昱,趙福貴
蘭州軍區(qū)蘭州總醫(yī)院1安寧分院神經(jīng)外科;2神經(jīng)外科;3安寧分院創(chuàng)傷外科,甘肅蘭州 730070
大鼠原代神經(jīng)細(xì)胞放射性損傷敏感性與ROS含量關(guān)系及依達(dá)拉奉的保護(hù)作用
高 晨1,田立樁2,朱文霞3,劉玉虎1,吳信篤1,趙 昱1,趙福貴1
蘭州軍區(qū)蘭州總醫(yī)院1安寧分院神經(jīng)外科;2神經(jīng)外科;3安寧分院創(chuàng)傷外科,甘肅蘭州 730070
目的:探討大鼠原代神經(jīng)細(xì)胞培養(yǎng)體系放射性損傷敏感性與ROS含量關(guān)系以及依達(dá)拉奉的保護(hù)作用。方法:X射線單次照射來(lái)源于大鼠海馬的原代神經(jīng)元、星形膠質(zhì)細(xì)胞以及星形膠質(zhì)細(xì)胞-神經(jīng)元共培養(yǎng)體系,對(duì)比評(píng)價(jià)正常培養(yǎng)或依達(dá)拉奉干預(yù)與否條件下細(xì)胞死亡、凋亡以及活性氧(ROS)含量變化。結(jié)果:X射線照射引起原代神經(jīng)元培養(yǎng)體系ROS含量及細(xì)胞死亡率明顯升高。共培養(yǎng)體系細(xì)胞損傷較輕,星形膠質(zhì)細(xì)胞培養(yǎng)體系則無(wú)明顯損傷。依達(dá)拉奉通過(guò)清除ROS可以阻止細(xì)胞死亡。結(jié)論:放射損傷后,原代神經(jīng)元培養(yǎng)體系ROS含量明顯增高,導(dǎo)致神經(jīng)元凋亡失調(diào)。依達(dá)拉奉通過(guò)清除ROS逆轉(zhuǎn)這一病理過(guò)程而產(chǎn)生神經(jīng)元保護(hù)作用,值得臨床推廣。
共培養(yǎng);放射性損傷;活性氧;依達(dá)拉奉;神經(jīng)保護(hù)
頭頸部腫瘤的有效治療手段之一是放射治療,在殺傷腫瘤細(xì)胞的同時(shí),隨之而來(lái)的放射性腦損傷也是目前各種放療手段均不能完全避免的副損傷。近年來(lái)影像診斷技術(shù)的進(jìn)步使得放射性腦損傷的檢出率逐漸增加,成為不可忽視的醫(yī)源性損傷原因之一[1]。研究表明,中樞神經(jīng)系統(tǒng)各類細(xì)胞在射線照射后反應(yīng)不盡相同。星形膠質(zhì)細(xì)胞出現(xiàn)反應(yīng)性增生[2],小膠質(zhì)細(xì)胞增殖并釋放出炎癥介質(zhì)[3],少突膠質(zhì)細(xì)胞產(chǎn)生放射性脫髓鞘改變[4]并伴隨凋亡增加[5],而血管內(nèi)皮細(xì)胞肥大導(dǎo)致血管壁增厚[6]。神經(jīng)元在放射性損傷后出現(xiàn)大量凋亡[7],尤其是海馬神經(jīng)元對(duì)放射線更為敏感,損傷后出現(xiàn)海馬依賴性進(jìn)行性功能損害,在學(xué)習(xí)、記憶和空間信息處理等方面發(fā)生缺陷,其確切的機(jī)制尚不明確。以往研究表明,腦損傷后增殖的星形膠質(zhì)細(xì)胞通過(guò)神經(jīng)內(nèi)分泌及毒素清除作用而保持內(nèi)環(huán)境穩(wěn)定并促進(jìn)神經(jīng)元修復(fù)[8],而腦損傷所致神經(jīng)元凋亡失調(diào)的重要機(jī)制之一是活性氧簇(reactive oxygen species,ROS)的爆發(fā)[9]。新型自由基清除劑依達(dá)拉奉(3-甲基-1-苯基-2-吡唑啉-5-酮,EDA),通過(guò)清除自由基,抑制脂質(zhì)過(guò)氧化,從而抑制腦細(xì)胞、血管內(nèi)皮細(xì)胞、神經(jīng)細(xì)胞的氧化損傷,在顱腦損傷的臨床救治中顯示出良好的療效。本研究分別建立大鼠海馬原代神經(jīng)元、星形膠質(zhì)細(xì)胞以及星形膠質(zhì)細(xì)胞-神經(jīng)元共培養(yǎng)體系,對(duì)比檢測(cè)不同培養(yǎng)體系對(duì)放射性損傷的敏感性。隨后通過(guò)原代細(xì)胞ROS含量檢測(cè),進(jìn)一步探討放射性腦損傷可能機(jī)制以及依達(dá)拉奉的腦保護(hù)作用。
1 材料與方法
1.1 材料
1.1.1 實(shí)驗(yàn)動(dòng)物 胚胎海馬組織取自18 d胎鼠大腦,數(shù)量30只,用以建立原代海馬神經(jīng)元培養(yǎng)體系及星形膠質(zhì)細(xì)胞-神經(jīng)元共培養(yǎng)體系。乳鼠海馬組織取自出生24 h內(nèi)SD乳鼠大腦,數(shù)量10只,用以建立原代海馬星形膠質(zhì)細(xì)胞培養(yǎng)體系。所有實(shí)驗(yàn)動(dòng)物均來(lái)源于蘭州大學(xué)實(shí)驗(yàn)動(dòng)物中心 [SCXK(甘)-0295],動(dòng)物實(shí)驗(yàn)經(jīng)過(guò)醫(yī)院倫理委員會(huì)書面同意,具備動(dòng)物實(shí)驗(yàn)資格,并嚴(yán)格遵循國(guó)際動(dòng)物實(shí)驗(yàn)指南。
1.1.2 主要試劑及儀器 除特別聲明以外,細(xì)胞培養(yǎng)所需試劑均購(gòu)自Gibco公司;胎牛血清購(gòu)自Hy-clone公司;阿糖胞苷、GlutaMax培養(yǎng)基補(bǔ)充物、多聚賴氨酸及L-谷氨酸均購(gòu)自Sigma公司;DAPI購(gòu)自Roche公司;依達(dá)拉奉購(gòu)自南京先聲東元制藥有限公司,批號(hào):H20031342;DCFH-DA試劑盒購(gòu)自江蘇碧云天生物技術(shù)研究所;AnnexinV異硫氰酸熒光素(fluorescein isothiocyanate,F(xiàn)ITC) 試 劑 盒 購(gòu) 自Pharmingen公司。
制冰機(jī)(Scotsman,意大利);直熱式CO2培養(yǎng)箱(Thermo,美國(guó));C2共聚焦顯微鏡(Nikon,日本);超凈工作臺(tái)(蘇州凈化設(shè)備儀器廠);低溫離心機(jī)(Ep-pendorf,德國(guó));細(xì)胞爬片(Thermo,美國(guó));尼龍網(wǎng)(BD,美國(guó));培養(yǎng)板及培養(yǎng)皿(Nunc,美國(guó));流式細(xì)胞儀(Beckman,美國(guó))。
1.2 方法
1.2.1 建立大鼠原代海馬星形膠質(zhì)細(xì)胞-神經(jīng)元共培養(yǎng)體系 75%醫(yī)用乙醇浸泡處死胎鼠,在超凈臺(tái)的無(wú)菌環(huán)境下冰浴開(kāi)顱整塊地取出腦組織,顯微鏡下鈍性分離留取海馬部位,仔細(xì)剝離棄去腦膜、血管等其余部位。將全部海馬組織放入玻璃培養(yǎng)皿中用4℃冰漢克斯平衡鹽溶液(HBSS緩沖液)反復(fù)沖洗,隨后用眼科剪刀將其剪成1 mm3大小的組織塊,加入用HBSS緩沖液稀釋的0.25%胰蛋白酶2 mL及脫氧核糖核酸酶Ⅰ,37℃培養(yǎng)箱消化30 min,HBSS緩沖液終止消化3次。組織懸液經(jīng)過(guò)200目尼龍網(wǎng)過(guò)濾后收集濾液。濾液離心后轉(zhuǎn)移至含有5%胎牛血清的Neurobasal-A培養(yǎng)基中 (含有0.5 mmol·L-1的L-谷氨酸,0.5 mmol·L-1的GlutaMax培養(yǎng)基補(bǔ)充物,100 U·mL-1青霉素+100 μg·mL-1鏈霉素,0.02%的B27血清補(bǔ)充物)利用巴斯德移液管吹打3次,充分混勻,再經(jīng)過(guò)孔徑為80 μm的尼龍網(wǎng)過(guò)濾。細(xì)胞懸液在室溫下1000 r·min-1離心3 min,棄去上清液,利用不含胎牛血清的Neurobasal-A培養(yǎng)基重懸,顯微鏡下用細(xì)胞計(jì)數(shù)板調(diào)整細(xì)胞濃度至1.5×106cells/mL,隨后種植于多聚賴氨酸包被的培養(yǎng)皿及細(xì)胞爬片上,放置在37℃,5%CO2,95%空氣,濕度維持在85%的恒溫培養(yǎng)箱中培養(yǎng)。細(xì)胞種植4~6 h后更新全部細(xì)胞培養(yǎng)基,隨后顯微鏡下觀察細(xì)胞生長(zhǎng)狀況,每3~4天更新一半細(xì)胞培養(yǎng)基。在種植后的第4天,培養(yǎng)基中加入1.5 mmol·L-1亮氨酸甲酯去除小膠質(zhì)細(xì)胞。培養(yǎng)3周后,細(xì)胞用于后續(xù)試驗(yàn)。
1.2.2 建立大鼠原代海馬神經(jīng)元培養(yǎng)體系 高純度的大鼠原代神經(jīng)元培養(yǎng)體系建立與星形膠質(zhì)細(xì)胞-神經(jīng)元共培養(yǎng)體系相同的胎鼠海馬細(xì)胞懸液。細(xì)胞懸液濃度、種植程序與星形膠質(zhì)細(xì)胞-神經(jīng)元共培養(yǎng)體系相同。在細(xì)胞種植后72 h,通過(guò)在培養(yǎng)基內(nèi)加入10 mmol·L-1的胞嘧啶阿糖胞苷及降低培養(yǎng)基中血清濃度來(lái)抑制星形膠質(zhì)細(xì)胞的生長(zhǎng)。培養(yǎng)3周后,細(xì)胞用于后續(xù)試驗(yàn)。
1.2.3 建立大鼠原代星形膠質(zhì)細(xì)胞培養(yǎng)體系 高純度的大鼠原代星形膠質(zhì)細(xì)胞來(lái)源于出生24 h SD乳鼠大腦海馬組織,細(xì)胞分離、純化、種植程序與星形膠質(zhì)細(xì)胞-神經(jīng)元共培養(yǎng)體系建立過(guò)程相同。不同的是細(xì)胞種植于含有10%的胎牛血清的DMEMF12培養(yǎng)基中,細(xì)胞懸液濃度與前述培養(yǎng)體系一致。種植1 h后更新全部細(xì)胞培養(yǎng)基以去除成纖維細(xì)胞,隨后每3~4天更新一半細(xì)胞培養(yǎng)基。在種植后的第4天,培養(yǎng)基中加入1.5 mmol·L-1亮氨酸甲酯去除小膠質(zhì)細(xì)胞。細(xì)胞需要經(jīng)過(guò)至少兩次消化后傳代,但需保持傳代前后細(xì)胞種植密度一致。培養(yǎng)3周后應(yīng)用于后續(xù)實(shí)驗(yàn)。
1.2.4 細(xì)胞純度鑒定 利用免疫熒光三標(biāo)技術(shù)鑒定不同原代神經(jīng)細(xì)胞培養(yǎng)體系的細(xì)胞純度。各體系隨機(jī)選取細(xì)胞爬片5張,于24孔板中在室溫下通過(guò)4%的多聚甲醛(pH 7.4的PBS溶媒)固定30 min。用PBS溶解1%牛血清蛋白(BSA)+0.3%Triton X-100,在室溫下振蕩器上緩慢封阻非特異性結(jié)合并破膜1 h。PBS清洗15 min。用一抗稀釋液配制1∶1000神經(jīng)元抗核抗體(NeuN,兔源多克隆抗體,Ab-cam公司,美國(guó))和 (或)1∶500膠質(zhì)纖維酸性蛋白(GFAP,小鼠源單克隆抗體,CST公司,美國(guó)),每孔中加入約500 μL,4℃緩慢振蕩器孵育過(guò)夜。PBS清洗15 min。用PBS配制熒光二抗1∶100 FITC(康為世紀(jì),北京)和1∶100異硫氰酸羅丹明(TRITC,康為世紀(jì),北京),室溫下緩慢振蕩器孵育2 h。PBS清洗15 min。再次室溫下避光孵育,PBS配制1∶2000的4′,6-二脒基-2-苯基吲哚 (4′,6-diamidino-2-phenylindole,DAPI)10 min。PBS清洗15 min后將細(xì)胞爬片蓋于載玻片上,60%甘油PBS封片,熒光顯微鏡 (尼康Ti-S,日本)下觀察并進(jìn)行圖像采集。FITC激發(fā)/發(fā)射波長(zhǎng)480 nm/535 nm,TRITC激發(fā)/發(fā)射波長(zhǎng)535 nm/610 nm。
利用Images J軟件進(jìn)行圖像分析,每組細(xì)胞選擇10個(gè)不同的400倍視野計(jì)數(shù)不同熒光著染細(xì)胞數(shù),取其平均值計(jì)算細(xì)胞比例。
1.2.5 細(xì)胞分組 各原代神經(jīng)細(xì)胞培養(yǎng)體系分別隨機(jī)分為對(duì)照組(Control group):始終進(jìn)行正常培養(yǎng);放射損傷組(X-ray group):通過(guò)X線照射造成細(xì)胞放射性損傷;放射性損傷+依達(dá)拉奉組(X-ray+EDA group):細(xì)胞接受X線照射后給予依達(dá)拉奉干預(yù)處理。
1.2.6 細(xì)胞放射性損傷[7]采用Varian 2100C型直線加速器,劑量率4 Gy·min-1的6 MV X射線造成細(xì)胞放射性損傷。射線從細(xì)胞貼壁面垂直入射,并加墊1.0 cm厚有機(jī)玻璃板,照射總劑量為30 Gy。照射完畢后繼續(xù)正常培養(yǎng),72 h后繼續(xù)后續(xù)實(shí)驗(yàn)。
1.2.7 依達(dá)拉奉干預(yù)處理[4]細(xì)胞照射接受X射線照射后,在培養(yǎng)基中加入100 mol·L-1依達(dá)拉奉進(jìn)行干預(yù)處理,繼續(xù)正常培養(yǎng),72 h后繼續(xù)后續(xù)實(shí)驗(yàn)。
1.2.8 細(xì)胞死亡率測(cè)定 利用細(xì)胞存活/死亡熒光分析試劑盒(英國(guó)Invitrolife公司)對(duì)比檢測(cè)細(xì)胞死亡率。該試劑盒通過(guò)乙啡啶同源二聚體著染死亡細(xì)胞核DNA在528 nm激發(fā)波長(zhǎng)下顯示紅色熒光,通過(guò)鈣黃綠素-AM著染細(xì)胞質(zhì)在494 nm激發(fā)波長(zhǎng)下顯示綠色熒光。按照說(shuō)明書將試劑稀釋后加入細(xì)胞爬片所在的24孔板內(nèi),每孔中加入約500 μL,室溫下避光孵育30 min。然后將細(xì)胞爬片蓋于載玻片上,60%甘油PBS封片,熒光顯微鏡(尼康Ti-S,日本)下觀察并進(jìn)行圖像采集。
利用Images J軟件進(jìn)行圖像分析,每組細(xì)胞選擇10個(gè)不同的200倍視野計(jì)數(shù)不同熒光著染細(xì)胞數(shù),取其平均值,計(jì)算細(xì)胞死亡率。
1.2.9 細(xì)胞凋亡檢測(cè) 利用NeuN/DAPI免疫熒光雙標(biāo)在熒光顯微鏡下觀察細(xì)胞凋亡情況,并計(jì)算凋亡率。各組細(xì)胞爬片在24孔板中室溫4%的多聚甲醛固定30 min,PBS清洗15 min。室溫下避光孵育,PBS配制1∶2000的DAPI 10 min。熒光顯微鏡下觀察凋亡細(xì)胞形態(tài)。
1.2.10 ROS檢測(cè)[10]采用雙乙酸雙氯雙氫熒光素(CM-H2DCF-DA)法檢測(cè)接種于培養(yǎng)皿上的各組原代神經(jīng)細(xì)胞培養(yǎng)體系的ROS含量。各原代培養(yǎng)體系的不同組細(xì)胞分別制作單細(xì)胞懸液,每個(gè)樣品收集10×103個(gè)細(xì)胞。檢測(cè)2′,7′-二氯熒光素(DCF)熒光強(qiáng)度,間接測(cè)定細(xì)胞內(nèi)活性氧水平。
1.3 統(tǒng)計(jì)學(xué)方法
本研究數(shù)據(jù)資料采用SPSS13.0統(tǒng)計(jì)軟件包進(jìn)行分析。計(jì)量資料采用均數(shù)±標(biāo)準(zhǔn)差(±s)表示。不同組樣本均數(shù)間的兩兩比較采用單因素方差分析(One-way ANOVA)。根據(jù)各組總體方差齊同與否,選擇Bonferroni法或Tamhane's T2法修正結(jié)果,以P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié) 果
2.1 各原代神經(jīng)細(xì)胞培養(yǎng)體系細(xì)胞純度測(cè)定(見(jiàn)圖1,見(jiàn)表1)
體外培養(yǎng)3周后,利用GFAP/NeuN/DAPI免疫熒光三標(biāo)技術(shù)鑒定不同原代神經(jīng)細(xì)胞培養(yǎng)體系細(xì)胞純度。來(lái)源于胎鼠海馬組織的原代星形膠質(zhì)細(xì)胞-神經(jīng)元共培養(yǎng)體系中神經(jīng)元比例>50%,星形膠質(zhì)細(xì)胞比例>45%;同樣來(lái)源于胎鼠海馬組織的原代神經(jīng)元培養(yǎng)體系中,神經(jīng)元純度>80%;來(lái)源于乳鼠海馬組織的原代星形膠質(zhì)細(xì)胞培養(yǎng)體系中,星形膠質(zhì)細(xì)胞純度>95%。各培養(yǎng)體系細(xì)胞形態(tài)正常,生長(zhǎng)狀態(tài)良好,符合進(jìn)一步實(shí)驗(yàn)要求。

圖1 各原代神經(jīng)細(xì)胞培養(yǎng)體系免疫熒光染色結(jié)果(200×)
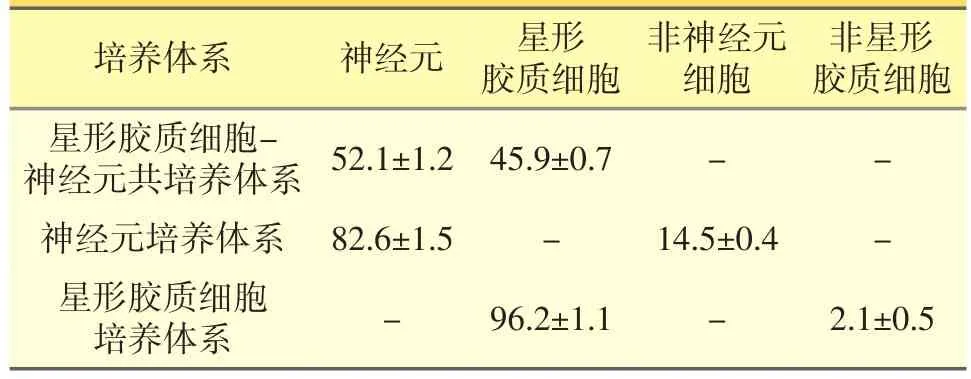
表1 各原代神經(jīng)細(xì)胞培養(yǎng)體系細(xì)胞純度測(cè)定結(jié)果(%)
2.2 各原代神經(jīng)細(xì)胞培養(yǎng)體系細(xì)胞死亡率檢測(cè)(見(jiàn)圖2,見(jiàn)表2)
各原代神經(jīng)細(xì)胞培養(yǎng)體系分別隨機(jī)分為對(duì)照組、放射損傷組、放射損傷+依達(dá)拉奉組以后進(jìn)行相應(yīng)處理,隨后利用細(xì)胞存活/死亡熒光分析試劑盒對(duì)比檢測(cè)細(xì)胞死亡率。如圖2所示,紅色熒光顯示為死亡細(xì)胞核,而綠色熒光顯示為正常存活細(xì)胞胞體。各培養(yǎng)體系對(duì)照組細(xì)胞死亡率均不超過(guò)20%。體系內(nèi)比較,共培養(yǎng)體系經(jīng)過(guò)放射線照射后,細(xì)胞死亡率升高達(dá)到32.0%±4.0%。經(jīng)過(guò)依達(dá)拉奉干預(yù)治療后,細(xì)胞死亡率迅速恢復(fù)至17.0%±1.8%,達(dá)到正常水平,放射損傷組與其它兩組比較差異均有統(tǒng)計(jì)學(xué)意義(P<0.05);單純神經(jīng)元的放射性損傷甚為明顯,細(xì)胞死亡率明顯升高至68.0%±5.2%。依達(dá)拉奉干預(yù)治療效果依舊明顯,細(xì)胞死亡率恢復(fù)至25.0%± 3.6%,基本達(dá)到正常水平。放射損傷組與其它兩組比較差異均有統(tǒng)計(jì)學(xué)意義(P<0.05);星形膠質(zhì)細(xì)胞培養(yǎng)體系對(duì)放射線損傷不敏感,體系內(nèi)不同組間細(xì)胞死亡率比較無(wú)明顯差異(P>0.05)。體系間比較,細(xì)胞種植密度相同情況下,射線照射以后神經(jīng)元培養(yǎng)體系細(xì)胞死亡率明顯高于共培養(yǎng)體系及星形膠質(zhì)細(xì)胞培養(yǎng)體系,差異均具有統(tǒng)計(jì)學(xué)意義(P<0.05),表明神經(jīng)元培養(yǎng)體系對(duì)放射性損傷最為敏感。依達(dá)拉奉干預(yù)治療后各培養(yǎng)體系間細(xì)胞死亡率已無(wú)統(tǒng)計(jì)學(xué)差異,表明依達(dá)拉奉治療收到了良好效果。
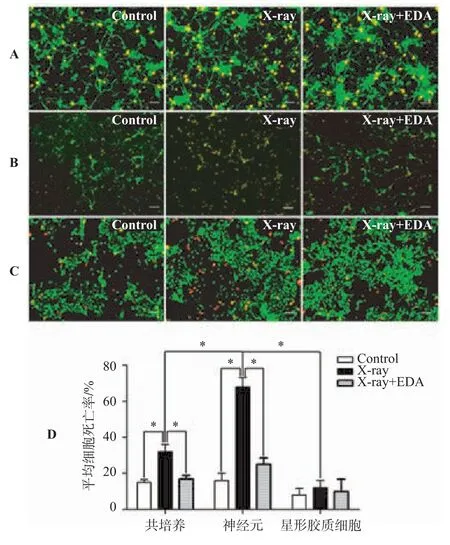
圖2 各原代神經(jīng)細(xì)胞培養(yǎng)體系細(xì)胞存活/死亡分析試劑盒檢測(cè)結(jié)果(200×)
表2 各原代神經(jīng)細(xì)胞培養(yǎng)體系細(xì)胞死亡率測(cè)定結(jié)果(±s,%)
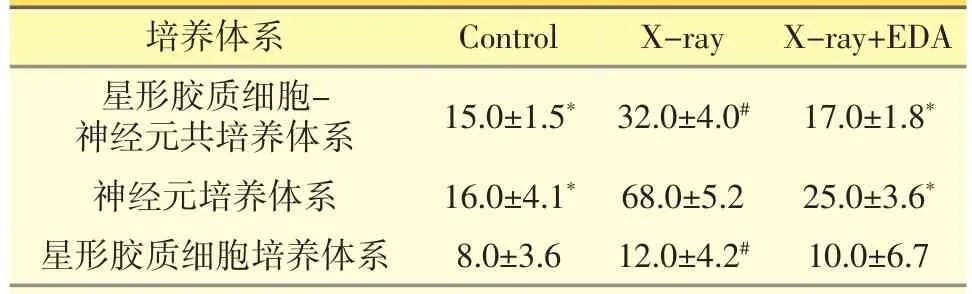
表2 各原代神經(jīng)細(xì)胞培養(yǎng)體系細(xì)胞死亡率測(cè)定結(jié)果(±s,%)
注:*體系內(nèi)與X-ray組比較,P<0.05;#體系間與神經(jīng)元培養(yǎng)體系比較,P<0.05。
培養(yǎng)體系Control X-ray X-ray+EDA星形膠質(zhì)細(xì)胞-神經(jīng)元共培養(yǎng)體系15.0±1.5*32.0±4.0#17.0±1.8*神經(jīng)元培養(yǎng)體系16.0±4.1*68.0±5.2 25.0±3.6*星形膠質(zhì)細(xì)胞培養(yǎng)體系8.0±3.6 12.0±4.2#10.0±6.7
2.3 神經(jīng)元培養(yǎng)體系細(xì)胞凋亡檢測(cè)(見(jiàn)圖3)
各原代神經(jīng)細(xì)胞培養(yǎng)體系間的細(xì)胞存活/死亡熒光分析結(jié)果表明,放射線照射致傷的細(xì)胞以原代神經(jīng)元為主,星形膠質(zhì)細(xì)胞對(duì)放射線損傷并不敏感。據(jù)此,利用NeuN/DAPI免疫熒光雙標(biāo)技術(shù),對(duì)比了正常培養(yǎng)及放射性損傷后72 h原代神經(jīng)元培養(yǎng)體系凋亡情況。結(jié)果表明,射線照射以后培養(yǎng)體系中64%的神經(jīng)元出現(xiàn)凋亡情況,而正常培養(yǎng)狀態(tài)下凋亡率僅為6%。凋亡神經(jīng)元在顯微鏡下顯示為藍(lán)色高亮、固縮、不規(guī)則形狀及碎裂的異常細(xì)胞核形態(tài)。以上結(jié)果也表明,神經(jīng)元的放射性損傷是以異常凋亡為主要表現(xiàn)的。
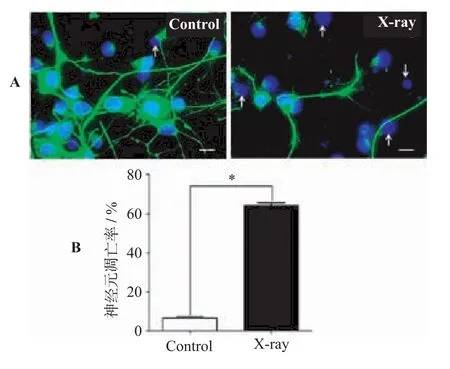
圖3 原代神經(jīng)元培養(yǎng)體系凋亡檢測(cè)結(jié)果(400×)
2.4 各原代神經(jīng)細(xì)胞培養(yǎng)體系ROS含量檢測(cè)(見(jiàn)表3)
表3 各原代神經(jīng)細(xì)胞培養(yǎng)體系細(xì)胞ROS含量測(cè)定結(jié)果(±s)

表3 各原代神經(jīng)細(xì)胞培養(yǎng)體系細(xì)胞ROS含量測(cè)定結(jié)果(±s)
注:*體系內(nèi)與X-ray組比較,P<0.05;#體系間與神經(jīng)元培養(yǎng)體系比較,P<0.05。
培養(yǎng)體系Control X-ray X-ray+EDA星形膠質(zhì)細(xì)胞-神經(jīng)元共培養(yǎng)體系42.6±7.2*79.8±10.4#46.5±8.1*神經(jīng)元培養(yǎng)體系38.9±10.3* 103.6±8.8 48.3±10.6*星形膠質(zhì)細(xì)胞培養(yǎng)體系40.3±9.6 43.9±5.6#41.5±9.3
各原代神經(jīng)細(xì)胞培養(yǎng)體系的對(duì)照組、放射損傷組、放射損傷+依達(dá)拉奉組細(xì)胞ROS含量變化趨勢(shì)與細(xì)胞死亡率變化趨勢(shì)相一致。如表3所示,體系內(nèi)比較,共培養(yǎng)體系及神經(jīng)元培養(yǎng)體系經(jīng)過(guò)放射線照射后,細(xì)胞活性氧含量均有明顯升高,依達(dá)拉奉干預(yù)治療后恢復(fù)至正常水平,體系內(nèi)放射損傷組與其它兩組比較差異均有統(tǒng)計(jì)學(xué)意義(P<0.05)。星形膠質(zhì)細(xì)胞培養(yǎng)體系經(jīng)過(guò)不同處理后活性氧含量無(wú)明顯差異(P>0.05)。體系間比較,僅放射性損傷組體系間有統(tǒng)計(jì)學(xué)差異(P<0.05),神經(jīng)元培養(yǎng)體系ROS含量高于其它兩種培養(yǎng)體系。其余兩組細(xì)胞體系間無(wú)明顯差異。
3 討 論
3.1 放射性腦損傷機(jī)制
放射治療已成為頭頸部腫瘤及血管病變的重要治療手段;但射線造成的放射性腦損傷也成為限制放療劑量、影響療效的重要因素[11]。目前放射性腦損傷發(fā)病機(jī)制主要包括:①血管損傷:主要發(fā)生在小血管和中等血管,以動(dòng)脈為主,血腦屏障因而遭到破壞,最終導(dǎo)致腦缺血性梗死及毛細(xì)血管擴(kuò)張癥[12];②膠質(zhì)損傷:放射性損傷后星形膠質(zhì)細(xì)胞反應(yīng)性肥大、增生,少突膠質(zhì)細(xì)胞損傷甚為明顯,導(dǎo)致神經(jīng)髓磷脂代謝紊亂、嚴(yán)重者出現(xiàn)凝固壞死和白質(zhì)空腔形成[13];③自身免疫損傷:照射后神經(jīng)膠質(zhì)細(xì)胞釋放抗原,引起過(guò)敏反應(yīng),同樣導(dǎo)致血管損傷和閉塞,進(jìn)一步導(dǎo)致?lián)p傷區(qū)域凝固性壞死和白質(zhì)廣泛脫髓鞘改變;④海馬、小腦及皮質(zhì)的神經(jīng)干細(xì)胞損傷;⑤細(xì)胞因子表達(dá)異常[14]。
3.2 原代神經(jīng)細(xì)胞培養(yǎng)體系對(duì)放射性損傷敏感性及與ROS含量變化關(guān)系
本研究重點(diǎn)關(guān)注了體外培養(yǎng)狀態(tài)下,神經(jīng)元及星形膠質(zhì)細(xì)胞對(duì)放射損傷的敏感性差異及與細(xì)胞ROS含量變化關(guān)系。實(shí)驗(yàn)結(jié)果表明,單純神經(jīng)元對(duì)放射性損傷最為敏感,星形膠質(zhì)細(xì)胞-神經(jīng)元共培養(yǎng)體系敏感性明顯降低,單純星形膠質(zhì)細(xì)胞則對(duì)放射損傷不敏感。細(xì)胞死亡以神經(jīng)元凋亡為主要表現(xiàn)形式。細(xì)胞ROS含量可以間接反映細(xì)胞氧化性損傷程度。檢測(cè)結(jié)果表明,各組細(xì)胞ROS含量差異與上述放射性損傷敏感性變化趨勢(shì)一致,說(shuō)明氧化應(yīng)激損傷是細(xì)胞放射性損傷的重要原因之一。ROS是一類分子的集合體,生理狀況下作為細(xì)胞內(nèi)氧化還原信使,傳遞調(diào)控胞內(nèi)信號(hào),其生成和清除保持著動(dòng)態(tài)平衡。應(yīng)激狀態(tài)將打破這一平衡。具體導(dǎo)致?lián)p傷機(jī)制涉及多條信號(hào)轉(zhuǎn)導(dǎo)通路,包括活化死亡受體通路、線粒體凋亡通路、c-Jun氨基末端激酶(c-Junterminal kinase,JNK)介導(dǎo)的凋亡信號(hào)通路以及破壞細(xì)胞內(nèi)谷胱甘肽相關(guān)的氧化還原平衡等,最終都將引起細(xì)胞凋亡失調(diào)[15]。
3.3 共培養(yǎng)體系中星形膠質(zhì)細(xì)胞對(duì)神經(jīng)元的保護(hù)作用
本研究結(jié)果表明,共培養(yǎng)狀態(tài)下神經(jīng)元死亡率較單純神經(jīng)元培養(yǎng)有明顯降低。這表明共培養(yǎng)體系中星形膠質(zhì)細(xì)胞的存在可能對(duì)神經(jīng)元產(chǎn)生了部分保護(hù)作用,從而降低了其對(duì)放射線的敏感性。我們推測(cè)這一保護(hù)作用的機(jī)制是星形膠質(zhì)細(xì)胞緩解了射線照射后血管損傷引起的腦能量代謝障礙。研究表明,膠質(zhì)細(xì)胞與神經(jīng)元之間相互作用貫穿于大腦發(fā)育和功能的各個(gè)方面,其中首當(dāng)其沖的就是腦的能量代謝[16]。星形膠質(zhì)細(xì)胞-神經(jīng)元乳酸穿梭假說(shuō)(astrocyte-neuron lactate shuttle hypothesis,ANLSH)的提出,賦予了星形膠質(zhì)細(xì)胞應(yīng)激狀態(tài)下作為神經(jīng)元能量來(lái)源的角色,這是大腦能量代謝特殊性的具體體現(xiàn)[17],對(duì)于維護(hù)大腦自穩(wěn)態(tài)至關(guān)重要。ANLSH得以實(shí)現(xiàn)的主要載體是單羧酸轉(zhuǎn)運(yùn)體,由此構(gòu)成了應(yīng)激狀況下星形膠質(zhì)細(xì)胞對(duì)神經(jīng)元內(nèi)生性保護(hù)作用的分子基礎(chǔ)[18]。
3.4 依達(dá)拉奉對(duì)神經(jīng)元放射性損傷的保護(hù)作用
本研究應(yīng)用依達(dá)拉奉對(duì)放射損傷后原代神經(jīng)細(xì)胞進(jìn)行干預(yù)治療,結(jié)果表明依達(dá)拉奉通過(guò)清除細(xì)胞內(nèi)異常增多的ROS,減輕細(xì)胞損傷,逆轉(zhuǎn)凋亡失調(diào),有效降低了神經(jīng)元的死亡率。近年來(lái)神經(jīng)細(xì)胞膜代謝研究中發(fā)現(xiàn)了自由基的毒害作用,自由基清除劑的神經(jīng)保護(hù)功能由此成為研究熱點(diǎn)。依達(dá)拉奉是一種新型的自由基清除劑,其神經(jīng)保護(hù)機(jī)制如下:①體內(nèi)的依達(dá)拉奉陰離子與自由基的不配對(duì)電子配對(duì),使自由基失去作用,阻斷了自由基連鎖反應(yīng)[19];②依達(dá)拉奉清除羥基基團(tuán),抑制黃嘌呤氧化酶和次黃嘌呤氧化酶的活性,刺激前列環(huán)素生成,減少白三烯產(chǎn)生,降低羥自由基的濃度[20];③依達(dá)拉奉阻斷內(nèi)質(zhì)網(wǎng)應(yīng)激相關(guān)蛋白的表達(dá),對(duì)神經(jīng)元起到保護(hù)作用[21];④依達(dá)拉奉提高超氧化物歧化酶活性,減少丙二醛產(chǎn)生,抑制脂質(zhì)過(guò)氧化,減輕細(xì)胞氧化損傷[22];⑤依達(dá)拉奉調(diào)控凋亡相關(guān)基因表達(dá)而產(chǎn)生凋亡抑制作用[23];⑥依達(dá)拉奉抑制皮質(zhì)神經(jīng)元線粒體孔的開(kāi)放而減少細(xì)胞色素C的釋放,抑制由其觸發(fā)的凋亡程序[24]。
神經(jīng)系統(tǒng)放射性損傷是臨床放射治療常見(jiàn)的副損傷之一。如何有效地提高腫瘤對(duì)放療敏感性并盡可能降低副損傷效應(yīng)是臨床治療中亟待解決的問(wèn)題。自由基清除劑的應(yīng)用為臨床提供了新的治療思路。另外,針對(duì)本研究中涉及的星形膠質(zhì)細(xì)胞對(duì)神經(jīng)元保護(hù)作用的分子機(jī)制的深入研究,有助于從機(jī)體內(nèi)源性保護(hù)機(jī)制方面探尋新的腦保護(hù)治療方案。
[1]尹華錦.放射性腦病的診治研究現(xiàn)狀[J].瀘州醫(yī)學(xué)院學(xué)報(bào),2010,32(6):658-61.
[2]Kaya M,Palanduz A,Kalayci R,et al.Effects of lipopolysaccharide on the radiation-induced changes in the blood-brain barrier and the astrocytes[J].Brain Res, 2004,1019(1-2):105-12.
[3]李華杰,田 野,包仕堯.神經(jīng)膠質(zhì)細(xì)胞在早期放射性腦損傷中的變化與作用 [J].中華放射醫(yī)學(xué)與防護(hù)雜志,2003,23(4):305-7.
[4]Tian Y,Shi Z,Yang S,et al.Changes in myelin basic protein and demyelination in the rat brain within 3 months of single 2-,10-,or 30-Gy whole-brain radi-ation treatments[J].J Neurosurg,2008,109(5):881-8.
[5]Li TQ,Wong CS.Radiation-induced apoptosis in the neonatal and adult rat spinal cord[J].Radiat Res,2000, 154:268-76.
[6]林曰增.腦放射損傷的影像學(xué)研究進(jìn)展 [J].國(guó)外醫(yī)學(xué)·放射醫(yī)學(xué)核醫(yī)學(xué)分冊(cè),2000,24(4):148-51.
[7]陳 勇,劉來(lái)昱,孫愛(ài)民,等.依達(dá)拉奉對(duì)原代培養(yǎng)大鼠海馬神經(jīng)元放射性損傷的保護(hù)作用[J].中華腫瘤防治雜志,2010,17(10):721-7.
[8]劉曉民,徐德生,李彥和,等.大鼠正常腦組織伽瑪?shù)墩丈浜驡FAP表達(dá)的實(shí)驗(yàn)研究 [J].臨床神經(jīng)外科雜志,2007,4(1):35-8.
[9]Crack PJ,Taylor TM.Reactive oxygen species and the modulation of stroke[J].Free Radic Biol Med,2005,38 (11):1433-44.
[10]高 晨,周海燕,荔志云,等.顱眶聯(lián)合傷后視網(wǎng)膜神經(jīng)節(jié)細(xì)胞活性氧含量與凋亡研究 [J].中國(guó)微侵襲神經(jīng)外科雜志,2013,18(10):468-71.
[11]Ku GY,Ilson DH.Esophagogastric cancer:Targeted agents[J].Cancer Treat Rev,2010,36(3):235-48.
[12]Mǜnter MW,Karger CP,Reith W,et al.Delayed vascular injury after single high-dose irradiation in the rat brain:histologic,immunohistochem ical and angiographic stuies[J].Radiology,1999,212(2):475-82.
[13]Valk PE,Dillon WP.Radiation injury of the brain[J]. Am J Roentgend,1991,12(1):45-62.
[14]Belka C,Budach W,Kortmann RD,et al.Radiation induced CNS toxicity-molecular and cellular mecha-nisms[J].Br J Cancer,2001,85:1233-9.
[15]Bonde C,Noraberg J,Noer H,et al.Ionotropic gluta-mate receptors and glutamate transporters are involved in necrotic neuronal cell death induced by oxygenglucose deprivation of hippocampal slice cultures[J]. Neuroscience,2005,136(3):779-94.
[16]Barres BA.What is a glial cell?[J].Glia,2003,43(1): 4-5.
[17]Magistretti PJ.Neuron-glia metabolic coupling and plasticity[J].J Exp Biol,2006,209(Pt 12):2304-11.
[18]Cortes-Campos C,Elizondo R,Llanos P,et al.MCT expression and lactate influx/efflux in tanycytes in-volved in glia-neuron metabolic interaction[J].PLoS One,2011,6(1):e16411.
[19]Tanaka M.Pharmacological and clinical profile of the free radical scavenger edaravone as a neuroprotevtive a-gent[J].Nippon Yakarigaku Zasshi(S),2002,119(5):301-8.
[20]Shichinohe H,Kuroda S,Yasuda H,et al.Neuropro-tective effects of the free radical scavenger Edaravone (MCI-186)in mice permanent focal brain ischemia[J]. Brain Res,2004,1029(2):200-6.
[21]龍 浩,凡 進(jìn),陳 琦,等.依達(dá)拉奉通過(guò)抑制內(nèi)質(zhì)網(wǎng)應(yīng)激途徑對(duì)谷氨酸刺激神經(jīng)元損傷的保護(hù)作用[J].江蘇醫(yī)藥,2013,39(12):1374-6.
[22]蔣 杰,陳亦江,陳 亮,等.依達(dá)拉奉對(duì)心臟瓣膜置換術(shù)患者腦損傷的影響[J].南京醫(yī)科大學(xué)學(xué)報(bào)(自然科學(xué)版),2006,26(7):570-3.
[23]Roh MI,Murakami Y,Thanos A,et al.Edaravone,an ROS scavenger,ameliorates photoreceptor cell death after experimental retinal detachment[J].Invest Oph-thalmol Vis Sci,2011,52(6):3825-31.
[24]薛 晶,韓 冬,鄧 方,等.依達(dá)拉奉對(duì)腦缺血再灌注損傷保護(hù)作用機(jī)制的研究 [J].中風(fēng)與神經(jīng)疾病雜,2009,26(1):18-20.
Relationship between the Radiation Injury Sensitivity and the ROS Content in Rat Primary Neural Cell Cultures and the Neuroprotective Effects of Edaravone
GAO Chen1,TIAN Li-zhuang2,ZHU Wen-xia3,LIU Yu-hu1,WU Xin-du1,ZHAO Yu1,ZHAO Fu-gui1
1Department of Neurosurgery,AnNing Branch Hospital;2Department of Neurosurgery;3Department of Trau-matology,AnNing Branch Hospital,Lanzhou General Hospital of Lanzhou Military Command,Lanzhou,Gan-su 730070,China
Objective:To study the relationship between the radiation injury sensitivity and the reactive oxygen species (ROS)content in rat primary neural cell cultures and the neuroprotective effects of edaravone.Methods:A single-dose x-ray exposure protocol was used in primary cultures of neurons, astrocytes,and astrocytes-neurons derived from rat hippocampus,with or without edaravone treatment.Cell death,apoptosis and the content of ROS were evaluated.Results:X-ray resulted in significantly raised cell death rate and ROS content in the neuronal cultures.However,the cells injury was lighter in the astrocyte-neuron co-cultures and not significant in the astrocyte cultures.Edaravone inhibits the cell death by eliminating ROS.Conclusion:The content of ROS in neuronal cultures increased significantly after the radiation injury,resulted in apoptosis imbalance of neurons.Edaravone prevents this pathological process by eliminating ROS and thus has a protective effect on neurons,the drug is worth clinical promotion.
Co-culture;Radiation injury;Reactive oxygen species;Edaravone;Neuroprotection
R964
A
1673-7806(2015)03-211-06
高晨,男,主治醫(yī)師,外科學(xué)博士,主要研究方向:顱腦損傷規(guī)范化診療 E-mail:gc2006418@163.com
2014-12-02
2015-03-10

