翻轉課堂下的課堂觀察——以“化學平衡常數”教學為例
安雙馬 盧 偉
(浙江師范大學 教師教育學院 浙江 金華 321004)
受建構主義教育理論的影響,教育界普遍認為學生學習是一個有意義的建構過程,學生理解知識是基于自身的經驗背景來建構,這往往取決于特定情境。受此影響教學通常包括知識傳授和知識內化兩個階段。傳統的課堂教學一般是課堂上知識傳授,課后進行知識內化。然而作為新型的教學模式,翻轉課堂不同于傳統課堂的教學模式,知識傳授通過信息技術的輔助在課前完成,知識內化則在課堂中經過同學的幫助與教師的協助來完成[1]。
翻轉課堂的發展往往需要教師自身反思,而課堂觀察是反思的基礎;教師專業成長的主陣地在課堂。因此通過課堂觀察,對改進翻轉課堂教學,提高教學效率和質量,提升教師專業發展水平有很大幫助[2][3]。
基于翻轉課堂的特殊性,筆者將本次翻轉課堂分為課前觀察、課中觀察和課后反思三個部分。
一、課前觀察
在上課之前,化學教師提前準備好教學資源上傳到學生的公共學習平臺,一般包含了給學生提供的參考書籍、電子課件、教案、微視頻教程以及有關于化學平衡常數這一專題學習拓展素材的資料。教學視頻的制作作為化學課程資源準備中的核心內容,在本次課堂觀察過程中,化學教師根據化學平衡常數的課堂教學目標運用視頻軟件對本次課程視頻進行錄制和后期制作。教師還為學生準備了教學課件,以及一些有關本次課的練習題。制作完成后,將這教學視頻和其他電子資源上傳到本班的公共學習平臺上,方便學生下載觀看。
二、課中觀察
筆者提前5分鐘進入教室,觀察到學生已經在上課之前提前將座位按照四人一小組的方式排列好并安靜地坐在座位上,做好上課準備。由于教室所限,為了最大限度減少課中觀察對學生學習的影響,筆者選擇坐在教室的最后一排,因此無法詳盡的記錄前排學生的交流討論情況,主要記錄離我比較近的學生的討論情況[3]。
在課堂觀察過程中將本次翻轉課堂分為四個部分:
1.合作探究(0-13min)
[教師]同學們,我依據大家昨天在公共學習平臺上反饋的問題作了一定的歸納總結,大家對本次化學平衡常數的一些問題分歧比較大,我們加強小組之間的團隊互助意識,相互討論,如果大家在相互交流之后還是不懂,那我就和同學們一起相互交流探究!
[投影](1)化學平衡常數為何與反應物和生成物的濃度無關?
(2)如何運用化學平衡常數來判斷可逆反應進行的方向?
(3)化學平衡常數和化學平衡轉化率在現實生活中有何應用?

[學生乙]我知道化學平衡常數能反映一個可逆反應的限度,但如何運用我確實不會。
[學生甲]我看了教學視頻、教材和課外參考資料,我認為化學平衡常數反映了一個可逆化學反應進行的程度。例如對于同一個可逆反應,如果一個化學平衡常數較大說明他的反應進行程度較大。
[學生丙]我從化學平衡常數的公式中推出,如果對于一個可逆反應,如果一個平衡常數越大,則其中生成物的比例也就越大。
此時教師走過來,站在旁邊仔細傾聽,未參與討論。
[學生乙]我看到課外參考書上寫化學平衡常數可以用來判斷一個反應的熱效應,例如:如果一個反應升高溫度,它的化學平衡常數增大,那說明可逆反應的正反應是一個吸熱反應,加熱更有利于正反應進行。相反,如果這可逆反應升高溫度,他的化學平衡常數減小,那就說明這個可逆反應的正反應是一個放熱反應,降低溫度反而更利于反應朝正反應方向進行。
[學生丙]我想對乙同學提出的觀點進行補充,我們可以運用化學平衡常數來提高可逆反應中反應物的轉化率。例如,在工業合成氨中不同溫度下化學平衡常數是不同的,具體的數據可以看教材第45頁表2-8,從這些數據中我們可以看出在373K時化學平衡常數最大,說明從理論上來說這時的溫度是合成氨轉化率最好的,因此可以說明理論基礎對于促進工業生產是很有價值的,可以減少原料的浪費,使工廠達到最佳的經濟效益。
2.釋疑解惑(13-20min)
[教師]剛才的幾分鐘,大家討論十分激烈,我站在旁邊聽到也看到大家結合自己昨天自學的知識為小組同學解釋并且相互交流。那我想請幾位小組代表來為我們全班同學答疑解惑。
全班積極性高漲,教師選擇了A同學代表他們小組來回答。
[學生A]通過教材中第44頁中的表2-6中計算以及推理可以得出化學平衡常數K是一個不變的定值。因此可以得出化學平衡常數與溫度有關與反應物和生成物的濃度無關。
[教師]除了這些,大家還有別的想要補充?
等待10s。
[教師]那第二題我想請B同學為我們大家解釋一下。
[學生B]結合之前我們小組討論的結果,引入一個濃度商Qc,Qc是可逆反應中生成物的濃度冪之積與反應物濃度冪之積的比值,和平衡常數相似,只是它是代表在一定溫度下任何時刻,反應物與生成物的關系。當Qc>K時,此時反應過程中生成物濃度相較于化學平衡時的生成物濃度大,此時代表反應正朝向逆方向進行即 v(逆)>v(正);當 Qc=K 時,此時反應過程中反應物濃度與此反應平衡時的反應物濃度相同,說明此反應已經達到平衡即 v(逆)=v(正);當 Qc<K 時,此時反應過程中反應物濃度大于此反應平衡時的反應物濃度,說明反應還在朝正反應方向進行即v(正)>v(逆)。
[教師]回答得很好,能夠挖掘出教材中未知的知識點,課前看課外資源很仔細!值得大家學習。第三小題我們就請C同學來幫我們解決一下。
[學生C]化學平衡常數和化學平衡轉化率應用非常廣泛。例如在工業生產中我們往往要考慮反應達到平衡時,反應物的轉化率,為了提高轉化率,我們一般會采取各種措施,降低生產成本,提高經濟效益。同時化學平衡常數還能判斷可逆反應的程度,化學平衡常數越大說明在反應體系中生成物所占的比例越大,化學反應進行程度也就越大。
[教師]本節課中的化學平衡常數是具體的數值,當化學平衡常數達到多少時可判斷這個可逆反應基本完全了?
[學生C]一般來說,化學反應平衡常數的K>105時可以判斷該反應已經進行完全了。同理如果化學平衡常數K<10-5時,可以判斷該反應的正反應很難進行,或者說該反應的逆反應已經完全了。
[教師]C同學講解的非常好。大家對之前的3個問題進行了很好的解決,還有別的疑問?
全班很安靜,無人回答。
3.達標測試(21-35min)
[教師]看到大家對于化學平衡常數的知識點掌握得相當不錯,我來檢測一下大家對本節課內容的掌握程度。
[投影]已知反應 C(s) +2H2O(g)?CO2(s) +2H2(g)的平衡常數K為A,用A表示下列各反應的平衡常數K:
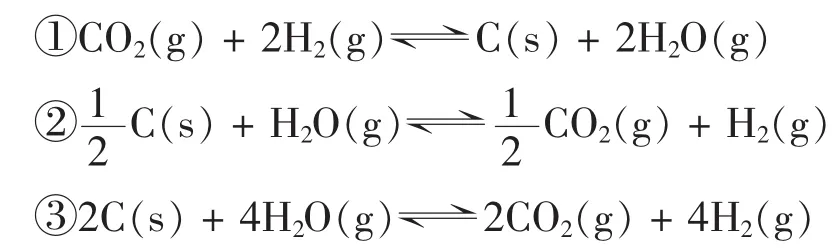
1分鐘后教師見學生都做得差不多了,請學生D回答。
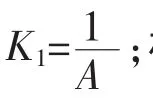
[教師]大家對同一個可逆反應之間的化學平衡常數的相互轉換的方法已經掌握了,下面我將要稍加難度。
[投影]合成氨的反應 N2(g) + 3H2(g)?2NH3(g)在某溫度下各物質的平衡濃度是 c(N2)=3mol·L-1,c(H2)=9mol·L-1,c(NH3)=4mol·L-1,求:
①該反應的化學平衡常數。
②N2、H2的初始濃度。
2分鐘后教師請學生E上講臺,在黑板上將整個過程進行演示。
學生E在黑板上的演示:
[教師]關于化學平衡常數的計算,我們一般采用起始、變化、平衡這三段式,這樣可以明確各物質之間的對應關系。既然大家對化學平衡常數的計算已經掌握,那我們來一起做一題關于化學平衡的轉化率的題目。
[投影]在一個密閉容器中,CO與H2O混合加熱到773K達到下列平衡:此時平衡常數K=9,若反應開始時 c(H2)=c(CO)=0.020mol·L-1,求達到平衡時 CO的轉化率。
2分鐘之后教師請學生F上講臺,在黑板上將整個過程進行演示。
[學生F]設達到平衡時CO的轉化率為x,

[教師]F同學和E同學的方法差不多,可見掌握一種好的解題方法往往是成功的一半。
4.小結提升(35-40min)
[教師]同學們討論很激烈也很投入,解題正確率也很高。我相信大家都有一定的收獲和心得,那我想請一位同學上臺來講一講你在本節課中學到了什么,還有什么不懂,需要大家來幫助你。下面我請同學G上臺講一下。
[學生G]在本節課中我學習了化學反應平衡常數的表達式,跟同學一起討論和老師的講解之后,我知道了化學平衡常數的影響因素只與溫度有關,與各物質的濃度、分壓無關。
G同學站在講臺上,暫時停頓。
[教師]那你談談化學平衡常數在衡量化學反應限度方面有什么作用?
[學生G]化學平衡常數可以判斷化學反應的進行程度,以及可以判斷可逆反應的反應方向,還可以求出在反應的某一個時刻或者反應平衡時的轉化率和各個物質的平衡濃度。
[教師]經過大家的共同合作、努力之下我們學習了化學平衡常數,化學平衡常數為我們今后學習化學平衡的移動、離子反應的電離平衡打下堅實的基礎。
三、課后反思
反思翻轉課堂觀察可以為一線教師研究翻轉課堂提供一個觀察翻轉課堂、思考翻轉課堂、研究翻轉課堂的支架,為每一位教師提供交流的平臺。在反思翻轉課堂觀察過程中,觀察者能通過一種全新的視角了解翻轉課堂教學,獲得深入的反思性認識。
特別是在此次翻轉課堂的觀察中,筆者發現將這節課的課堂完全交給學生,學生課前自學,課堂上討論,自己總結,教師只是點評,輔助學生,課堂氛圍更好,學生學習積極性更高,觀察到有一些平時不怎么說話的學生也樂于參與同學之間的交流。翻轉課堂教學過程改變了傳統教學過程,加強了學生課前與課堂教學過程中的自學能力、思維能力以及合作學習時的交流討論能力,使學生能夠主動探求化學知識、應用化學知識。
通過此次對翻轉課堂的觀察、反思、分析,筆者認為翻轉課堂對學生充分利用課外時間,提高自覺性和獲取多樣的課外學習資源提出了更高的要求。對教師而言為學生提前篩選學生學習所需的教學資源,并提前做好充足的課堂教學準備,高效利用課堂教學時間。同時教師之間相互觀察、探討翻轉課堂,加強交流、合作與探究,共同促進。只有這樣翻轉課堂才能真正改善學生學習,促進教師專業化發展[4]。
[1] 王春.基于“翻轉課堂”教學模式下的同課異構—以“化學平衡常數的應用”為例[J].化學教學,2014,(9):47
[2] 王文.課堂觀察一教師專業成長的必由之路[D].福州:福建師范大學,2008,1
[3] 夏雪梅.以學習為中心的課堂觀察[M].北京:教育科學出版社,2012 :136-147
[4] 陳瑤.課堂觀察指導[M].北京:教育科學出版社,2012:148

