依維莫司在器官移植領域的臨床應用
劉 麗,王華光
(1.中國醫學科學院·北京協和醫學院醫藥生物技術研究所,北京 100050; 2.北京朝陽醫院,北京 100020)
依維莫司在器官移植領域的臨床應用
劉 麗1,2,王華光2
(1.中國醫學科學院·北京協和醫學院醫藥生物技術研究所,北京 100050; 2.北京朝陽醫院,北京 100020)
目的 從作用機制、藥代動力學性質及影響因素、臨床評價、不良反應等方面簡述依維莫司在器官移植領域的臨床應用。方法 查閱近幾年文獻,提取重要信息,通過分析、歸納進行綜述。結果與結論 依維莫司用于器官移植能維持較好的腎功能。食物、藥物等多種因素均能影響其藥代動力學性質。以已有的研究性臨床治療方案為指導,采用依維莫司個體化給藥方案,監測其血藥濃度,可提高療效、降低不良反應。
依維莫司;器官移植;藥代動力學;臨床評價;血藥濃度
依維莫司(everolimus,EVL)又稱40-O-(2-羥乙基)-雷帕霉素,是西羅莫司(雷帕霉素,大環內酯類抗生素)的衍生物,為哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抑制劑、新的增殖信號抑制劑(PSI),具有極強的抗腫瘤和免疫抑制作用[1-3]。與西羅莫司相比,依維莫司具有較好的穩定性、水溶性及藥代動力學性質[4]。該藥最早于2003年在歐洲被批準用于治療腎移植及心臟移植后的排斥反應。依維莫司作為一種新型免疫抑制劑及腫瘤靶向治療藥物,具有良好的發展前景。現對依維莫司在器官移植領域的臨床應用作一簡要概述。
1 藥理作用機制
mTOR是絲氨酸-蘇氨酸蛋白激酶,是細胞內信號通路的重要物質,參與細胞生長和增殖、細胞代謝、自噬、血管生成等很多重要的過程。依維莫司進入細胞后,在胞漿內與FK結合蛋白12(FKBP-12)結合形成復合物,進而與mTOR結合,抑制mTOR活性,使 p70S6激酶脫磷酸化而失活,而p70S6對蛋白質的合成及細胞循環有重要作用。因此,通過與mTOR的相互作用,依維莫司可抑制T細胞、B細胞的增殖和分化及抗體的形成,以及非免疫細胞(成纖維細胞、內皮細胞、肝細胞和平滑肌細胞)的增殖[5]。
2 藥代動力學性質
一項12名健康受試者的藥代動力學研究顯示,口服單劑量依維莫司4 mg,給藥后30 min內迅速吸收,峰濃度(Cmax)為(44.2± 13.3)μg/L,達峰時間(tmax)為 0.5~1 h,藥-時曲線下面積(AUC)為(219±69)μg·h/L,消除半衰期(32.2±6.1)h[6]。穩定的腎移植患者一次給藥2.5 mg時,Cmax為(45±21)μg/L;給藥1 mg時,Cmax為(13.8±3.1)μg/L;藥物體內達穩態時間4~7 d;清除半衰期18~32 h。因此,依維莫司通常的用法是1天2次[5]。
依維莫司主要由CYP3A4,CYP3A5,CYP2C8經腸道和肝臟代謝,98%以代謝物形式經膽汁排出,僅2%通過尿液排出。依維莫司及其4種主要的代謝產物(羥基依維莫司、二羥基依維莫司、脫甲基依維莫司及開環形式的依維莫司)存在于血液中。最重要的代謝產物羥基依維莫司 AUC24 h約為依維莫司的1/2[(16.0± 6.5)μg·h/L比(35.4±13.1)μg·h/L],其次是脫甲基依維莫司 AUC24 h為(10.7±15.8)μg·h/L,二羥基依維莫司為(8.5± 5.7)μg·h/L,開環形式的依維莫司為(2.3±2.1)μg·h/L。給藥后,所有的代謝產物很快達到峰濃度,tmax為1.2~2.0 h(依維莫司 tmax=1.5 h)[6]。
3 藥代動力學影響因素
3.1 藥物影響
依維莫司是CYP3A4和P-糖蛋白(P-gp)的底物及中效抑制劑,故CYP3A4酶系的抑制劑、誘導劑和P-pg的抑制劑都會影響其藥代動力學性質。強效CYP3A4抑制劑包括酮康唑、伊曲康唑、伏立康唑、克拉霉素、利托那韋等,中效CYP3A4和/或P-gp抑制劑包括環孢素、地爾硫 、紅霉素、氟康唑、異搏定等,強效CYP3A4誘導劑包括地塞米松、苯妥英鈉、卡馬西平、利福平及苯巴比妥等[7]。
依維莫司和CYP3A4或P-gp抑制劑聯用時,清除率降低、血藥濃度增加。如依維莫司和酮康唑聯用時,半衰期延長1.9倍[8];和環孢素、異搏定或紅霉素分別聯用時,AUC比單用時分別提高了2.7倍[9]、3.5倍[10]或4.4倍[11]。依維莫司和CYP3A4誘導劑聯用時,血漿濃度降低。如與利福平聯用時,清除率提高172%,Cmax和AUC降低[12]。因此,依維莫司不應與CYP3A4強效抑制劑合用,應謹慎與中效CYP3A4和/或P-gp抑制劑合用;如不能選擇治療,應降低劑量;停用中效CYP3A4和/或P-gp抑制劑時,劑量應調至最初未使用抑制劑時的劑量。依維莫司也應避免和強效CYP3A4誘導劑合用,若必須合用,應提高劑量;若停用強效CYP3A4誘導劑,劑量亦應調至最初未使用強效誘導劑時的劑量[7]。
一項健康受試者研究[13]顯示,依維莫司與羥甲基戊二酸單酰輔酶 A(HMG-CoA)還原酶抑制劑阿托伐他汀同時口服,前者Cmax降低9%、AUC降低5%,后者 Cmax降低11%、AUC不受影響;依維莫司與普伐他汀同時口服時,前者 Cmax降低10%、AUC降低6%,后者 Cmax降低10%、AUC降低5%;阿托伐他汀和普伐他汀的消除半衰期均不受影響。因此,依維莫司與CYP3A4底物阿托伐他汀及非CYP3A4底物普伐他汀之間均沒有具臨床意義的藥代動力學相互作用。
依維莫司和他克莫司聯用的臨床研究表明[14],后者不影響前者的藥物暴露量;而前者對后者的暴露量的影響,不同研究結果不一致,即可能增加、降低或不影響后者的暴露量。
3.2 食物或中草藥影響
柚子(汁)、葡萄柚(汁)、紅酒、魚油補充劑、大蒜(3.6 g/d)、辣椒、刺激性調料(如姜)、草藥、草藥茶(如洋甘菊、薄荷、蒲公英)、黃連素、人參、野甘菊、黃柏等均能影響依維莫司的代謝,如柚子(汁)、葡萄柚(汁)可增加依維莫司的口服生物利用度[5,15]。因此,服用依維莫司的患者應盡量少用或避免使用這些食物或中草藥,如需使用,應密切監測血藥濃度。一項多中心臨床研究[5]顯示,食物對依維莫司的血藥谷濃度沒有影響,但可使 Cmax波動52%,因此,為了避免依維莫司暴露量的大幅變化,最好保持一致的給藥方式,即一直與食物同服或一直空腹服用;而高脂飲食能顯著影響依維莫司的藥代動力學,tmax推遲約 1.75 h,Cmax降低53%,AUC降低21%,因此建議服藥期間避免高脂飲食。
3.3 其他因素
依維莫司成人體內的藥代動力學不受年齡、性別和體重的影響。1例體重為 71kg的 44歲患者,依維莫司的表觀清除率為8.82 L/h;體重每增加1 kg,清除率僅增加0.44%[16]。研究接受依維莫司、環孢素和皮質類固醇的26例肝移植患者發現,通過鼻-胃和鼻-十二指腸不同途徑給藥,均對依維莫司的藥代動力學參數影響不大[17]。Peveling等[18]針對不同程度肝損害對依維莫司藥代動力學的影響進行了研究,患者口服單劑量依維莫司10 mg,與肝功能正常患者相比,肝損害輕度、中度、重度患者的 AUC分別增加 1.60,3.26,3.64倍,表觀清除率分布是健康受試者的62%,31%,28%。肝功能嚴重損害者不建議使用依維莫司,如果權衡利弊確實需要使用,每天1次應不高于2.5 mg。
4 臨床應用評價
一項前瞻性、多中心、隨機、開放性臨床試驗[19]比較了早期應用依維莫司和神經鈣調蛋白抑制劑(CNIs)的療效。試驗納入115例心臟移植患者,移植5 d后被隨機分為治療組和對照組,治療組(56例)給予低暴露量的依維莫司(維持血藥濃度為3~6 ng/mL)、減少暴露量的環孢素(維持血藥濃度為75~175 ng/mL)、霉酚酸酯和糖皮質激素,對照組(59例)給予標準暴露量的環孢素(0~3個月,150~300 ng/mL;3~6個月,100~250 ng/mL;6~12個月,60~200 ng/mL)、霉酚酸酯和糖皮質激素;心臟移植7~11周后,治療組停用環孢素,依維莫司的暴露量提高到6~10 ng/mL,對照組方案不變。心臟移植12個月,治療組的腎小球濾過率(GFR)明顯增高,治療組和對照組分別為(79.8±17.7)mL/(min·1.73 m2),(61.5±19.6)mL/(min·1.73 m2)(P<0.001);治療組的心臟移植物血管病變(CAV)的發生率(50.0%)明顯低于對照組(64.6%,P=0.003)。移植7~11周后,治療組的急性排斥反應發生多于對照組(P=0.03),而兩組的藥物治療對患者左心室功能的影響相似。治療組和對照組副反應發生率分別為,高血壓(17.9%比 33.9%),水腫(28.6%比 18.6%),白細胞減少癥(19.6%比22.0%),胸腔積液(23.2%比13.6%),感染(60.7%比66.1%)。可見,雖然治療組的急性排斥反應發生較多,但心臟移植12個月后,心臟功能并沒有受到影響。因此,心臟移植后,以依維莫司為基礎、早期停用環孢素的治療方案能顯著改善患者的腎功能,同時具有較低的心臟移植物血管病變(CAV)發生率。
另一項前瞻性、多中心、開放性臨床試驗[20]研究了依維莫司和減少劑量的他克莫司聯用對肝移植患者的療效。試驗共納入719例患者,隨機分為3組,i組為依維莫司加他克莫司(后他克莫司撤去,231例),ii組為依維莫司加減少劑量的他克莫司(245例),iii組為標準劑量的他克莫司(243例)。由于急性排斥反應發生率較高,i組提前終止試驗。ii和iii組移植術后12個月的療效相當(從急性排斥反應、移植物失功能方面評價),分別為6.7%和 9.7%(P<0.001),急性排斥反應發生率分別為 2.9%和7.0%(P=0.035),移植物失功能發生率分別為 9.0%和9.9%(P<0.01)。ii組和 iii組嚴重感染的發生率分別為 13.9%和7.9%(RR=1.76,95%CI=1.03,3.00);GFR分別為(80.8± 32.7)mL/(min·1.73 m2),(78.9±27.7)mL/(min·1.73 m2)(P<0.01)。研究提示,肝移植術后1年,在不影響療效和可接受的安全范圍內,依維莫司和減少劑量的他克莫司聯用,能維持較好的腎功能。
5 不良反應
依維莫司作為免疫抑制劑,對器官移植的患者有較好的療效,但會產生一些不良反應,應用過程中需要早期識別和治療,以避免嚴重藥源性疾病的發生。依維莫司用于腎移植時常見的不良反應及發生率見表 1[21]。Miura等[22]報道了 1例腎移植術后出現蛋白尿的68歲腎移植男性患者,移植術后用他克莫司緩釋劑(TACER)、雷酚酸酯、巴利昔單抗和類固醇。移植術后2年,該患者的移植物功能穩定,GFR為31 mL/min,24 h尿蛋白為90 mg,無明顯的蛋白尿出現;TACER谷濃度為2.9 ng/mL,AUC0~24為95 ng/(h·mL);但腎活檢顯示有CNI毒性表現。為停用TACER,加用依維莫司,劑量為1.5 mg/d,谷濃度達3.0~4.5 ng/mL。依維莫司應用3個月后,蛋白尿增加;繼續提高劑量至 2.0 mg/d,同時減少TACER的劑量至1.0 mg/d,但蛋白尿繼續升高(超過1.0 g),血清肌酐(Cr)和C反應蛋白也升高,同時伴有皮疹和呼吸困難。停用依維莫司并將TACER恢復到最初劑量時,蛋白尿下降(0.5 g);同時給予甲強龍沖擊治療(125 mg)3 d,蛋白尿得到改善(0.1 g),且其他癥狀也隨即消失。根據同種異體活組織檢查及免疫熒光等檢查結果和患者的臨床表現,伴有蛋白尿的腎小球損傷被認為是依維莫司引起的。該病也說明了通過同種異體活組織檢查明確病理改變的重要性。雖然依維莫司能維持較好的腎功能,但也存在產生蛋白尿的可能性。因此,依維莫司用于抗排斥反應時,應綜合評定其療效與不良反應,采取個體化治療為宜,并嚴密監測血藥濃度、實驗室檢查及生命體征等,便于及時調整藥物劑量或更改治療方案,以防嚴重不良反應事件的發生。
6 臨床研究方案參考
Langer等[23]研究發現,在腎移植患者中,依維莫司合并低劑量他克莫司獲得較好的抗排斥作用、較低的不良反應及較好的腎功能,依維莫司 C0為3~8 ng/mL,他克莫司0~3個月的 C0為4~7 ng/mL,4~7個月 C0為 1.5~3 ng/mL。Junge等[24]的研究提示,肝移植患者采用依維莫司(C03~8 ng/mL)合并低劑量他克莫司(C03~5 μg/L)能維持較好的腎功能,急性排斥反應發生率較低。de Pablo等[25]研究發現,肺移植患者在獲得較好療效的同時,盡早將嘌呤抑制劑替換為依維莫司可更好地維持腎功能;依維莫司的 C0為4~8 μg/L;聯合環孢素A時,推薦減少環孢素A的給藥劑量,使環孢素 A C0降低50%左右,維持在100 μg/L。Kovarik等[26]研究發現,心臟移植后血藥濃度依維莫司維持在3~6 ng/mL,環孢素 A維持在 75~175 ng/mL,7~11周后依維莫司提高至6~10 ng/mL并停用環孢素A,能取得較好的療效。
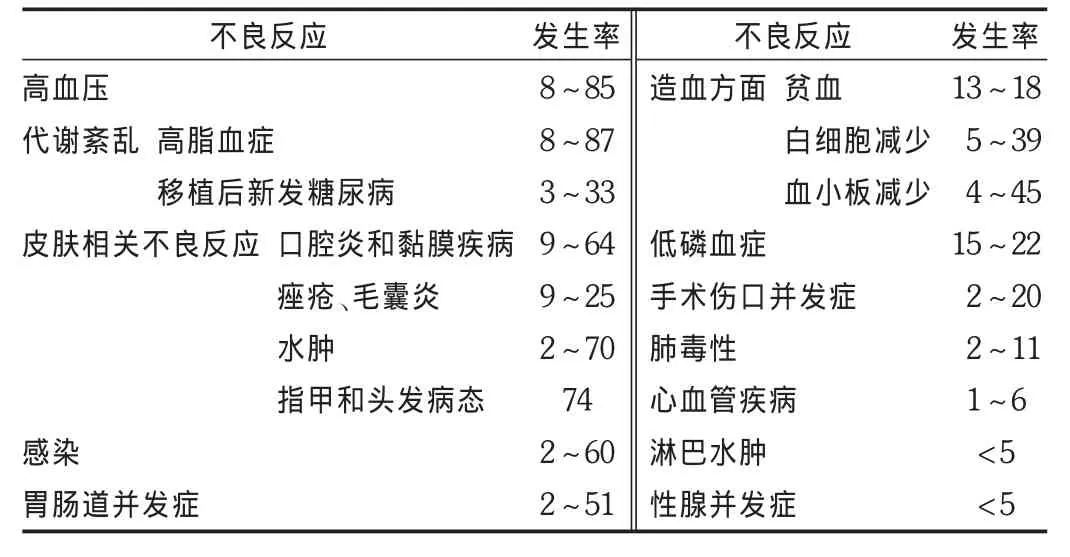
表1 依維莫司用于腎移植時常見的不良反應(%)
CNIs(如環孢素、他克莫司)是器官移植領域廣泛使用的免疫抑制劑,盡管能取得較低的免疫排斥作用,但由于其嚴重的腎毒性,很難維持長期的移植物功能。為了避免腎毒性,移植后早期停用或減小CNIs劑量并引入mTOR抑制劑將是一種有效的治療策略。但依維莫司合用或撤銷CNIs時,不同的臨床研究有不同的治療劑量,很難確定一個最佳的治療劑量,因此依維莫司的治療方案應個體化。推薦監測依維莫司及CNIs血藥濃度,一般依維莫司血藥濃度維持在3~8 ng/mL;而他克莫司或環孢素的治療目標范圍不固定,不同研究或不同器官移植的目標范圍不同。另外,依維莫司的 C0和 AUC有較好的相關性,因此 C0可作為提高臨床療效監測的一個依據。盡管依維莫司和環孢素、他克莫司藥物相互作用的研究結果并不完全一致,但有研究提示[14],依維莫司和他克莫司合用時劑量應高于與環孢素合用時的劑量。
[1]Calane RY,Collier DS,Lim S,et al.Rapamycin for immunosuppression in organ allografting[J].See comment in PubMed Commons belowLancet,1989,2(8 656):227.
[2]Schuler W,Sedrani R,Cottens S,et al.SDZ RAD,a new rapamycin derivative:pharmacological properties in vitro and in vivo[J].Transplantation,1997,64(1):36-42.
[3]Vezina C,Kudelski A,Sehqal SN.Rapamycin(AY-22,989),a new anti
fungal antibiotic:I.taxonomy of the producing streptomycete and isolation
of the active principle[J].J Antibiot(Tokyo),1975,28(10):721-726.[4]Crowe A,Bruelisauer A,Duerr L,et al.Absorption and intestinal metabolism of SDZ-RAD and rapamycin in rats[J].See comment in PubMed Commons belowDrug Metab Dispos,1999,27(5):627-632.
[5]Sánchez-Fructuoso AI.Everolimus:an update on the mechanism of action,pharmacokinetics and recent clinical trials[J].Expert Opin Drug Metab Toxicol,2008,4(6):807-819.
[6]Kirchner GL,Meier-Wiedenbach L,Manns MP.Clinical Pharmacokinetics of Everolimus[J].Clin Pharmacokinet,2004,43(2):83-95.
[7]Grabowsky JA.Interactions and the pharmacist:foucs on everolimus[J].Ann Pharmacother,2013,47(7-8):1 055-1 063.
[8]Kovarik JM,Beyer D,Bizot MN,et al.Blood concentrations of everolimus are markedly increased by ketoconazole[J].J Clin Pharmacol,2005,45(5):514-518.
[9]Kovarik JM,Kalbag J,Figueiredo J,et al.Differential influence of two cyclosporine formulations on everolimus pharmacokinetics:a clinically relevant pharmacokinetic drug interaction[J].J Clin Pharmacol,2002,42(1):95-99.
[10]Kovarik JM,Beyer D,Bizot MN,et al.Pharmacokinetic interaction between verapamil and everolimus in healthy subjects[J].Br J Clin Pharmacol,2005,60(4):434-437.
[11]Kovarik JM,Beyer D,Bizot MN,et al.Effect of multiple-dose erythromycin on everolimus pharmacokinetics[J].Eur J Clin Pharmacol,2005,61(1):35-38.
[12]Kovarik JM,Beyer D,Schmouder RL.Everolimus drug interactions:application of a classification system for clinical decision making[J].Biopharm Drug Dispos,2006,27(9):421-426.
[13]Kovarik JM,Hartmann S,Hubert S,et al.Pharmacokinetic and pharmacodynamic assessments of HMG-CoAreductase inhibitors when coadministered with everolimus[J].See comment in PubMed Commons below J Clin Pharmacol,2002,42(2):222-228.
[14]Fuad Shihab,Uwe Christians,Lonnie Smith.Focus on mTOR inhibitors and tacrolimus in renal transplantation:Pharmacokinetics,exposure-response relationships,and clinical outcomes[J].Transplant Immunology,2014,31(1):22-32.
[15]Moore LW.Food,Food Components,and Botanicals Affecting Drug Metabolism in Transplantation[J].J Ren Nutr,2013,23(3):e71-e73.
[16]Kovarik JM,Hsu CH,McMahon L,et al.Population pharmacokinetics of everolimus in de novo renal transplant patients:impact of ethnicity and comedications[J].Clin Pharmacol Ther,2001,70(3):247-254.
[17]Levy GA,Grant D,Paradis K,et al.Pharmacokinetics and tolerability of 40-O-[2-hydroxyethyl]rapamycin in de novoliver transplant recipients[J].Transplantation,2001,71(1):160-163.
[18]Peveling-Oberhag J,Zeuzem S,Yong WP,et al.Effects of hepatic impairment on the pharmacokinetics of everolimus:a single-dose,openlabel,parallel-griup study[J].Clin Ther,2013,35(3):215.
[19]Andreassen AK,Andersson B,Gustafsson F,et al.Everolimus Initiation and Early Calcineurin Inhibitor Withdrawal in Heart Transplant Recipients:A Randomized Trial[J].Am J Transplant,2014,14(8):1 828-1 838.
[20]de Simone P,Nevens F,de Carlis L,et al.Everolimus With Reduced Tacrolimus Improves Renal Function in De Novo Liver Transplant Recipients:A Randomized Controlled Trial[J].Am JTransplant,2012,12(11):3 008-3 020.
[21]Zaza G,Tomei P,Ria P,et al.Systemic and Nonrenal Adverse Effects Occurring in Renal Transplant Patients Treated with mTOR Inhibitors [EB/OL].[2013-08-04].http://www.hindawi.com/journals/jir/2013/403280.
[22]Miura M,Yanai M,Fukasawa Y,et al.De novo proteinuria with pathologicalevidence ofglomerulonephritisaftereverolimusinduction[J].Nephrology(Carlton),2014,19(Suppl 3):57-59.
[23]Langer RM,Hené R,Vitko S,et al.Everolimus plus early tacrolimus minization:a phase II,randomized,open-labed,multicentre trial in renal transplantation[J].Transpl Int,2012,25(5):592-602.
[24]Junge G,Dumortier T,Schwende H,et al.mTOR inhibition in liwer transplantation:how to dose for effective/safe CNI reduction[J].Transplant Proc,2013,45(5):1 979.
[25]de Pablo A,Santos F,Solé A,et al.Recommendations on the use of everolimus in lung transplantation[J].Transplant Rev:Orlando,2013, 27(1):9-16.
[26]Kovarik JM,Sabia HD,Figueiredo J,et al.Influence of hepatic impairment on everolimus pharmacokinetics:implications for dose adjustment[J].Clin Pharmacol Ther,2001,70(5):425-430.
Clinical Application of Everolimus in Field of Organ Transplantation
Liu Li1,2,Wang Huaguang2(1.Institute of Medicinal Biotechnology,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijiing,China 100050; 2.Beijing Chaoyang Hospital,Beijing,China 100020)
Objective To summary the clinical application of everolimus in the field of organ transplantation by describing the action mechanism,pharmacokinetics,influence factors,clinical evaluation,adverse reaction,and so on.M ethods By consulting the literatures about the mechanism,pharmacokinetics and clinical researches of everolimus in recent years,the important informations were extracted, analyzed and summarized for conducting this review.Results and Conclusion Everolimus can maintain better renal function in the aspect of organ transplantation;various factors,such as food,drugs,can affect its pharmacokinetic properties.With the existing research clinical treatment regimen as the guidance,individualized medication regime and monitoring its blood concentration can increase the curative effect and reduce the adverse reactions.
everolimus;organ transplantation;pharmacokinetics;clinical evaluation;blood drug concentration
劉麗(1990-),女,在讀碩士研究生,主要研究方向為微生物與生化藥學、臨床藥學,(電話)010-63010986(電子信箱)liuli0978@163.com;王華光(1976-),女,碩士研究生,主管藥師,主要研究方向為臨床藥學,本文通訊作者,(電子信箱)whg_007@163.com。
2014-10-27)
R969;R979.5
A
1006-4931(2015)13-0003-04

