雷公藤甲素對類風濕關節炎患者滑膜成纖維樣細胞增殖的體外抑制作用研究Δ
葉 蕾,賈 霜,潘文萍(.山東省千佛山醫院藥學部,濟南 25004;2.山東省千佛山醫院風濕免疫科,濟南 25004)
類風濕關節炎(RA)以關節慢性侵蝕性炎癥為特征,基本病理變化為滑膜炎,表現為成纖維樣滑膜細胞(Fibroblast-like synoviocytes,FLS)過度增生、大量T 淋巴細胞和巨噬細胞浸潤以及血管翳的形成。FLS 作為炎癥性滑膜炎中組織損傷和基質重塑的直接效應細胞,可通過誘導炎癥反應、介導骨基質降解、促進破骨細胞分化或增殖等途徑參與RA 患者關節軟骨、骨質的破壞[1-3]。因此,抑制FLS的異常增殖或誘導FLS分化成熟成為治療RA的新策略。
雷公藤是衛茅科植物,具有抗炎、抑制免疫的作用,臨床上常用于治療RA、腎病綜合征、支氣管哮喘等,但其作用機制尚不完全清楚[4]。雷公藤甲素(Triptolide,TP)又稱雷公藤內酯醇,是中藥雷公藤的有效單體成分,是雷公藤中活性最高的環氧化二萜內酯化合物,臨床上常用于治療RA。有研究表明,TP 體外可誘導RA 患者FLS 的凋亡[5],但相關的試驗數據較少,故本試驗研究TP 對RA 患者體外FLS 增殖和細胞周期的影響,并探討其可能的作用機制,以期為TP治療RA提供試驗依據。
1 材料
1.1 儀器
3100 SeniesⅡ水套CO2細胞培養箱、Labofuge 400 高速離心機、Multiskan MK3酶標儀(美國Thermo 公司);Epics XL流式細胞儀(美國Beckman coulter公司);X70倒置顯微鏡[Olympus(中國)有限公司]。
1.2 藥品與試劑
雷公藤甲素(上海融禾醫藥科技發展有限公司,批號:071206,純度:99.92%);高糖DMEM 培養基(美國Gibco BRL公司);胎牛血清(FBS,美國Gibco BRL公司),Ⅲ型膠原酶(美國Sigma 公司,批號:30H6812);胰蛋白酶(上海華美公司);二甲基亞砜(DMSO,上海生工生物工程有限公司)。
1.3 滑膜組織來源
滑膜組織取自山東省千佛山醫院骨關節科經關節鏡行膝關節置換術或滑膜切除術的5 例RA 患者,RA 診斷均符合1987年美國風濕病學會修訂的類風濕關節炎分類標準。患者均為女性,年齡59~72 歲,平均年齡61 歲,X 線分期均為Ⅳ期。5 例患者均于術中切取膝關節滑膜組織。本試驗經山東省千佛山醫院倫理委員會批準。
2 方法
2.1 FLS的分離、培養與鑒定
采用組織塊原代培養法進行FLS 原代培養,具體方法見文獻[5]。倒置顯微鏡下觀察細胞生長情況,當細胞生長至覆蓋底面>80%時,吸棄培養液,用無菌磷酸鹽緩沖液(PBS)沖洗2~3遍,加入胰蛋白酶/乙二胺四乙酸溶液于37 ℃消化約1 min。倒置顯微鏡下觀察,若大部分細胞胞質回縮、胞體變圓、細胞間隙增大,則加入少量含10%FBS的DMEM培養液終止消化,吸管吹打使細胞懸液混勻后移至15 ml 離心管中,以離心半徑為17 cm、1 000 r/min 離心5 min,棄上清,加入適量含10%FBS的DMEM培養液吹打均勻后,按1∶3傳代,分別接種到培養瓶中,置于含5%CO2、37 ℃培養箱中培養。根據細胞的生長情況及培養液的變化,每1~3 天更換培養液1 次。細胞培養至3~4代后,加入CD55抗體,用流式細胞儀檢測細胞表達CD55陽性率,檢驗細胞純度。
2.2 臺盼藍法對體外FLS計數及活力檢測
將第3~4 代細胞消化、離心、重懸后,取等體積細胞懸液與5 g/L的臺盼藍染液混勻,靜置染色3~4 min后計數。死細胞被染成淡藍色,活細胞拒染。根據以下公式進行細胞計數并計算活細胞百分率:細胞總數=(4大格細胞總數/4)×104×稀釋倍數;活細胞百分率(%)=(4 大格活細胞總數/4 大格細胞總數)×100%。
2.3 MTT法檢測細胞的增殖抑制率
取對數生長期細胞,用含10% FBS 的DMEM 制備成1×105ml-1的細胞懸液,接種于96 孔培養板中,孵育24 h 后加入TP溶液,制成TP終濃度為0 nmol/ml的空白對照組和50、100、200 nmol/ml 的低、中、高濃度組,每個濃度設6 個復孔。分別置于37 ℃、5%CO2的培養箱中繼續培養24、48、72 h后,加入5 mg/ml MTT 20 μl,繼續培養4 h,棄去上清,每孔加DMSO 200 μl,振蕩至結晶完全溶解。用酶標儀于490 nm波長處測定吸光度A,細胞的增殖抑制率(SF,%)=(1-A試驗組/A空白對照組)×100%。
2.4 流式細胞術檢測細胞凋亡和周期
取對數生長期細胞制成5×105ml-1的細胞懸液,將試驗分為4 組,TP 濃度分別為0(空白對照)、50、100、200 nmol/ml,每個濃度設6個復孔。各組細胞均于37 ℃、5%CO2培養箱中培養48 h 后,取適量細胞,PBS 洗滌2 次,加入70%乙醇固定30 min,離心后PBS洗2次,棄上清,加入10 mg/ml的核糖核酸酶A 100 μl 和10 mg/ml 的溴化丙啶(PI)2 ml,4 ℃避光孵育30 min,流式細胞儀檢測細胞凋亡和細胞周期。
2.5 統計學方法
3 結果
3.1 細胞的形態及鑒定結果
對原代培養的FLS進行貼壁分離純化,細胞傳代培養,試驗各間段均在倒置顯微鏡觀察細胞形態。結果顯示,活細胞百分率>98%,流式細胞儀鑒定細胞表面CD55陽性表達率大于95%,因此可用3~4代細胞進行試驗。
3.2 各組細胞增殖抑制率檢測結果
與空白對照組比較,各給藥組作用24、48、72 h后SF值均升高,差異有統計學意義(P<0.05);作用時間相同時,隨著藥物濃度的增加,SF 值增加;當藥物濃度相同時,適當延長作用時間,SF 值略有升高(除中濃度組72 h SF 值較48 h 略有下降),平均在24~48 h達抑制最大值。增殖抑制率測定結果見表1。
表1 增殖抑制率測定結果(,n=6)Tab 1 The results of proliferation inhibitory rates(,n=6)
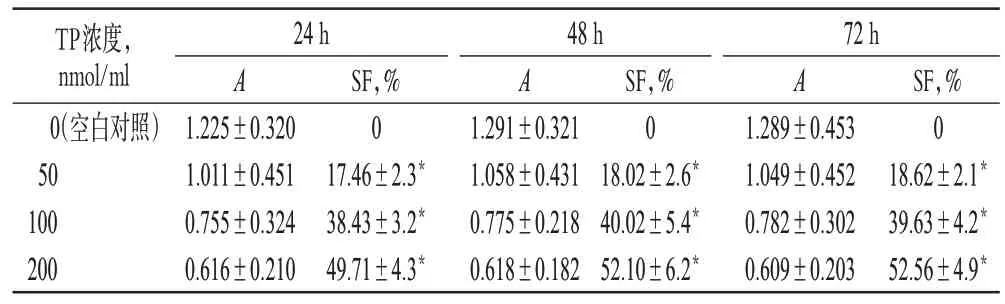
表1 增殖抑制率測定結果(,n=6)Tab 1 The results of proliferation inhibitory rates(,n=6)
注:與空白對照組比較,*P<0.05Note:vs.blank control group,*P<0.05
3.3 各組細胞凋亡和細胞周期檢測結果
與空白對照組比較,中、高濃度TP 作用后G0/G1期細胞比例增加,S 期細胞比例減少,差異有統計學意義(P<0.05);且高濃度時可誘導細胞凋亡,作用48 h后出現顯著凋亡峰(見圖1)。各組細胞周期檢測結果見表2。
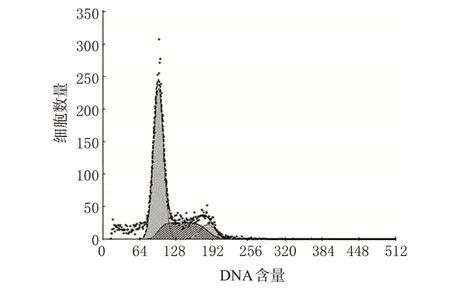
圖1 高濃度TP對FLS的流式細胞凋亡圖Fig 1 Flow cytometry apoptosis of FLS after treated with high concentration of TP
表2 細胞周期檢測結果(,n=6,%)Tab 2 The results of cell cycle test(,n=6,%)
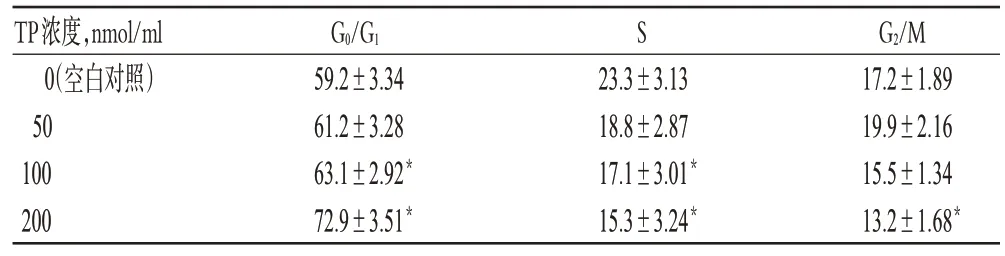
表2 細胞周期檢測結果(,n=6,%)Tab 2 The results of cell cycle test(,n=6,%)
注:與空白對照組比較,*P<0.05Note:vs.blank control group,*P<0.05
4 討論
正常情況下,FLS可分泌纖維蛋白、膠原蛋白、軟骨素蛋白聚糖等多種結締組織的組成成分,在保持關節內環境穩態中發揮重要作用[6]。大量的研究表明,RA 患者的FLS 在慢性炎癥過程中被激活后出現細胞表型的顯著改變,在連續培養中這些細胞表現出高增殖率、接觸抑制缺失、組成性表達細胞因子mRNA 和錨定非依賴性細胞生長等特性[7]。FLS為RA患者炎癥性滑膜炎中組織損傷和基質重塑的關鍵效應細胞,抑制FLS增殖可有效減輕關節炎和減少骨侵蝕,從而達到治療RA的效果。
研究證明,TP可抑制炎癥關節滑膜組織中多種趨化因子、細胞因子mRNA及其相應受體的表達[8-11],抑制血清中炎性細胞因子的表達,促進抗炎細胞因子的水平升高[11],抑制滑膜細胞分泌血管內皮生長因子(VEGF)、金屬基質蛋白酶9(MMP-9)等從而抑制血管翳增殖[12]。
筆者從RA患者膝關節分離滑膜組織,采用組織塊培養法得到的FLS,經原代培養后,取第3~4代FLS用于試驗。加入TP 作用24 h 后FLS 即開始出現生長明顯減慢,光鏡下可見細胞突觸回縮,細胞形態變不規則,細胞變圓甚至皺縮變小,核分裂相細胞較少,有的可見凋亡小體。這與周光偉等[5]研究結果相一致。不同濃度對FLS 的增殖均有抑制作用,并隨濃度的加大抑制作用增強,呈濃度依賴性;而與作用時間并無明顯的正相關關系,平均24~48 h均達作用最高峰。低劑量TP雖對FLS細胞增殖有抑制作用,但對其細胞周期無明顯影響。加大藥物濃度可誘導細胞凋亡,使S 期細胞比例降低,G0/G1期細胞比例增加,抑制細胞有絲分裂,促進細胞分化。
綜上,TP 對RA 患者體外培養的FLS 具有良好的抑制作用,高濃度TP 可誘導FLS 凋亡,但其作用機制不明,有待進一步研究。
[1]Jackson JR,Minton JA,Ho ML,et al.Expression of vascular endothelial growth factor in synovial fibroblasts is induced by hypoxia and interleukin-1β[J].J Rheumatol,1997,24(7):1 253.
[2]Marinova-Mutafchieva L,Williams RO,Funa K,et al.Inflammation is preceded by tumor necrosis factor-dependent infiltration of mesenchymal cells in experimental arthritis[J].Arthritis Rheum,2002,46(2):507.
[3]Lories RJ,Derese I,Ceuppens JL,et al.Bone morphogenetic proteins 2 and 6,expressed in arthritic synovium,are regulated by proinflammatory cytokines and differentially modulate fibroblast-like synoviocyte apoptosis[J].Arthritis Rheum,2003,48(10):2 807.
[4]姚金成,劉穎,胡領,等.雷公藤甲素誘導肝細胞L-02 凋亡的作用機制研究[J].中國藥房,2013,24(11):964.
[5]周光偉,沈權,金若玨,等.雷公藤多苷對類風濕關節炎患者滑膜細胞凋亡的影響[J].浙江臨床醫學,2007,9(8):1 034.
[6]Ospelt C,Neidhart M,Gay RE,et al.Synovial activation in rheumatoid arthritis[J].Front Biosci,2004,1(9):2 323.
[7]Bartok B,Firestein GS.Fibroblast-like synoviocytes:key effector cells in rheumatoid arthritis[J].Immunol Rev,2010,233(1):233.
[8]陳宗良.雷公藤多苷對滑膜細胞趨化因子RANTES、MCP-1影響的研究[J].中國醫療前沿,2009,13(4):125.
[9]Li H,Zhang YY,Tan HW,et al.Therapeutic effect of tripterine on adjuvant arthritis in rats[J].J Ethnopharmacol,2008,118(3):479.
[10]陳學晏,劉揚,李振英.雷公藤多苷治療佐劑關節炎大鼠對TH1/TH2細胞平衡的影響[J].黑龍江醫科大學,2009,32(2):95.
[11]毛曉丹,孫賽君,裴紫燕,等.雷公藤內酯醇對類風濕關節炎滑膜成纖細胞IL-18 及其受體表達的影響[J].細胞與分子免疫學雜志,2009,25(7):606.
[12]張前德,時彥標,談文峰,等.雷公藤甲素對類風濕關節炎滑膜成纖維細胞系MH7A中VEGF、MMP-9水平變化的影響[J].南京醫科大學學報:自然科學版,2008,28(7):902.

