載透明質酸-甲基膠原-三元共聚物/多柔比星復合膜的鉭支架的制備及處方優化
李 飛,梁嘉碧,祁 真,郭新銘(中山大學附屬第五醫院,廣東珠海 519000)
植入式緩控釋給藥系統是緩控釋制劑的一個重要組成部分,因其具有使藥物生物活性增強及生物利用度提高等特點,應用范圍也越來越廣,例如用在腫瘤、心血管等方面的治療[1]。多柔比星(Doxorubicin,Dox)是臨床常用的抗腫瘤藥物,但因其心臟、腎臟毒性大,限制了其臨床應用。現急于尋找一種更有效的制劑,以最大限度提高腫瘤組織內Dox的濃度,最大限度降低心臟和腎臟內Dox的濃度[2]。鑒于上述需求,本研究將Dox做成植入式緩控釋系統,在金屬鉭支架材料表面利用靜電自組裝反應制備出載透明質酸-甲基膠原-三元共聚物/Dox 復合膜的鉭支架,并采用正交設計優化處方,為下一步該緩釋系統用于臨床植入治療骨腫瘤奠定基礎。
1 材料
1.1 儀器
紫外分光光度計(美國Thermo Scientific公司);JB-3定時恒溫磁力攪拌器(上海電磁新徑儀器公司);LGJ-25C冷凍干燥機(長沙湘儀儀器公司);SHZ-D(Ⅲ)循環水式真空泵(鞏義市予華儀器公司);NOVA 系列NANNOSEM600 共聚焦掃描電鏡(德國FEI 公司);SHC-C 水浴恒溫振蕩器(江蘇環宇儀器公司)。
1.2 藥品與試劑
Dox 原料藥(深圳萬樂藥業公司,批號:1203A3,純度:>98%);Ⅰ型膠原(華南理工大學材料學院提供);透明質酸(美國Lifecore 生物公司);多孔金屬鉭支架材料(美國Zimmer 公司);甲基丙烯酸羥乙酯、甲基丙烯酸甲酯和甲基丙烯酸單體(廣州永屹化工有限公司,批號:1104B8、1204A4、1009A1,純度:均>98%)。
1.3 其他
透析袋(北京鼎國科技公司)。
2 方法與結果
2.1 成膜材料的制備
2.1.1 甲基膠原的制備 稱取適量Ⅰ型膠原加入到20 ml 的0.1 mol/L的鹽酸溶液中,溶解制成透明膠原溶液,將膠原溶液加入到400 ml 丙酮中,攪拌,產生沉淀。靜置一段時間,將產生的沉淀膠原置于200 ml 含0.1 mol/L 鹽酸的甲醇溶液中,在4 ℃無菌條件下攪拌。然后將甲基化后的200 ml 混合溶液裝入透析袋中,置于盛有蒸餾水的燒杯中,透析直到蒸餾水的pH為6.3。整個過程溫度保持在4 ℃。移除透析袋里的溶液,對甲基膠原溶液冷凍干燥。
2.1.2 三元共聚物的制備 在78 ℃、雙偶氮異丁腈的啟動下,加入0.1 mol/L 甲基丙烯酸羥乙酯、甲基丙烯酸甲酯和甲基丙烯酸單體在異丙醇中,減壓蒸餾,各單體的摩爾比為25 ∶25 ∶50,單體與溶劑比例為1 ∶6(m/V)。在油浴中磁性攪拌,合成甲基丙烯酸羥乙酯-甲基丙烯酸甲酯-甲基丙烯酸的三元共聚物。反應24 h后降至室溫,加入過量的石油醚,聚合物即沉淀析出。過濾沉淀,加入少量乙醇溶解,置于蒸餾水中再次沉淀,回收沉淀物,即得三元共聚物。
2.2 載透明質酸-甲基膠原-三元共聚物/Dox復合膜的鉭支架的制備
將金屬鉭支架材料放入透明質酸溶液中,放入真空干燥器中負壓抽吸。將吸附有透明質酸的鉭支架材料進行冷凍干燥。取適量甲基膠原溶液和Dox溶液,混合均勻,然后用加樣槍定量吸取混合溶液滴加在鉭材料上,真空干燥;再用加樣槍吸取適量三元共聚物溶液滴加在鉭材料上,充分反應1 h后真空干燥,制得載透明質酸-甲基膠原-三元共聚物/Dox復合膜的鉭支架。用共聚焦掃描電鏡觀察所制備復合膜的鉭支架材料內部,以空白鉭支架材料內部為對照,可觀察到所制復合膜內部有明顯的膜(圖1黑框處)形成,證明了透明質酸、甲基膠原、三元共聚物通過靜電自組裝反應形成了均勻分布的復合膜[3]。共聚焦掃描電鏡圖見圖1。

圖1 共聚焦掃描電鏡圖Fig 1 Confocal scanning electron microgram
2.3 Dox含量測定方法考察[4]
精密稱取Dox原料藥,加pH 7.2磷酸鹽緩沖液(PBS)溶解并定量稀釋制成0.05、0.1、0.2、0.5、1、2、5、10 μg/ml 的標準溶液,以pH 7.2 PBS為空白,采用紫外分光光度法測定234 nm波長處的吸光度。以吸光度(y)為縱坐標、質量濃度(x)為橫坐標進行回歸分析,得回歸方程為y=0.001 2x+0.022 5(r=0.999 8);日內RSD小于1.83%(n=5),日間RSD小于2.01%(n=5)。
2.4 體外釋放度方法考察[5]
將制備的載復合膜的鉭支架材料置于裝有2 ml PBS的深色離心管中,于37 ℃下水浴搖床中振搖(80 r/min),考察30 d內的體外累積釋放度。樣品溶液經濾過后用pH 7.2的PBS稀釋,搖勻,作為供試品溶液,按照“2.3”項下方法測定吸光度,并代入回歸方程計算含量,再計算累積釋放度。
2.5 正交設計優化處方工藝及驗證
根據預試驗結果,以對影響累積釋放度的3 個主要因素:透明質酸(A)、甲基膠原(B)、三元共聚物的質量濃度(C)。以A、B、C為因素,以1、30 d的累積釋放度為指標,按正交表設計試驗,優化處方[6]。因素與水平見表1,正交試驗結果與極差分析見表2,方差分析結果見表3。
由表2可知,根據1 d累積釋放度結果顯示,因素對處方的影響程度為A>B>C;根據30 d累積釋放度結果顯示,因素對處方的影響程度為B>A>C。由表3可知,就1 d累積釋放度而言,A對處方有顯著影響(P<0.05),其余因素對處方無顯著影響。綜合考慮,最優處方為A1B3C3,即透明質酸1 mg/ml、甲基膠原4.5 mg/ml、三元共聚物100 mg/ml。
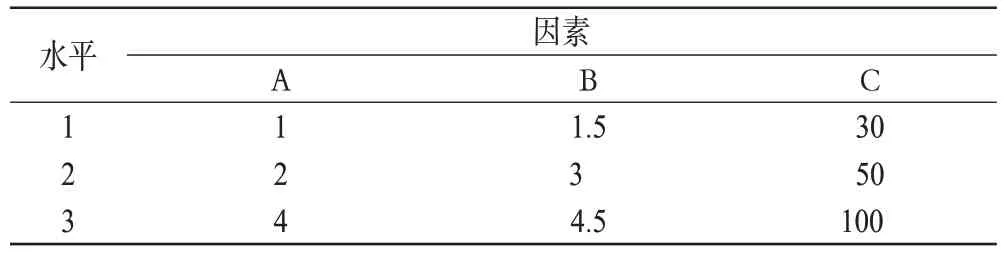
表1 因素與水平(mg/ml)Tab 1 Factors and levels(mg/ml)
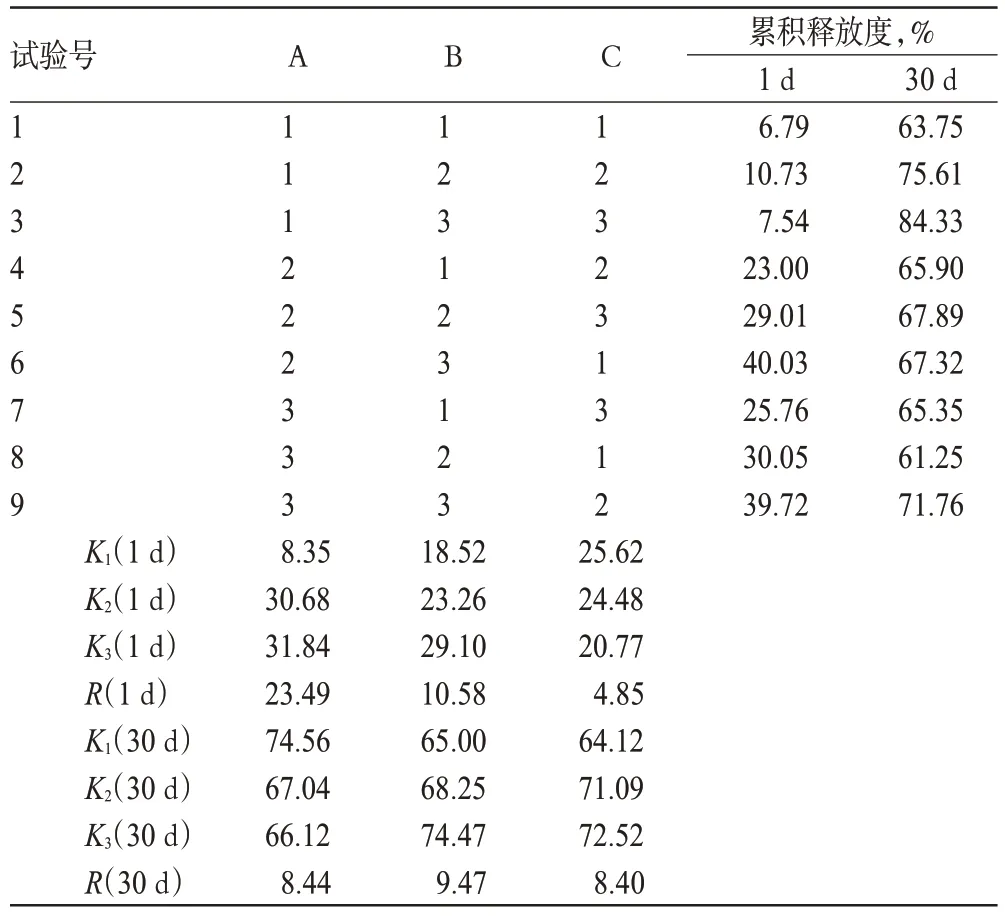
表2 正交試驗結果與極差分析Tab 2 Result of orthogonal experiments and range analysis
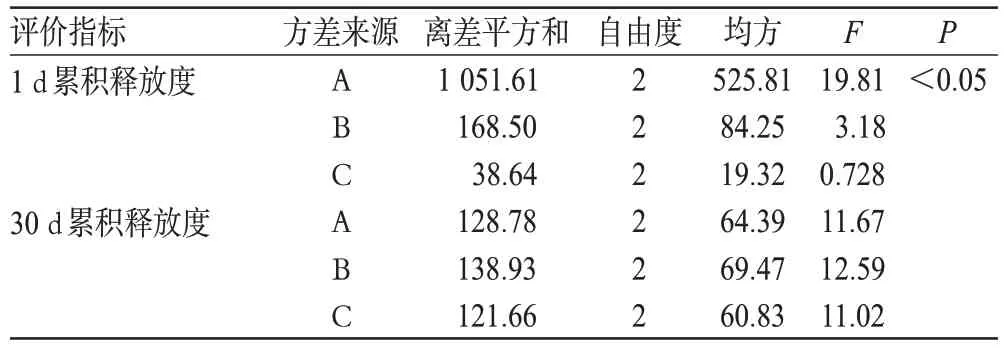
表3 方差分析結果Tab 3 Analysis of variance
按最優處方制備3 批樣品,按“2.4”項下方法考察1、30 d的累積釋放度,結果分別為(7.57±2.3)%、(84.14±2.1)%。
2.6 釋放機制分析
在“2.5”項下驗證試驗過程中,分別于1、2、3、5、10、14、18、22、26、30 d取樣,測定并計算累積釋放度。以累積釋放度對時間作圖,繪制體外釋放曲線,結果見圖2。

圖2 復合膜中Dox的體外釋藥曲線Fig 2 Release curve of Dox in compound membranes in vitro
由圖2可知,Dox在初始時快速釋放,有釋藥沖擊量;隨著時間的延長,每日釋放量減少;且在20 d 后,體系的每日釋放量隨著時間的增長而緩慢減小,溶出速率趨于穩定,近似為零級速率釋藥。由此可見,該緩釋系統在體外模擬環境下可維持緩釋時間達30 d。
3 討論
本試驗中所采用的植入材料為多孔金屬鉭支架材料,其生物相容性好、彈性模量接近松質骨,具有非降解特性,物理化學性能穩定。這種材料是通過化學蒸汽沉積法在均勻的網狀碳骨架表面噴涂了一層惰性金屬鉭制作而成的,其平均孔徑為430μm,孔隙率為75%~80%,孔隙間相互連通,是一個比較新穎的金屬材料。
由驗證試驗結果可見,所制Dox 植入式緩控釋系統30 d平均累積釋放度為84.14%,低于緩控釋制劑要求的藥物完全累積釋放度90%。究其原因,筆者認為是多孔金屬鉭支架材料的自身問題。
在本試驗中,影響制備Dox 植入式緩控釋系統的因素除了成膜材料的濃度外,筆者認為還包括自組裝反應的時間與溫度。本次研究中統一反應時間為1 h、反應溫度為室溫,后續試驗中筆者將對其作進一步優化。
本試驗研制的Dox植入式緩控釋系統體外釋放符合擬訂的釋藥速度要求。由正交設計可見,透明質酸作為大分子黏彈性物質[7],其對釋藥速度影響最大。由釋放度結果可見,制備的Dox緩控釋系統具有緩釋作用,釋放度重現性良好,但該系統在動物體內釋放、吸收等情況還有待進一步研究。
[1]王明,楊小平,蘇宇雄,等.定量緩釋基因重組堿性成纖維細胞生長因子/聚乳酸-聚羥基乙酸植入片的制備及體外釋藥研究[J].中華口腔醫學研究雜志,2008,2(2):19.
[2]李勃,肖引,劉凱,等.阿霉素磁靶向藥物制劑研究進展[J].中國藥業,2014,23(10):96.
[3]屠錫德.藥劑學[M].3 版.北京:人民衛生出版社,2002:949-951.
[4]樊秋平,梁嘉碧,楊海云,等.熱療用阿霉素溫敏納米粒的制備及工藝優化[J].中國藥房,2011,22(17):1 580.
[5]祝俠麗,賈永艷,黃海英,等.正交設計法優化布洛芬緩釋骨架片的處方工藝[J].中國藥房,2014,25(9):830.
[6]鮑玉成,張文龍,王勇,等.長效緩釋雙藥物人工骨的制備及釋放特性[J].中國組織工程研究,2012,16(38):7 126.
[7]陳建澎,王婧茜,易喻,等.透明質酸及其衍生物研究進展[J].中國生物工程雜志,2015,35(2):111.

