大鼠腦出血后活化星形膠質細胞EGFR-JAK1/STAT3表達及Genistein 的抑制作用
肖 霖,劉 珍,武 衡
目前,許多研究認為星形膠質細胞活化在腦出血后腦損傷中可能起著重要的作用,腦損傷后,星形膠質細胞通過自分泌、旁分泌多種細胞因子促進自身的分裂增殖,其中轉化生長因子-α(TNF-α)、表皮生長因子(EGF)是刺激活化AS 進入細胞周期的關鍵因子[1],而表皮生長因子受體(epidermal growth factor receptor,EGFR)是TNF-α、EGF 兩種配體的共同受體。EGFR 是ErbB(ErbB1-4)家族的一員,是一種跨膜糖蛋白,屬受體型酪氨酸蛋白激酶(RTK),與配體結合后,受體二聚化導致細胞內酪氨酸蛋白激酶活化,通過激活下游多條信號轉導通路(Ras/Raf/MEK/ERK/MAPK 通路、PI3K/PDK1/Akt 通路、JAK/STAT 通路)[2]將信息傳遞到核內,作用靶基因,參與調節許多細胞的增殖、分化與遷移。近來有研究發現,在中樞神經系統損傷(外傷、卒中、腫瘤)或神經系統變性(阿爾茨海默病、帕金森病)[3]等情況下,EGF 及EGFR 在星形膠質細胞表達迅速上調,并長時間持續存在。我們最近的研究也表明,體外培養的星形膠質細胞應用睫狀神經營養因子(CNTF)活化后,EGFR mRNA 表達明顯上調[4],表明EGFR 可能介導了星形膠質細胞活化的信號轉導,是觸發星形膠質細胞由靜息狀態轉變為活化狀態的上游信號調控分子。而JAK/STAT 通路是EGFR 下游信號傳導通路之一,基于此,我們選擇染料木黃酮(genistein,GST)特異地抑制酪氨酸激酶活性[5],通過抑制EGFR 表達,進一步抑制其下游信號系統的激活,從而抑制細胞生長,為腦損傷后干預星形膠質細胞活化提供新的藥效學靶點。
1 材料與方法
1.1 實驗動物和試劑 體重200~300 g SD大鼠60 只(南華大學實驗動物部購買),雌雄各半。鼠腦立體定位儀;常用試劑均為國產分析純。
1.2 大鼠腦出血模型制作 大鼠以10%水合氯醛(400 mg/kg)腹腔注射麻醉,固定于鼠腦立體定位儀,參照鼠腦立體定位儀圖譜,確定進針的部位:以前囟為原點,向后1.4 mm,矢狀縫右側旁開3.2 mm,開一約2 mm×2 mm 大小的正方形骨窗,通過微量注射器向下進針5.6 mm,緩慢注入0.20 U/μl的Ⅶ型膠原酶2 μl。神經功能評分采用Bederson 5 分制評分法:無神經功能缺失癥狀0 分;提尾時損傷對側前肢屈曲1 分;前肢屈曲及對側抵抗推力下降2 分;向對側轉圈3 分;向對側轉圈及意識障礙4 分。1~3 分為造模成功大鼠。
1.3 實驗分組與給藥 造模后大鼠隨機分為3 組(每組20 只),腦出血模型組(ICH 組):造模后大鼠正常飼養,自由飲水;GST 組:造模后腹腔注射7.5 g/L 濃度Genistein(劑量50 mg/kg),1 d 一次;DMSO 組:造模后每天腹腔注射相同劑量DMSO 溶液。每組大鼠分別于術后1 d、7 d、14 d 和28 d 4 個時間點進行處理,各時間點隨機選取5 只大鼠。
1.4 組織處理 大鼠用10%水合氯醛腹腔注射麻醉,打開胸腔,充分暴露心臟,經左心室插管至升主動脈,用血管鉗鉗夾腹主動脈,剪開右心耳,經左心室快速灌入生理鹽水100~150 ml 左右,當右心耳流出液變清亮時,再用4%多聚甲約200 ml 灌注固定,然后取腦組織浸泡于4%多聚甲醛溶液中固體過夜后包埋成蠟塊,切片備用。
1.5 GFAP、EGFR 免疫組織化學 免疫組織化學采用SABC 法,對照組用PBS 代替一抗。細胞質內出現棕黃色顆粒為陽性細胞。每張切片隨機選擇5 個不同的視野,用Quantimet570 圖像分析系統Quic 圖像分析軟件進行分析,測定陽性細胞的平均吸光度值(A 值)。
1.6 Western blot 法檢測p-JAK1 及p-STAT3提取各組腦組織總蛋白,10%聚丙烯酰胺凝膠電泳,轉膜,10%脫脂奶粉封閉后,加入一抗、二抗孵育,最后用增強化學發光劑進行底物顯色。使用凝膠成像分析系統進行灰度掃描,以p-JAK1/p-STAT3 與βactin 灰度值的比值進行比較分析。
1.7 統計學分析 采用SPSS13.0 統計軟處理,計量資料用均數±標準差(±s)表示,同一時間點組間及不同時間點組內的比較采用方差分析,P<0.05 為差異有統計學意義。
2 結果
2.1 各組大鼠神經功能評分 3 組大鼠在腦出血術后1 d,神經功能評分無明顯差異(P>0.05);第7、14、28 天,GST 組與ICH 組、DMSO 組比較,差異有統計學意義(P<0.05);DMSO 組與ICH組比較,差異無統計學意義(P>0.05);GST 組的第7、14、28 天與第1 天比較,差異有統計學意義(P<0.05);DMSO 組、ICH 組第7、14 天與第1 天比較,差異無統計學意義(P>0.05);第28 天與第1 天比較,差異有統計學意義(P<0.05,見表1)。
2.2 各組大鼠GFAP、EGFR 表達的比較 腦出血后第1、7,14、28 天均可見GFAP、EGFR 陽性表達,腦出血后第1、7 天,ICH 組、DMSO 組及GST 組GFAP、EGFR 陽性表達無明顯差異(P>0.05),第14、28 天,GST 組GFAP、EGFR 陽性細胞明顯增多,與ICH 組、DMSO 組比較,差異有統計學意義(P<0.05),各時間點DMSO 組陽性細胞表達與ICH 組比較,差異無統計學意義(P>0.05,見表2)。
2.3 各組p-JAK1、p-STAT3 蛋白表達水平比較 腦出血后,大鼠腦內p-JAK1、p-STAT3 表達水平明顯上調,7 d 達高峰(見圖1),14 d 開始下降,28 d仍有少量表達。第7 天GST 組p-JAK1、p-STAT3 水平較ICH 組、DMSO 組明顯下調,差異有統計學意義(P<0.05,見圖2),其余時間點,各組表達差異無統計學意義(P>0.05)。
表1 各組大鼠神經功能評分比較(n=20,±s)
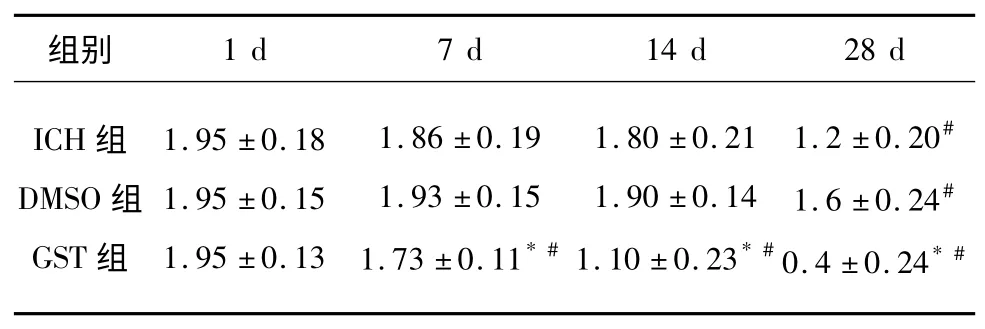
表1 各組大鼠神經功能評分比較(n=20,±s)
與同時間點ICH、DMSO 組比較* P<0.05;與同組1 d 比較#P<0.05
表2 各組大鼠GFAP、EGFR 陽性表達平均吸光度值(A 值)比較(n=20,±s)
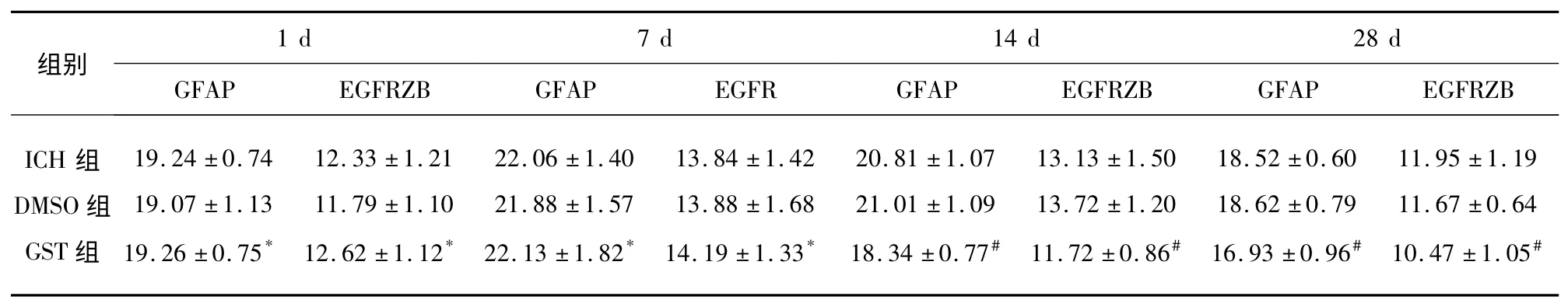
表2 各組大鼠GFAP、EGFR 陽性表達平均吸光度值(A 值)比較(n=20,±s)
與同時間點ICH、DMSO 組比較* P>0.05;與同時間點ICH、DMSO 組比較#P<0.05
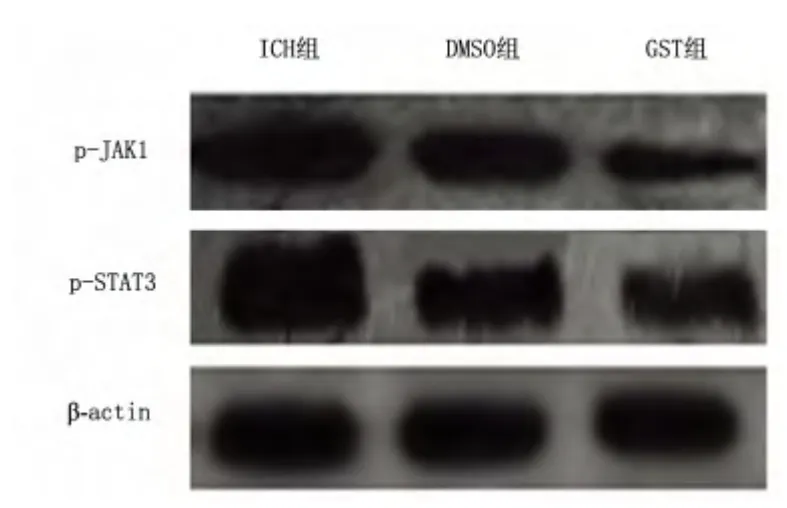
圖1 各組第7 天p-JAK1、p-STAT3 蛋白表達
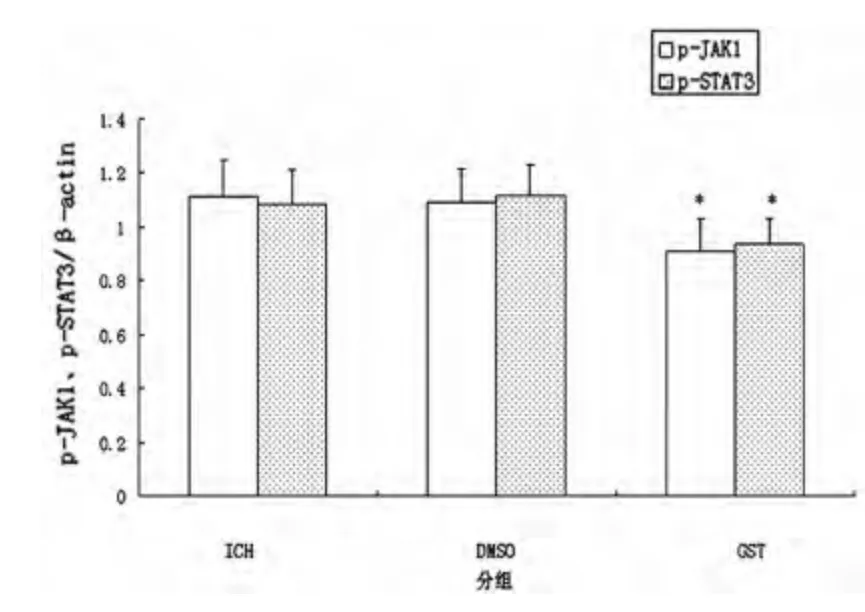
圖2 各組第7 天p-JAK1、p-STAT3 表達
3 討論
在中樞神經系統內,星形膠質細胞對神經元起結構支持作用。正常情況下,中樞神經系統中星形膠質細胞存在靜止態、活化態兩種并存細胞形態,但在病理條件下(出血、梗死、外傷等),大量星形膠質細胞在細胞因子作用下,從靜息狀態快速向活化狀態轉變,星形膠質細胞活化后,其在不同時期對腦損傷起著截然不同的作用,在病變早期,星形膠質細胞活化增殖過程中產生的細胞因子與增殖細胞一起,將損傷區與非損傷區隔離,避免膠質活化瀑布效應造成進一步的損傷[6]。但在星形膠質細胞活化增殖晚期,早期的多種有益功能逐漸消失,反而分泌許多有害因子,形成化學屏障,影響神經再生,同時,星形膠質細胞過度增生形成的膠質瘢痕可形成機械性屏障,阻礙軸突的再生、延長和融合[7],并且膠質瘢痕可以形成微血管套,壓迫微血管,影響局部的血液供應。因此,探討星形膠質細胞的活化機制、功能及調控因素,對于調控腦損傷后星形膠質細胞活化,減少膠質瘢痕的形成,促進腦損傷后神經功能的恢復具有重要的意義。
腦損傷后,星形膠質細胞活化是損傷刺激通過一系列級聯反應,由細胞外通過細胞膜、細胞質傳遞到細胞核,導致細胞周期調控信號通路相關蛋白(如細胞周期蛋白cyclinsD1)等表達增高,從而啟動細胞周期的進程,促使細胞由G1 期向S 期轉化,導致星形膠質細胞不斷增殖活化,到后期形成膠質瘢痕,影響神經功能的恢復[7]。研究表明,大鼠腦缺血后,活化星形膠質細胞中存在EGFR 表達上調,而且隨著時間的遞進其陽性表達值迅速上調,阻斷EGFR 的表達可抑制星形膠質細胞活化,達到保護缺血性腦損傷作用,表明EGFR 可能是腦損傷后促進星型膠質細胞的活化重要因素。本研究發現,腦出血后第7天,腦組織中出現明顯的EGFR 陽性表達星形膠質細胞,第14、28 天仍可見EGFR 陽性表達。同時,實驗還發現,EGFR 陽性表達與GFAP 陽性表達值成正相關性變化,予以GST 阻斷EGFR 表達后,能明顯抑制星形膠質細胞的活化,表明EGFR 參與了腦出血后星形膠質細胞活化進程。
那么EGFR 是通過何種下游信號傳導途徑調控星形膠質細胞增殖活化的呢?目前,EGFR-JAK/STAT 信號轉導途徑與腫瘤細胞的增生關系已經明確,那么,我們是否可借鑒而用于研究其是否與星形膠質細胞增殖有關呢?目前尚無此方面的研究。不過,近來已有許多研究表明JAK 及STAT 家族成員在中樞神經系統的發育和損傷修復過程中存在不同程度的表達[8]。JAK/STAT 信號傳導途徑在中樞神經系統的研究,以往主要集中在神經免疫調節領域,與膠質細胞的關系是最近才為人們所認識,而且主要集中在小膠質細胞,如腦缺血可使小膠質細胞的JAK/STAT 信號傳導途徑活化,在星形膠質細胞活化、增殖中的作用目前不清楚。JAK-STAT 途徑主要是各種細胞因子與受體結合,使其二聚體化,JAK 相互靠近、磷酸化,使受體上的酪氨酸殘基磷酸化,通過STAT 形成二聚體后,STAT 與受體分離,轉位到核內,結合到DNA 序列,從而調控基因表達。目前,已知AS 上有眾多細胞因子(如IL-1、IL-6、EGF、TNF-α等)的靶點,所以,我們推測當這些細胞因子與AS 上的受體結合后,可激活JAK/STAT 信號轉導途徑,而STAT3 在GFAP 啟動子上有結合位點,激活后進入核內與其位點結合,引起酪氨酸的快速磷酸化和AS中STAT-3 的核轉位,從而調節靶基因的表達,導致星形膠質細胞的活化增生[9]。本實驗顯示,腦出血后星形膠質細胞中EGFR 表達上調,p-JAK1、p-STAT3 蛋白表達水平也上調,代表星形膠質細胞的應激性反應的GFAP 表達值也相應上調,表明腦出血后,活化的EGFR 經下游信號JAK1/STAT3 通路,誘導星形膠質細胞過度增殖,從而發揮其對神經功能的損傷作用。在給予EGFR 阻斷劑干預后,GFAP表達值、p-JAK1、p-STAT3 蛋白水平均受到抑制,神經功能恢復,由此提示EGFR-JAK1/STAT3 信號轉導途徑在大鼠腦出血后星形膠質細胞化中發揮重要作用。
[1]Shim YJ,Shin YJ,Jeong SY,et al.Epidermal growth factor receptor is involved in clusterin-induced astrocyte proliferation[J].Neuroreport,2009,20(4):435-439.
[2]Departamento de D,Facultad de M,Pontificia U,et al.Epidermal growth factor receptor(EGFR)and squamous cell carcinoma of the skin:molecular bases for EGFR-targeted therapy[J].Pathol Res Pract,2011,207(6):337-342.
[3]Yang Q,Wang EY,Huang XJ,et al.Blocking epidermal growth factor receptor attenuates reactive astrogliosis through inhibiting cell cycle progression and protects against ischemic brain injury in rats[J].Neurochem,2011,119(3):644-653.
[4]郭志慧,武 衡.星形膠質細胞活化與表皮生長因子受體表達的相關性研究[J].中風與神經疾病雜志,2010,26(8):683-685.
[5]Lin AH,Leung GP,Leung SW,et al.Genistein enhances relaxation of the spontaneously hypertensive rat aorta by transactivation of epidermal growth factor receptor following binding to membrane estrogen receptors-α and activation of a G protein-coupled,endothelial nitric oxide synthase-dependent pathway[J].Pharmacol Res,2011,63(3):181-189.
[6]Milos P,Marcela P.Astrocyte reactivity and reactive astrogliosis:costs and benefits[J].Physiol Rev,2014,94(10):1077-1098.
[7]Yang Q,Wang EY,Huang XJ,et al.Blocking epidermal growth factor receptor attenuates reactive astrogliosis through inhibiting cell cycle progression and protects against ischemic brain injury in rats[J].Neurochem,2011,119(3):644-653.
[8]Liu YD,Holdbrooks AT,Patrizia DS,et al.Therapeutic efficacy of suppressing the JAK/STAT pathway in multiple models of experimental autoimmune encephalomyelitis[J].J Immunol,2014,192(1):59-72.
[9]Lucile BH,Ceyzeriat K,Carrillo-de Sauvage MA,et al.The JAK/STAT3 pathway is a common inducer of astrocyte reactivity in Alzheimer’s and Huntington’s diseases[J].J Neurosci,2015,35(2):2817-2829.

