新生大鼠胰腺干細胞的分離和培養及初步鑒定
張巨彪,蘇秀蘭,歐陽曉暉※
(1.內蒙古自治區人民醫院腫瘤外科,呼和浩特 010010; 2.內蒙古醫科大學中心實驗室,呼和浩特 010010)
?
新生大鼠胰腺干細胞的分離和培養及初步鑒定
張巨彪1,蘇秀蘭2,歐陽曉暉1※
(1.內蒙古自治區人民醫院腫瘤外科,呼和浩特 010010; 2.內蒙古醫科大學中心實驗室,呼和浩特 010010)
摘要:目的探討分離、培養及初步鑒定新生大鼠胰腺干細胞的方法。方法取30只無特定病原體(SPF)級新生大鼠的胰腺組織,用完整胰腺膠原酶消化法分離胰島。以低糖改良Eagel培養液為基礎培養液,于不同時期分別添加血清、堿性成纖維細胞生長因子、表皮細胞生長因子、胰島素-轉鐵蛋白-硒添加劑、白血病抑制因子、神經干細胞原代培養的無血清培養液中的營養因子B27、神經元培養的無血清培養液中的營養因子N2等進行培養,倒置相差顯微鏡下觀察其形態學特征及生長特性。應用免疫細胞化學法對培養不同時期的細胞進行巢蛋白(Nestin)及細胞角質蛋白19(CK-19)檢測,并進行初步鑒定。結果①新生大鼠胰腺內纖維組織少,體積小,完整胰腺膠原酶消化法簡化了胰島分離步驟,減少了污染機會,有利于進一步培養。②培養24 h可見細胞貼壁,但貼壁細胞數量較少,改用無血清培養后,貼壁細胞快速生長,10~15 d形成單層細胞匯集,細胞形態較一致。③培養所得細胞一直較多表達胰腺干細胞的標志物Nestin,隨培養時間延長,表達CK-19的細胞數量逐漸增多。結論新生大鼠胰腺消化后,獲得的細胞于不同時期表達胰腺干細胞的標志物Nestin、CK-19。
關鍵詞:胰腺干細胞;移植;細胞分離;細胞培養;大鼠
干細胞是體內存在的特殊細胞,既有自我更新和不斷增生的能力,又有多向分化的潛能,這種特點使其成為獲得大量胰島β細胞的最佳種子細胞,只要掌握了胰腺干細胞的特異標志、轉化調控機制、培養及分離技術就可以體外操縱干細胞,大量擴增和定向誘導分化,最后得到胰島樣細胞[1-2]。
盡管胰腺干細胞的研究及移植已有成功的報道,但是胰腺干細胞的分離、培養、鑒定與誘導為靶細胞的研究,乃至用于治療糖尿病的研究仍然存在一些問題,尚未能用于臨床,因此需要進一步深入研究。本實驗對新生大鼠胰腺組織中胰腺干細胞的分離、培養和初步鑒定等方面進行研究,目的是建立一套比較有效的技術和方法,進而獲得單一性和富集度均較高的胰腺干細胞。
1材料與方法
1.1材料30只新生無特定病原體(specific pathogen free,SPF)大鼠(2~4 d)購自內蒙古大學實驗動物中心,體質量220~280 g,飼養室內氨濃度<20 g/L,相對濕度為40%~70%,室溫18~25 ℃,普通飼料喂養,飼水自由,實驗前1 h領取。
1.2方法
1.2.1含血清培養液的制備取改良型Eagel培養液,加10%胎牛血清,100 U/mL青霉素、100 μg/mL鏈霉素,加β-巰基乙醇終濃度為 71.5 μmol/L,丙酮酸鈉終濃度1 mmol/L,HEPES終濃度為 1 mmol/L,加入多鳥氨酸終濃度為10 μg/mL,牛纖維連接蛋白終濃度為2 μg/mL,刀豆素A終濃度為 1 μg/mL,過濾除菌,4 ℃冰箱保存。
1.2.2無血清培養液的制備取改良型Eagel培養液,加100 U/mL青霉素、100 μg/mL 鏈霉素,羥乙基哌嗪乙磺酸終濃度為1 mmol/L,堿性成纖維細胞生長因子、表皮細胞生長因子各 20 ng/mL,1400 U/mL白細胞抑制因子,2%神經細胞原代培養的無血清培養液中的營養因子B27、1%神經元培養的無血清培養液中的營養因子N2添加劑,過濾除菌,4 ℃冰箱保存。
6 d后(大約換液3次),用不含堿性成纖維細胞生長因子的無血清培養液進行培養。
1.2.3新生大鼠胰腺干細胞的體外分離和培養無菌條件下完全游離胰腺后取出,放入4 ℃ D-Hank′s(無鈣鎂離子的Hank′s液)液中,再放入50 mL的消化瓶中,加入膠原酶6 mL,封瓶后放入37 ℃恒溫水浴中消化12 min,立即加入4 ℃ D-Hank′s液40 mL中,用吸管反復吹打至胰腺團塊消失,自然沉降,棄去上清液,反復吹打3次,收集沉降的消化物。取D-Hank′s液稀釋后的胰島制備物3 mL,加入配制好的雙硫腙液5 μL,混勻后靜置3 min,倒置相差顯微鏡下觀察。培養瓶中加入5 mL含血清培養液。為初步鑒定細胞,培養板的3個孔中預先放入無菌處理后的蓋玻片,每孔加入1 mL含血清培養液。培養瓶與培養板均過夜后使用。將分離好的胰島制備物加入配制好的8 mL含血清培養液,充分吹打均勻,于培養板的3個孔中每孔加入1 mL,使每孔中共含培養液2 mL,將剩余的制備物平均放入兩個25 cm2細胞培養瓶中,置入37 ℃、5%CO2培養箱中培養。
72 h后可見有細胞貼壁生長,但胰島細胞不貼壁,棄去不貼壁細胞及胰島,換用無血清培養液培養,每48小時換液1次,3次后,換用不含堿性成纖維細胞生長因子的無血清培養液繼續培養,倒置顯微鏡下觀察細胞生長情況,可見貼壁細胞呈較快速度生長,10~15 d可形成單層細胞匯合。
10~15 d后,細胞約長滿培養瓶70%進行傳代,用 0.05%胰酶消化5 min,吹打均勻后接種在含血清培養液中,重復前述培養。
1.3免疫細胞化學染色細胞培養同前,于培養的第4、8、12日取出細胞培養板中的蓋玻片,行免疫細胞化學染色進行初步鑒定。將培養液棄去,磷酸鹽緩沖液洗滌3次,以4%多聚甲醛37 ℃固定20 min,磷酸鹽緩沖液(phosphate buffered saline,PBS)洗滌3次,加50 μL過氧化物酶阻斷液,室溫孵育10 min,PBS洗滌3次,加50 μL正常動物非免疫血清,室溫孵育5 min,PBS洗滌3次,Nestin加入50 μL 1∶100稀釋的Nestin,細胞角質蛋白19(cyto-keratoprotein-19,CK-19)的檢測加入50 μL 1∶100稀釋的CK-19,室溫孵育90 min,PBS洗滌3次,加入即用型、生物素標記的廣譜型二抗,室溫孵育10 min,PBS洗滌3次,加入50 μL鏈霉菌抗生物素-過氧化物酶溶液,室溫下孵育 10 min,PBS洗滌3次,加入新配制的100 μL過氧化物酶反應底物3,3′-二氨基聯苯胺,室溫下10 min,鏡下觀察,PBS洗滌,中止反應,以上PBS洗滌每次5 min,蘇木素復染細胞核1 min,流水沖洗,1%鹽酸酒精分化3 s,自來水沖洗5 min,浸水,藍化,空白對照使用 PBS替代一抗,其余條件相同,結果觀察:陽性為細胞胞質染成棕黃色;陰性為胞質不著色。細胞計數法:在倒置相差顯微鏡下放大100倍觀察,計數四角大方格中的細胞。
2結果
2.1新生大鼠胰腺干細胞的體外分離和培養結果
2.1.1新生大鼠胰腺干細胞的體外分離結果新生大鼠完整胰腺經膠原酶消化后,可見胰腺組織散落呈細顆粒狀,終止消化后,反復吹打,組織完全散開,肉眼見大塊組織消失,呈均勻一致的細顆粒樣懸液,經3次沉降后即可獲得胰島制備物。倒置相差顯微鏡下可見大量細胞團及散在的細胞,雙硫腙染色后可見亮紅色的胰島細胞(圖1,見封三)。
2.1.2新生大鼠胰腺干細胞的體外培養結果培養72 h可見細胞貼壁,但貼壁細胞形態不一,數量較少,改用無血清培養48 h后,貼壁細胞數量增加,混有少量成纖維細胞,約達培養板面積的5%(圖2,見封三)。此時棄去不貼壁細胞,貼壁細胞生長速度加快,換用不含堿性成纖維細胞生長因子的無血清培養液后,成纖維細胞數量逐漸減少,可見貼壁細胞呈較快速度生長,10~15 d可形成單層細胞匯合(圖3,見封三)。
2.1.3新生大鼠胰腺干細胞傳代培養結果本實驗中,胰腺干細胞最多可傳至第3代,之后,細胞分裂開始停滯,活力逐漸降低,最終碎裂、死亡。
2.2新生大鼠胰腺干細胞的免疫細胞化學染色結果培養的第4、8、12日取出細胞培養板中的蓋玻片,行免疫細胞化學染色檢測Nestin與CK-19,其中CK-19與Nestin的抗體濃度均為1∶100。在培養第4日可見一些多角形上皮樣細胞,單核,呈附壁生長,Nestin表達陽性,胞質染成棕黃色(圖4,見封三),成纖維細胞樣生長的細胞散在分布,形態不規則,多為長梭形,Nestin與CK-19染色均呈陰性反應。第8日后可見培養細胞中仍多數表達Nestin(圖5,見封三),表達CK-19的陽性細胞比例開始增加(圖6,見封三),胞質染成棕黃色,空白對照陰性。第12日時,大多數培養細胞表達CK-19(圖7,見封三)與Nestin,成纖維細胞樣逐漸減少,空白對照仍為陰性。
3討論
研究顯示,胰腺導管上皮細胞體外培養可獲得胰島細胞,并能使糖尿病動物模型血糖恢復正常;胰腺內也存在Nestin陽性細胞,體外分離和培養后可形成胰島樣結構[3-4]。新生大鼠胰腺內纖維組織少,采用完整胰腺消化,組織消化完全,對胰島損傷較小,可獲得完好的胰島,滿足進一步實驗的要求,省略了胰腺組織剪碎的過程,減少了組織污染機會,有利于組織培養[5]。
血清中含有豐富的營養成分,對細胞有去分化作用,影響細胞功能,血清還可促進成纖維細胞生長,造成優勢效應而抑制上皮細胞的生長。本研究先用含血清培養液,使胰腺細胞盡快貼壁,貼壁后改為含多種生長因子的無血清培養液,換液3次后,改用不含堿性成纖維細胞生長因子的無血清培養液,達到控制成纖維細胞繁殖、促進胰腺干細胞生長的目的。
研究認為,胰腺干細胞體外擴增、培養時均呈貼壁生長,形態為多角形上皮樣[6]。本實驗結果與之類似,新生大鼠胰腺干細胞體外培養時,呈克隆性生長,貼璧時,呈多角形上皮樣,核為圓形,單、雙或多核仁。胰腺干細胞特異性標志物還沒有最終完全確定,目前較為公認的特異性標志物有以下幾種[7-8]:Nestin、CK-19、胰腸同源域因子1、神經原因子3、波形蛋白等。
本研究為確定新生大鼠胰腺干細胞的表達特征,參照多種研究結果,在免疫細胞染色實驗中選用Nestin和CK-19標志物的抗體對胰腺干細胞抗原進行了檢測。結果顯示,隨著培養時間延長,共表達Nestin與CK-19的細胞數量逐漸增多。
參考文獻
[1]Wang W,Walker JR,Wang X,etal.Identification of small-molecule inducers of pancreatic beta-cell expansion[J].Proc Nati Acad Sci U S A,2009,106(5):1427-1432.
[2]Suen PM,Leung PS.Pancreatic stem cells:a glimmer of hope for diabetes?[J].JOP,2005,6(5):422-424.
[3]Yatoh S,Dodge R,Akashi T,etal.Differentiation of affinity-purified human pancreatic duct cells to β-cells[J].Diabetes,2007,56(7):1802-1809.
[4]史愷,徐立,鄧儀昊.昆明小鼠胰腺導管上皮樣細胞的培養方法研究[J].四川解剖學雜志,2006,14(4):72-73.
[5]白日星,田井琦,張海燕.新生鼠胰島干細胞分離、培養和分化的實驗研究[J].中國普通外科雜志,2004,13(10):746-749.
[6]Kajiyama H,Hamazaki TS,Tokuhara M,etal.Pdx1-transfected adipose tissue-derived stem cells differentiate into insulin-producing cells in vivo and reduce hyperglycemia in diabetic mice[J].Int J Dev Biol,2010,54(4):699-705.
[7]Claiborne KC,Stoffers DA.Toward a cell-based cure for diabetes:advances in production and transplant of beta cells[J].Mt Sinai J Med,2008,75(4):362-371.
[8]Gioviale MC,Bellavia M,Damiano G,etal.Beyond islet transplantation in diabetes cell therapy:form embrymic stem cells to transdifferentiation of adult cells[J].Transplant Proc,2013,45(5):2019-2024.
張巨彪,蘇秀蘭,歐陽曉暉
新生大鼠胰腺干細胞的分離和培養及初步鑒定
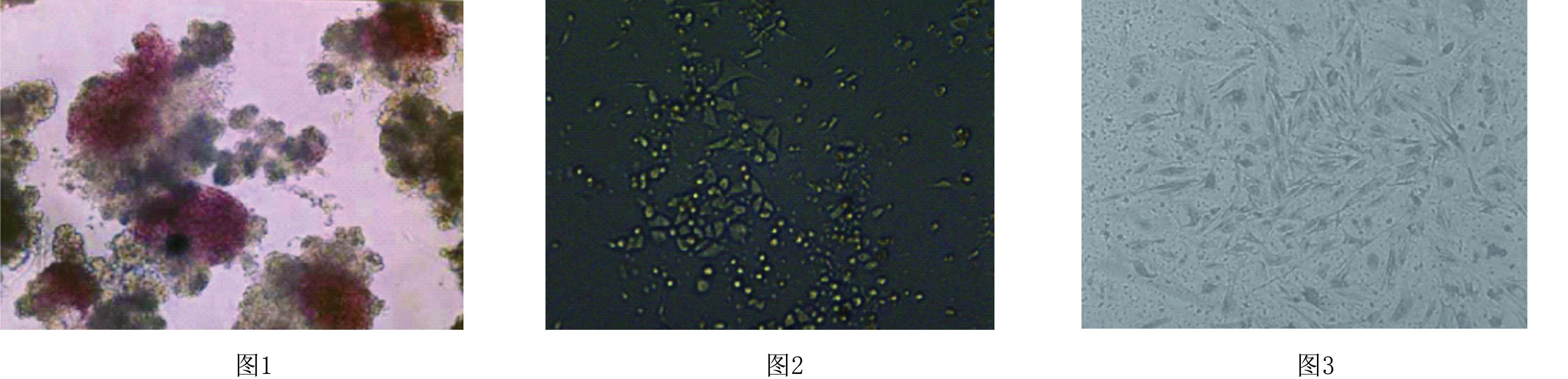

圖1新生大鼠胰島細胞分離后在倒置顯微鏡下被染成紅色(雙流腙×100)
圖2新生大鼠胰島細胞分離后培養72 h后在倒置相差顯微鏡下形成的貼壁細胞(雙流腙染色×100)
圖3新生大鼠胰島細胞分離后培養10 d后在倒置相差顯微鏡下形成的貼壁細胞(雙流腙染色×40)
圖4培養4 d后的貼壁細胞在倒置相差顯微鏡下Nestin呈陽性(免疫細胞化學染色×100)
圖5培養8 d后的貼壁細胞在倒置相差顯微鏡下Nestin呈陽性(免疫細胞化學染色×100)
圖6培養8 d后的貼壁細胞在倒置相差顯微鏡下CK-19呈陽性(免疫細胞化學染色×100)
圖7培養12 d后的貼壁細胞在倒置相差顯微鏡下CK-19呈陽性(免疫細胞化學染色×40)
Isolation,Cultivation and Identification of Pancreatic Stem Cells from Newborn RatsZHANGJu-biao1,SUXiu-lan2,OUYANGXiao-hui1. (1.DepartmentofSurgicalOncology,InnerMongoliaPeople′sHospital,Hohhot010010,China; 2.CentralLoaboratory,InnerMongoliaMedicalUniversity,Hohhot010010,China)
Abstract:ObjectiveTo explore the method of isolation,cultivation and identification of pancreatic stem cells in newborn rats.MethodsA total of 30 newborn rats were bought from Experimental Animal Center,Inner Mongolia University.Get the rats 1 h before experiments.The whole pancreas of newborn rats were digested with collagenase,and cultivated with the basic Eagel culture solution modified with low.Serum,bFGF,EGF,ITS,LIF,N2,B27 were added to culture solution during different phases,the digested tissue fragments were cultured.The whole formation process of new pancreatic stem cells was observed under the inverted phase contrast microscope.The expression of Nestin and CK-19 was tested using immunocytochemical method.Results①Because there was little fibrous tissue in newborn rat,its pancreas and the volume of pancreas were tiny,the opportunity of contamination was greatly reduced,so as to make further experiments.②After 24 hours,some cells adhered to the surface of the culture plates,but the number of them was small,then we removed the liquid, and added medium of free serum,the number of them increased obviously,10-15 days later,a newly formed monolayer of cells could be observed, their shapes were uniform.③During the cultivation period,the cells came from the pancreas of newborn rats expressed large amount of Nestin,and as the cultivation time prolonged,the expression of CK-19 increased.ConclusionAfter digestion of newborn rat′s pancreas, the cells express Nestin and CK-19, which are the markers of the expression of pancreatic stem cells,during different periods.
Key words:Pancreatic stem cells; Transplant; Cells isolation; Cells cultivation; Rat
收稿日期:2013-07-29修回日期:2014-10-31編輯:伊姍
doi:10.3969/j.issn.1006-2084.2015.02.047
中圖分類號:R617
文獻標識碼:A
文章編號:1006-2084(2015)02-0315-02

