三種肉桂酰胺衍生物的制備及其與人血清白蛋白的結合
杜傳榮,逯東偉,石 康,陳丹丹,林翠梧,3*
(1.廣西大學化學化工學院,廣西南寧 530004; 2.廣西桂林電子科技大學信息與通信學院,廣西桂林 541000; 3.廣西高校應用化學技術與資源開發重點實驗室,廣西南寧 530004)
三種肉桂酰胺衍生物的制備及其與人血清白蛋白的結合
杜傳榮1,逯東偉1,石 康2,陳丹丹1,林翠梧1,3*
(1.廣西大學化學化工學院,廣西南寧 530004; 2.廣西桂林電子科技大學信息與通信學院,廣西桂林 541000; 3.廣西高校應用化學技術與資源開發重點實驗室,廣西南寧 530004)
基于臨床上肉桂酰胺類藥物的廣泛應用及優異性能,以間羥基肉桂酸為母體,分別與不同氨基酸反應,設計合成了3種未見報道的肉桂酰胺類衍生物,并用MS、IR、1H NMR、13C NMR進行結構表征。采用分子對接技術和熒光光譜法、同步熒光光譜法、紫外-可見光譜法共同研究了3種衍生物分別和人血清白蛋白(HSA)相結合的機理。AutoDock對接顯示,這3種衍生物結合在HSA亞結構域ⅡA(即siteⅠ)的疏水腔內,維系衍生物與HSA的主要作用力為氫鍵和范德華力,同時還存在著疏水作用。光譜實驗結果表明,在體外生理條件下,衍生物都與HSA形成復合物,對HSA內源熒光產生靜態猝滅,且對其構象產生影響。根據不同溫度下的熱力學函數,確定主要作用力均是氫鍵和范德華力。分子對接與實驗獲得了一致的結果。
肉桂酰胺衍生物;光譜法;分子模擬;人血清白蛋白(HSA)
1 引 言
藥物被吸收進入人體后,大多數會先與血漿蛋白結合,繼而被轉運到受體部位發揮作用。人血清白蛋白(HSA)是血漿中含量最多的蛋白,具有保持血液正常滲透壓的功能,可以結合、運輸脂肪酸、氨基酸以及許多藥物小分子等內源和外源性化合物分子,在生命活動中起著非常重要的作用。且其結構已被探知,故常被作為探討藥物與蛋白相互作用機理的最佳模型[1-5]。藥物小分子與HSA的結合,極大地影響其在人體內的吸收、分布和代謝情況。因此,研究小分子與HSA間的結合作用,不但可以幫助人們深入分子水平了解其作用機理,而且對闡明藥物在體內的代謝動力學具有極其重要意義,也為設計及研發新型高活性且毒副作用小的藥物提供有價值的參考及理論指導[5-6]。
臨床上,肉桂酰胺類化合物作為藥物的應用歷史久遠。國內外對其生物活性的研究主要集中于抗驚厥、擴張血管、抗誘變、抗腫瘤、殺蟲以及消炎等方面,并取得了顯著成果[7-14]。基于此,本文以間羥基肉桂酸為起始原料,分別與β-丙氨酸、γ-氨基丁酸、6-氨基己酸反應,設計合成了3種未見文獻報道的肉桂酰胺類衍生物,以期得到有更強生物活性且毒副作用小的藥物。在模擬生理條件下,采用Autodock分子對接結合熒光光譜法、UVVis光譜法研究了這3種肉桂酰胺類衍生物分別與HSA的結合特性。分別確定了其對HSA熒光猝滅的機理、結合常數和結合位點數,并探討了其對人血清白蛋白構象的影響,實驗與分子對接獲得了一致的結果。本研究為深入闡明這3種肉桂酰胺類衍生物在體內的作用機理、運輸及代謝情況提供了確切的實驗依據和理論參考。
2 實 驗
2.1 儀器與試劑
儀器:Agilent Cary Eclipse Fluorescence Spectrophotometer熒光分光光度計(帶恒溫裝置,美國Agilent Technologies),Agilent Cary 60 UV-Vis紫外-可見分光光度計(帶恒溫裝置,美國Agilent Technologies),Shimadzu LCMS-8040液質聯用儀(日本Shimadzu),Boetius顯微熔點測定儀(德國Boetius),Bruker Tensor 27紅外光譜儀(德國Bruker),Bruker Avance-600 NMR Spectrometer核磁共振儀(600 MHz,德國Bruker),Milli-Q Advantage A10(美國Millipore)
試劑:間羥基肉桂酸(珠海嘉信康醫藥科技有限公司,HPLC≥95%),人血清白蛋白(HSA, 99%,美國Sigma),pH 7.4 PBS緩沖液(粉劑,美國Sigma),其余試劑均為國產分析純,實驗用水為Milli-Q超純水。
2.2 衍生物Ⅰ~Ⅲ的合成及表征
衍生物Ⅰ~Ⅲ的合成路線如圖1所示。
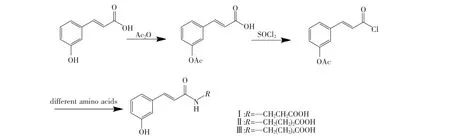
圖1 衍生物Ⅰ~Ⅲ的合成路線Fig.1 Synthetic route ofthe derivatives
2.2.1 中間體間乙酰基肉桂酸的制備
間羥基肉桂酸50 mmol,乙酸酐50 mL,吡啶3 mL,80℃反應12 h。將反應液傾入冰水中,并劇烈攪拌,生成大量白色沉淀,靜置過夜,抽濾,濾餅用水洗至洗液為中性,干燥,直接用于下一步反應。
2.2.2 中間體間乙酰基肉桂酰氯的制備
間乙酰基肉桂酸20 mmol,SOCl215 mL,油浴80℃加熱回流反應5 h,減壓旋蒸除去溶劑即得粗產物,直接用于下一步反應。
2.2.3 衍生物Ⅰ~Ⅲ的制備
將40 mmol β-丙氨酸(γ-氨基丁酸/6-氨基己酸)溶于20 mL NaOH(2 mol·L-1)溶液,滴入間乙酰基肉桂酰氯(3 mL THF溶解),10~15℃反應3 h,用HCl溶液調節pH為4~5,有白色固體析出,過濾,甲醇重結晶,分別得到目標衍生物Ⅰ、Ⅱ、Ⅲ。
2.2.4 衍生物Ⅰ~Ⅲ的結構表征波譜數據
(E)-3-[3'-(3″-羥基苯基)丙烯酰胺基]丙酸(衍生物Ⅰ):白色粉末狀固體。收率:88.5%。m.p.:164~165℃。ESI-MS(m/z):234.2[M--1]。IR(KBr)vmax(cm-1):3 571.3,3 483.6(—OH(COOH)),3 357.9(—NH—),1 702.5, 1 657.5(—C==O—),1 647.9(—C==C—), 1 594.7,1451.3(Ar),1270.3(—CO—(ArOH)),874.0,799.6,691.6(γArH)。1H NMR (600 MHz,DMSO-d6)δ:12.21(1 H,s,—COOH), 9.61(1 H,s,—OH),8.19(1 H,t,J=6.6 Hz,—CO—NH—),7.32(1 H,d,J=15.8 Hz,H-3', 7.19(1 H,t,J=7.8 Hz,H-5″),6.97(1 H,d, J=7.8 Hz,H-6″),6.92(1 H,s,H-2'),6.78 (1 H,d,J=7.8 Hz,H-4″),6.56(1 H,d,J= 15.8 Hz,H-2'),3.37(2 H,q,J=6.6 Hz, H-3),2.45(2 H,t,J=6.6 Hz,H-2)。13C NMR (151 MHz,DMSO-d6,TMS)δ:173.4(—COOH), 165.5(—CO—NH—),158.2(C-3″),139.3 (C-3'),136.6(C-1″),130.4(C-5″),122.3 (C-6″),119.2(C-2'),117.1(C-2″),114.2 (C-4″),35.5(C-3),34.4(C-2)。
(E)-4-[3'-(3″-羥基苯基)丙烯酰胺基]丁酸(衍生物Ⅱ):白色粉末狀固體。收率:90.2%。m.p.:150~151℃,ESI-MS(m/z):248.3[M--1];IR(KBr)vmax(cm-1):3 518.3,3 458.9(—OH (COOH)),3354.6(—NH—),1 720.2,1 694.3 (—C==O—),1 650.1(—C==C—),1 592.4, 1 457.8(Ar),1285.7(—CO—(ArOH)),891.9, 789.5,682.9(γArH)。1H NMR(600 MHz,DMSO-d6)δ:12.08(1 H,s,—COOH),9.59(1 H,s,—OH),8.13(1 H,t,J=6.0 Hz,—CO—NH—), 7.31(1 H,d,J=15.6 Hz,H-3'),7.19(1 H,t, J=7.8 Hz,H-5″),6.97(1 H,d,J=7.8 Hz, H-6″),6.92(1 H,s,H-2″),6.77(1 H,dd,J1= 7.8 Hz,J2=1.8 Hz,H-4″),6.53(1 H,d,J= 15.6 Hz,H-2'),3.19(2 H,q,J=6.0 Hz,H-4),2.26(2 H,t,J=7.2 Hz,H-2),1.67(2 H, m,H-3)。13C NMR(151 MHz,DMSO-d6,TMS)δ: 174.7(—COOH),165.4(—CO—NH—),158.1 (C-3″),139.2(C-3'),136.6(C-1″),130.4 (C-5″),122.4(C-6″),119.1(C-2'),117.1 (C-2″),114.1(C-4″),38.6(C-4),31.6(C-2),25.1(C-3)。
(E)-6-[3'-(3″-羥基苯基)丙烯酰胺基]己酸(衍生物Ⅲ):白色粉末狀固體。收率:95.1%。m.p.:170~171℃。ESI-MS(m/z):276.3[M--1]。IR(KBr)vmax(cm-1):3 571.2(—OH(COOH)), 3 349.3(—NH—),1 722.2,1 696.4(—C== O—),1 651.9(—C==C—),1 591.6,1 449.8 (ArH),874.9,784.9,679.1(γArH),1 237.1(—CO—(ArOH))。1H NMR(600 MHz,DMSO-d6)δ:8.22 (1 H,t,J=6.0 Hz,—CO—NH—),7.29(1 H,d, J=15.6 Hz,H-3'),7.18(1 H,t,J=7.8 Hz,H-5″),6.95(1 H,d,J=7.8 Hz,H-6″),6.94(1 H, s,H-2″),6.78(1 H,dd,J1=7.8 Hz,J2=1.8 Hz,H-4″),6.56(1 H,d,J=15.6 Hz,H-2'), 3.14(2 H,q,J=6.0 Hz,H-6),2.18(2 H,t,J= 7.2 Hz,H-2),1.41~1.52(4 H,m,H-3&5), 1.26~1.30(2 H,m,H-4)。13C NMR(151 MHz, DMSO-d6,TMS)δ:174.9(—COOH),165.1(—CO—NH—),157.9(C-3″),138.7(C-3'),136.3 (C-1″),130.0(C-5″),122.2(C-6″),118.8(C-2'),116.8(C-2″),113.8(C-4″),38.7(C-6), 34.0(C-2),29.0(C-5),26.2(C-4),24.5 (C-3)。
2.3 分子模擬
ACD/Labs(version12.00)構建衍生物Ⅰ、Ⅱ、Ⅲ的三維結構mol文件,通過Open Bable(version2.3.2)MM94力場進行結構優化。HSA-warfarin復合物晶體結構來自Protein Data Bank數據庫(http://www.rcsb.org/pdb,PDB編碼:1H9Z)。對接前除去HSA-warfarin復合物中包含的配體及水分子,繼而對其加氫,添加偏電荷及調整質子化狀態。通過AutoDock 4.2建立衍生物Ⅰ、Ⅱ、Ⅲ分別與HSA的相互作用模型,將其對接到HSA的活性口袋,進行計算。運用拉馬克遺傳算法(LGA)預測衍生物與HSA結合時可能存在的構象。對接過程中,所有對接參數采用缺省值,考慮了衍生物的10個構象。最終得到10種對接模型,結合能最負的為最佳。進一步通過LigPlot+軟件[15-16]分析最佳構象時衍生物與HSA之間的結合模式。
2.4 光譜測定
儲備液的配制:以pH 7.4 PBS緩沖液為溶劑,分別配制1.0×10-4mol·L-1人血清白蛋白,1.0×10-3mol·L-1不同衍生物的儲備液,4℃下保存備用。
掃描溶液的配制:于10支10 mL比色管中依次準確加入1.0 mL人血清白蛋白溶液,再依次加入不同量衍生物儲備液,定容。分別在298,303, 308 K下恒溫靜置30 min。
設置激發波長為280 nm,激發、發射狹縫寬度分別為5 nm、2.5 nm,快速掃描不同濃度衍生物-HSA體系熒光發射光譜(波長范圍300~500 nm)。同時掃描同步熒光光譜(Δλ=15 nm和Δλ=60 nm)。
以PBS緩沖液為參比,分別測定298,303, 308 K時不同濃度衍生物-HSA體系300~500 nm的吸收光譜。
3 結果與討論
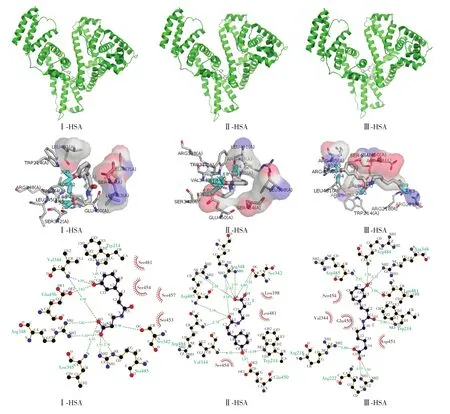
圖2 不同衍生物-HSA體系的分子對接圖Fig.2 Molecular docking mode of different derivative-HSA systems
3.1 分子模擬研究衍生物與HSA的相互作用
蛋白質的晶體結構研究[17-18]表明,HSA分子三維晶體結構呈心形,有3個同源結構域:Ⅰ(1~195氨基酸殘基)、Ⅱ(196~383氨基酸殘基)、Ⅲ(384~585氨基酸殘基)。每個域包含A和B兩個子域,每個子域又分為不同的亞域,分別為ⅠA、ⅠB、ⅡA、ⅡB、ⅢA、ⅢB。它們分別以槽口相對的方式形成圓筒狀結構,幾乎所有的疏水性氨基酸均包圍在圓筒內部,構成疏水腔。大多數藥物分子與HSA相互作用于亞結構域ⅡA、ⅢA形成的疏水腔中,即siteⅠ、siteⅡ。對接結果的最佳構象及衍生物與HSA的結合模式見圖2。
圖2清晰地展示了衍生物與HSA相互作用的結合位域及相互作用力。可以看出,衍生物與HSA相互作用時均主要位于ⅡA的鍵合口袋中。衍生物Ⅰ結構中的酚羥基的氧原子與周圍殘基Trp214、Val344、Glu450形成氫鍵,羧基的氧原子與周圍殘基Ser324、Leu345、Arg348、Arg485形成氫鍵,周圍還存在疏水性殘基Leu453、Ser454、Leu457、Leu481。衍生物Ⅱ結構中的酚羥基的氧原子與周圍殘基Trp214、Val344、Glu450形成氫鍵,酰胺鍵的氧原子與周圍殘基Arg348、Arg484、Arg485形成氫鍵,羧基的氧原子與周圍殘基Ser324、Arg348、Arg485形成氫鍵,周圍還存在著疏水性殘基Leu198、Ser454、Leu481。衍生物Ⅲ結構中的酚羥基的氧原子與周圍殘基Arg348、Arg484、Arg485、Leu481形成氫鍵,酰胺鍵的氧原子與周圍殘基Trp214形成氫鍵,羧基的氧原子與周圍殘基Arg218、Arg222形成氫鍵,周圍還存在著疏水性殘基Val344、Glu450、Asp451、Ser454。可見,不同衍生物的引入改變了Trp214殘基周圍微環境的疏水性,從而對HSA的熒光發射光譜產生影響,并產生猝滅效應。它們之間的相互作用力都主要是氫鍵和范德華力,同時還存在著疏水作用。對接計算得到298 K時衍生物Ⅰ-HSA體系的ΔG=-26.37 kJ·mol-1;化合物Ⅱ-HSA體系的ΔG=-31.14 kJ·mol-1,化合物Ⅲ-HSA體系的ΔG=-22.14 kJ·mol-1,說明衍生物Ⅰ(Ⅱ/Ⅲ)與HSA的結合都是自發進行的。分子對接形象地展現了衍生物與HSA的結合模式,分析了衍生物與HSA相互作用的結合位域和作用力,為實驗提供了可靠的理論信息。理論結果和實驗結果存在略微差異,這種差異可能是由于分子對接時HSA是以晶體形態與衍生物結合,而實驗時HSA是在溶液中與衍生物發生作用的[5]。
3.2 衍生物與HSA相互作用的熒光發射光譜
當激發波長為280 nm時,HSA在350 nm附近出現最大熒光發射峰。衍生物Ⅰ、Ⅱ、Ⅲ在此測試條件下并無熒光發射,不會對實驗產生干擾。但衍生物Ⅰ、Ⅱ、Ⅲ在λex、λem處均有一定吸收,其猝滅行為中包含“內濾光效應”,需根據公式(1)予以校正[19-20]。
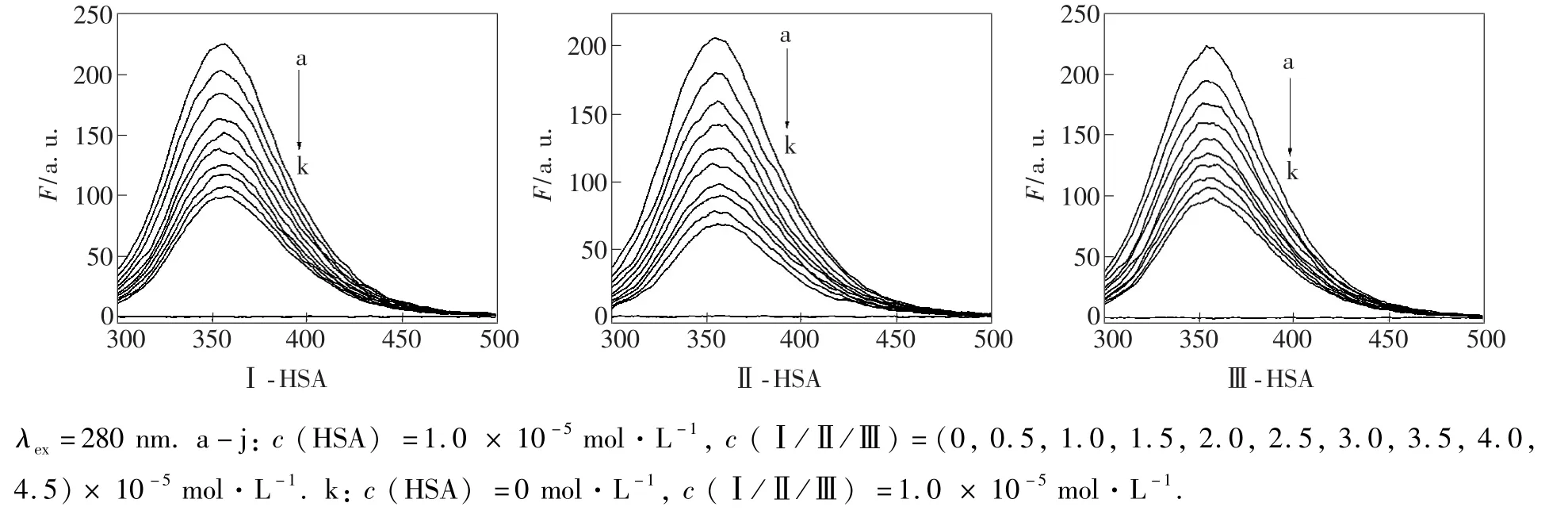
圖3 不同衍生物-HSA體系的熒光猝滅光譜Fig.3 Fluorescence quenching spectra of different derivative-HSA systems
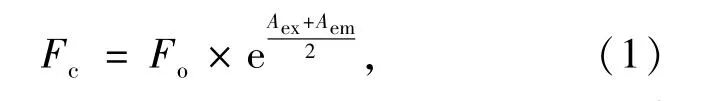
Fo和Fc分別表示測試和校正后的熒光發射峰強度,Aex、Aem分別是溶液在λex、λem處的吸收值。
圖3是衍生物Ⅰ、Ⅱ、Ⅲ分別與HSA相互作用的熒光猝滅光譜。由圖可知,HSA的最大熒光發射峰為355 nm,隨著體系中衍生物濃度的增加,HSA內源性熒光發生不同程度的猝滅,但峰形保持不變,而最大熒光發射峰有輕微紅移(Ⅰ-HSA:由355 nm移動至358 nm;Ⅱ-HSA:由355 nm移動至360 nm;Ⅲ-HSA:由355 nm移動至357 nm)。這表明衍生物Ⅰ、Ⅱ、Ⅲ均與HSA發生結合,使得色氨酸殘基(Trp)周圍環境極性變大,疏水性變小,從而導致HSA空間構象發生改變[21]。
3.3 衍生物與HSA相互作用的猝滅機理
熒光猝滅機理通常分為靜態猝滅和動態猝滅兩種。靜態猝滅是指熒光分子和猝滅劑之間通過結合作用,形成不發光的復合物而產生熒光猝滅;動態猝滅則僅僅是熒光物質的激發態分子和猝滅劑分子間通過碰撞作用,使其熒光猝滅,其作用過程符合Stern-Volmer方程[22]:
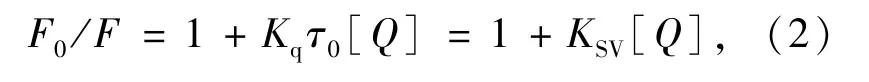
式中F0、F分別表示存在和不存在猝滅劑時的熒光強度,KSV表示Stern-Volmer猝滅常數,Kq表示雙分子猝滅速率常數,τ0表示熒光分子的平均壽命(1×10-8s),[Q]是藥物濃度。
分別繪制298,303,308 K溫度下衍生物Ⅰ(Ⅱ/Ⅲ)-HSA體系的Stern-Volmer曲線(見圖4),可見,數據有良好的線性關系,由直線斜率可以得到不同溫度下的猝滅常數(見表1)。表1顯示,KSV隨著溫度的升高而降低,可見是靜態猝滅引起HSA發生熒光猝滅[23]。結果表明,衍生物Ⅰ(Ⅱ/Ⅲ)均與HSA形成不發光的復合物。另外,不同衍生物-HSA體系的Kq均遠大于小分子猝滅劑對蛋白質大分子的最大碰撞猝滅速率2.0× 1010L·mol-1·s-1[24],進一步說明衍生物Ⅰ、Ⅱ、Ⅲ均能分別與HSA有效地形成穩定的非共價復合物,其熒光猝滅過程是靜態猝滅。
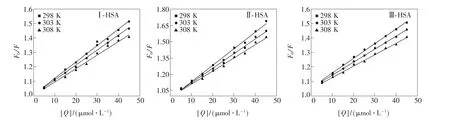
圖4 不同溫度下衍生物-HSA體系的熒光猝滅Stern-Volmer圖Fig.4 Stern-Volmer plots of fluorescence quenching of derivative-HSA systems at different temperatures

表1 不同溫度下衍生物-HSA體系的猝滅參數Table 1 Quenching constants of derivative-HSA systems at different temperatures
3.4 衍生物與HSA相互作用的紫外-可見吸收光譜
為了更進一步驗證衍生物與HSA相互作用的猝滅機理,測定了不同衍生物-HSA體系的吸收光譜。不同衍生物-HSA體系溶液的吸收光譜如圖5所示。由圖可知,隨著衍生物Ⅰ、Ⅱ、Ⅲ濃度的逐漸增加,HSA最大吸收峰強度明顯增大,說明不同衍生物的加入均使HSA分子構象發生變化,肽鏈部分伸展開來,促使本來包含在HSA內部的Trp和酪氨酸殘基(Tyr)等的芳雜環疏水基團出現裸露現象,基團間疏水作用減弱,導致吸收強度增加[25]。另外,紫外吸收光譜顯示衍生物Ⅰ(Ⅱ/Ⅲ)-HSA體系和游離Ⅰ(Ⅱ/Ⅲ)的差譜與HSA的紫外吸收曲線明顯不重合(見圖5中小圖)。這兩方面都進一步說明衍生物Ⅰ、Ⅱ、Ⅲ均分別與HSA基態分子發生相互作用形成了基態配合物,進一步證實其猝滅機制為靜態猝滅[26]。
3.5 衍生物與HSA相互作用的結合常數(KA)及結合位點數(n)
衍生物Ⅰ、Ⅱ、Ⅲ對HSA的熒光猝滅均為靜態猝滅,即其可分別與HSA相互作用形成基態復合物。假設衍生物與HSA有n個相同并且獨立的結合位點,則HSA的熒光強度與衍生物濃度的關系可用公式(3)來描述[23]:
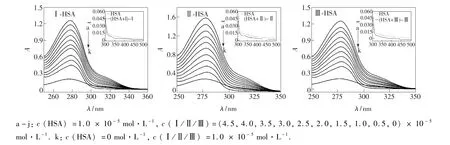
圖5 不同衍生物-HSA體系的紫外吸收光譜Fig.5 UV absorption spectrum of different derivative-HSA systems
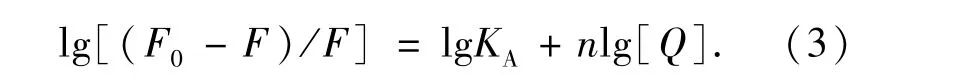
不同衍生物-HSA體系的lg[(F0-F)/F]對lg[Q]雙對數圖如圖6所示,由直線截距和斜率得到不同體系的KA和n值(表2)。由表2可知:不同溫度下n值均接近于1,表明衍生物Ⅰ、Ⅱ、Ⅲ分別與HSA相互作用均只有1個結合位點。且KA均隨溫度升高而降低,說明溫度升高導致復合物穩定性降低,更進一步證明各體系的猝滅過程為靜態猝滅[27]。
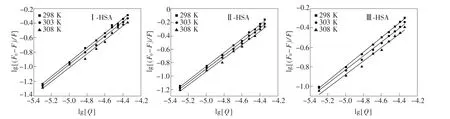
圖6 不同溫度下衍生物-HSA體系的熒光猝滅雙對數圖Fig.6 Double lg plots of fluorescence quenching of derivative-HSA systems at different temperatures

表2 不同溫度下衍生物-HSA體系的結合參數Table 2 Binding parameters of derivative-HSA systems at different temperatures
3.6 不同衍生物-HSA體系結合距離(r)及能量轉移效率(E)
根據非輻射能量轉移理論,供體大分子蛋白與受體小分子相互作用的E與r之間關系如下[28-29]:
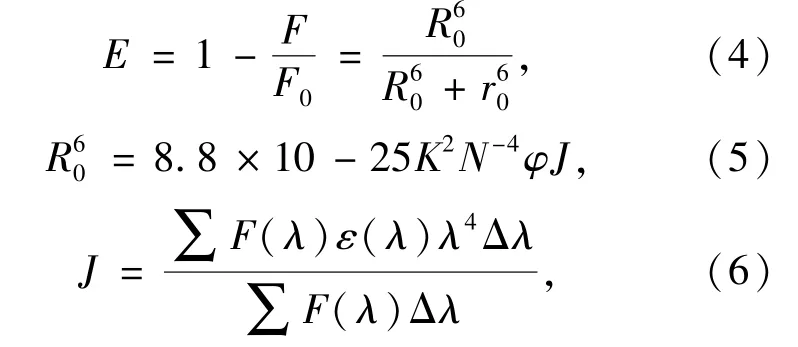
其中,F0為供體的熒光強度,F為供體和受體濃度為1∶1時的熒光強度,R0為臨界能量轉移距離,N為介質折射指數(1.336),K2為偶極空間取向因子(2/3),φ為供體的熒光量子產率(0.118)[30],J為供體的熒光光譜與受體的吸收光譜的重疊積分,F(λ)、ε(λ)分別為供體在波長λ處的熒光強度、摩爾吸光系數。
HSA熒光光譜與衍生物紫外吸收光譜的重疊圖如圖7所示。據公式(4)~(6)得到J、E、r,見表3。r均小于7 nm,且0.5R0<r<1.5R0,表明Trp殘基可將能量以非輻射方式轉移至衍生物Ⅰ、Ⅱ、Ⅲ,引起HSA內源性熒光猝滅。r均大于R0,說明非輻能量轉移引起的猝滅概率小于靜態猝滅,衍生物與HSA發生作用的主要猝滅方式為形成復合物導致的靜態猝滅[28,31]。
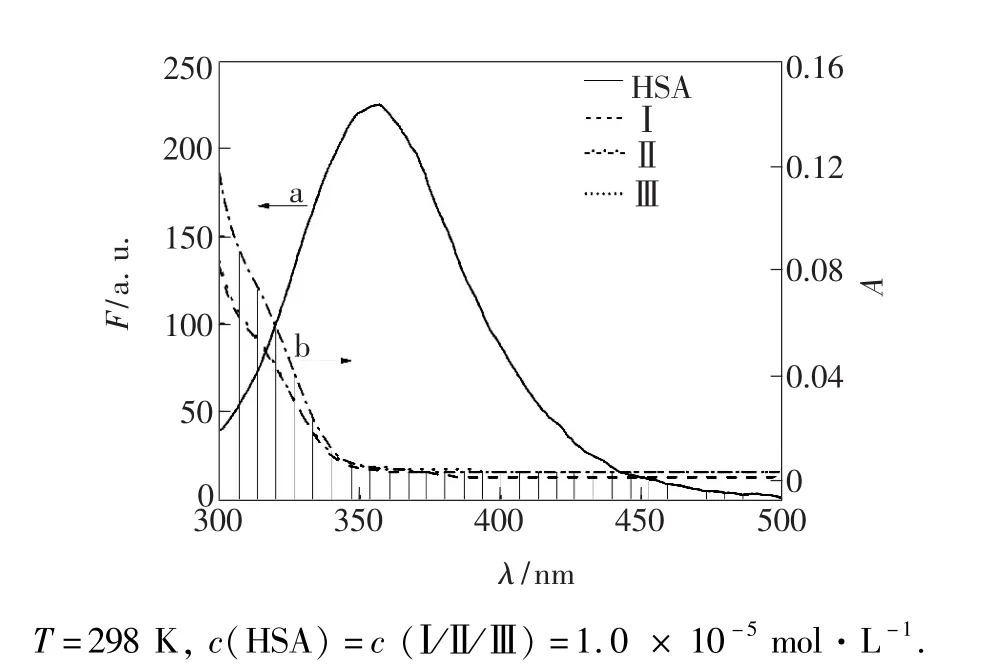
圖7 HSA的熒光發射光譜(a)與不同衍生物(b)的紫外吸收光譜重疊圖Fig.7 Overlap of fluorescence emission spectrum of HSA(a) and absorption spectra of different derivatives(b)

表3 不同衍生物-HSA體系的結合距離參數Table 3 Distance parameters of different derivative-HSA systems
3.7 不同衍生物-HSA體系作用力類型
氫鍵、疏水作用、范德華力和靜電力是配體小分子與生物大分子間的主要結合力類型。反應前后熱力學參數ΔH、ΔS的變化可以用來判斷不同的作用力類型[28]。實驗溫度在25~35℃之間, HSA不會發生任何結構降解。根據van't Hoff定律,兩物質間相互作用的熱力學參數符合下列關系:
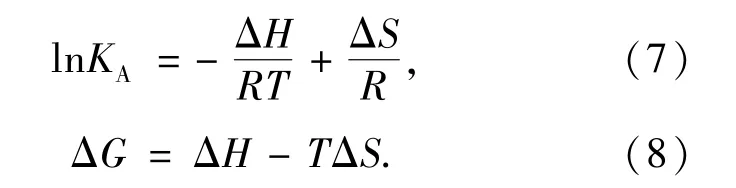
以lnKA對1/T作圖得到直線(圖8),由直線截距和斜率得到衍生物與HSA相互作用的ΔH、ΔS,通過公式(8)可以計算出不同溫度下的ΔG(表4)。不同溫度下ΔG<0,表明衍生物Ⅰ、Ⅱ、Ⅲ與HSA的結合均是自發進行的;ΔS<0,ΔH<0,表明其結合是焓驅動過程,相互作用力均主要是氫鍵和范德華力[32]。
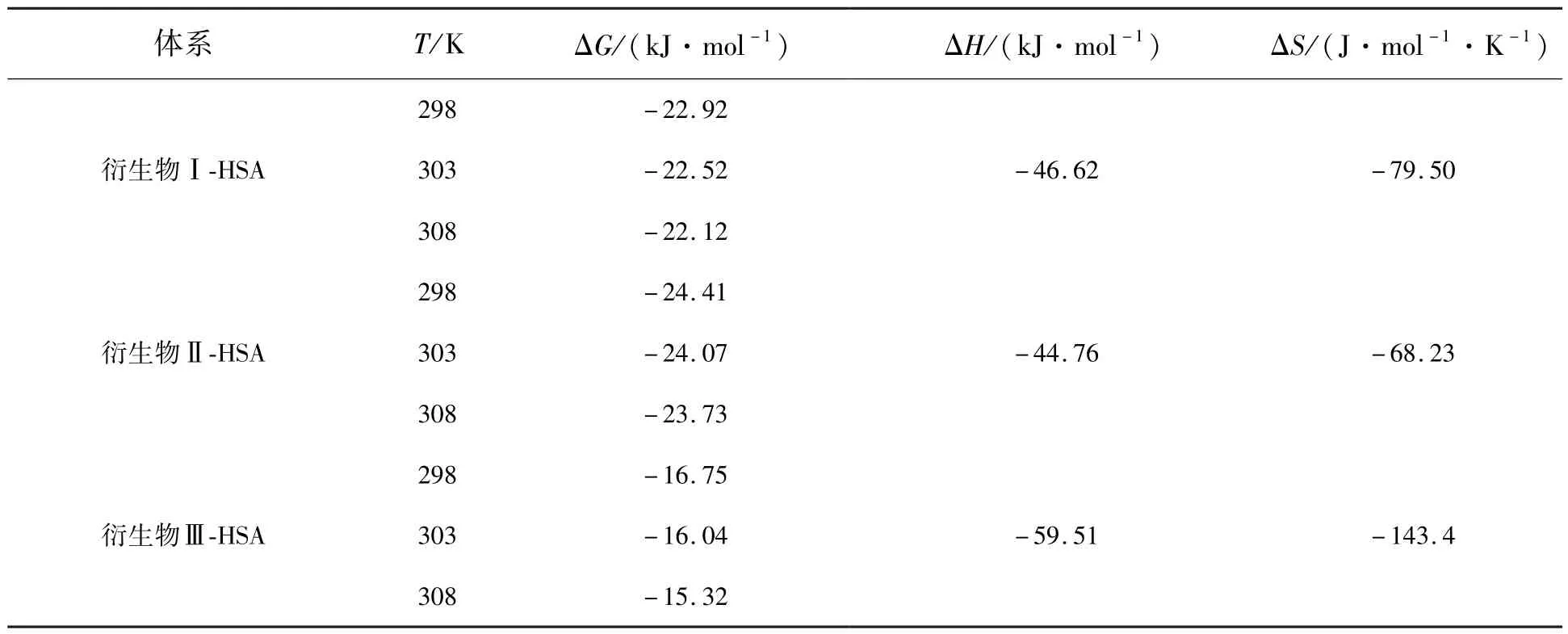
表4 不同溫度下衍生物-HSA體系的熱力學參數Table 4 Thermodynamic parameters of derivative-HSA systems at different temperatures
3.8 不同衍生物對HSA構象的影響
同步熒光光譜法具有譜圖簡化、選擇性高、光散射干擾減少等特點,廣泛應用于食品檢測、藥物分析、蛋白質構象變化分析等[33-34]。它可以反映不同發色團的性質,當固定激發波長與發射波長的間距為Δλ=15 nm時,只反映Tyr殘基的熒光光譜特性;當Δλ=60 nm時,只反映Trp殘基的熒光光譜特性。
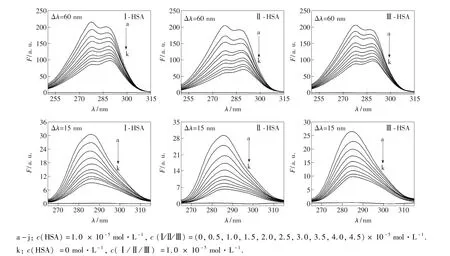
圖9 不同衍生物-HSA體系的同步熒光光譜Fig.9 Synchronous fluorescence spectra of different derivative-HSA systems
圖9為298 K時不同衍生物-HSA體系的同步熒光光譜。由圖可見,HSA熒光隨不同衍生物濃度的升高而呈顯著下降趨勢。Tyr殘基最大熒光發射峰所在波長沒有變化,而Trp殘基最大熒光發射峰所在波長明顯紅移(3種衍生物-HSA體系均從279 nm移動至290 nm)。即Tyr殘基周圍環境沒有明顯變化,而Trp殘基周圍環境極性增大,疏水性降低[30]。這表明衍生物的加入使HSA構象發生改變,分子內部肽鍵更加伸展開來,疏水腔發生部分瓦解,水分子進入其中,使得原本處于疏水腔中的Trp殘基暴露在更加親水的環境中[23]。由此可見,各衍生物與HSA的結合位點更接近于Trp殘基,同時印證了分子對接的結果。
4 結 論
采用分子對接技術結合光譜法研究了3種未見報道的肉桂酰胺類衍生物與HSA的相互作用。分子對接揭示了衍生物在HSA上的結合部位主要位于亞結構域ⅡA(即siteⅠ)中,相互作用力主要是氫鍵和范德華力,兼有疏水作用。光譜法實驗表明,在體外生理條件下,衍生物Ⅰ、Ⅱ、Ⅲ都使HSA內源熒光發生顯著猝滅,猝滅過程均遵循靜態猝滅,主要作用力均是氫鍵和范德華力,且HSA空間構象發生改變。分子對接預測和實驗結果一致,二者相互作證,提高了實驗結果推斷的準確度。這些信息對深入探究重要活性成分肉桂酸衍生物在生物體內的藥代動力學及可能存在的毒副作用具有重要意義,為藥物研發、改良提供有價值的理論參考。
[1]Xiao J B,Chen T T,Cao H,et al.Molecular property-affinity relationship of flavanoids and flavonoids for HSA in vitro [J].Mol.Nutr.Food Res.,2011,55(2):310-317.
[2]Guo S H,Shi X L,Yang F,et al.Structural basis of transport of lysophospholipids by human serum albumin[J].Biochem.J.,2009,423(1):23-30.
[3]Yang M L,Song Y M,Lu X Q.Preparation,anticoagulant property test and mechanism discussion of water soluble compound of β-cyclodextrin with warfarin/frulic acid[J].Chin.J.Anal.Chem.(分析化學),2015,43(6):836-842(in Chinese).
[4]Ma J H,Qin D D,Song Y M.Synthesis of superoxide dismutase-like activity of Co(Ⅱ),Ni(Ⅱ)complexes containing aromatic amines and glycylglycine[J].Chin.J.Anal.Chem.(分析化學),2015,43(8):1136-1144(in Chinese).
[5]Liang J,Feng S L.Interaction between ambroxol hydrochloride and human serum albumin studied by spectroscopic and molecular modeling methods[J].Spectrosc.Spect.Anal.(光譜學與光譜分析),2011,31(4):1020-1024(in Chinese).
[6]Xin J W,Ma H Y,Yang M.Spectroscopic studies on the interaction between mecobalamin and bovine serum albumin [J].Chin.J.Lumin.(發光學報),2012,33(5):553-557(in Chinese).
[7]Wu D.Synthesis and Antidepressant Activity of N-(2-hydroxyethyl)Cinnamam Derivatives[D].Yanji:Yanbian University,2011(in Chinese).
[8]Guan L P,Wei C X,Deng X Q,et al.Synthesis and anticonvulsant activity of N-(2-hydroxyethyl)cinnamamide derivatives[J].Eur.J.Med.Chem.,2009,44(9):3654-3657.
[9]Kong J O,Lee S M,Moon Y S,et al.Nematicidal activity of cassia and cinnamon oil compounds and related compounds toward Bursaphelenchus xylophilus(Nematoda:Parasitaphelenchidae)[J].J.Nematol.,2007,39(1):31-36.
[10]Motohashi N,Ashihara Y,Yamagami C,et al.Structure-antimutagenic activity relationships of benzalacetone derivatives against UV-induced mutagenesis in E.coli WP2uvrA and γ-induced mutagenesis in Salmonella typhimurium TA2638[J]. Mutat.Res-Fund.Mol.M,2001,474(1-2):113-120.
[11]Nie W,Luo J G,Wang X B,et al.Synthesis of new α-glucosidase inhibitors based on oleanolic acid incorporating cinnamic amides[J].Chem.Pharm.Bull.,2011,59(8):1051-1056.
[12]Deng X Q,Wu D,Wei C X,et al.Synthesis and antidepressant-like action of N-(2-hydroxyethyl)cinnamamide derivatives in mice[J].Med.Chem.Res.,2011,20(8):1273-1279.
[13]Ronad P M,Hunashal R D,Darbhamalla S,et al.Synthesis and evaluation of anti-inflammatory and analgesic activities of a novel series of substituted-N-(4-methyl-2-oxo-2H-chromen-7-yl)benzamides[J].Arzneim.Forsch.,2008,58(12): 641-646.
[14]Mou L Y,Lin Z Y,Zhu L Y,et al.Synthesis and vasodilative activities of α-phenylcinnamide[J].Acta Pharmaceut. Sinica(藥學學報),2001,36(7):502-506(in Chinese).
[15]Laskowski R A,Swindells M B.LigPlot+:Multiple ligand-protein interaction diagrams for drug discovery[J].J.Chem.Inf.Model.,2011,51(10):2778-2786.
[16]Jiang B L,Hu Y R,Zhao A R,et al.Characterization of taurine and its derivative binding to HSA using calorimetry and docking[J].J.Chem.Pharm.Res.,2013,5(12):1529-1536.
[17]Zaidi N,Ajmal M R,Rabbani G,et al.A comprehensive insight into binding of hippuric acid to human serum albumin: A study to uncover its impaired elimination through hemodialysis[J].PLoS One,2013,8(8):e71422.
[18]Bijari N,Shokoohinia Y,Ashrafi-Kooshk M R,et al.Spectroscopic study of interaction between osthole and human serum albumin:Identification of possible binding site of the compound[J].J.Lumin.,2013,143:328-336.
[19]Pacheco M E,Bruzzone L.Synchronous fluorescence spectrometry:Conformational investigation or inner filter effect? [J].J.Lumin.,2013,137:138-142.
[20]Li D J,Hong D F,Guo H,et al.Probing the influences of urea on the interaction of sinomenine with human serum albumin by steady-state fluorescence[J].J.Photoch.Photobio.B,2012,117:126-131.
[21]Xie M X,Long M,Liu Y,et al.Characterization of the interaction between human serum albumin and morin[J].BBAGen.Subjects,2006,1760(8):1184-1191.
[22]Yan Z Y,Shao X F,Yan L,et al.Interaction between gatifloxacin and bovine serum albumin[J].J.Chin.Pharm. Sci.,2005,14(1):33-37.
[23]Du C R,Luo X,Wei J R,et al.Preparation of(2E)-3-(4'-halophenyl)-prop-2-enoyl sulfachlorpyridazine sodium salts and their interaction with bovine serum albumin by fluorescence spectroscopy[J].Chem.Res.Chin.Univ.,2013,29 (5):854-860.
[24]Wang C,Wu Q H,Li C R,et al.Interaction of tetrandrine with human serum albumin:A fluorescence quenching study [J].Anal.Sci.,2007,23(4):429-433.
[25]Zhang Q,Song Y M,Liu J C,et al.Interaction between complexes of transition metal with warfarin and human serum albumin[J].Chin.J.Inorg.Chem.(無機化學學報),2011,27(9):1772-1780(in Chinese).
[26]Feng X Q,Fu G Q,Li X F,et al.Interaction of rare earth with bovine serum albumin[J].Chin.J.Lumin.(發光學報),2011,32(2):205-209(in Chinese).
[27]Wu J X,Li M,Liu Z G,et al.Study on interaction of Y3+and bovine serum albumin by spectrometry[J].Chin.J.Lumin.(發光學報),2012,33(10):1153-1159(in Chinese).
[28]Wang J,Zheng X F,Cao H Y,et al.Synthesis of 4-thio-5-iodouridine and the interaction between it and human serum albumin[J].Chin.J.Lumin.(發光學報),2013,34(3):361-368(in Chinese).
[29]Liu Y,Xie M X,Kang J,et al.Studies on the interaction of total saponins of Panax notoginseng and human serum albumin by Fourier transform infrared spectroscopy[J].Spectrochim.Acta A,2003,59A(12):2747-2758.
[30]Luo X,Du C R,Wei J R,et al.Study of the interaction between sodium salts of(2E)-3-(4'-halophenyl)prop-2-enoyl sulfachloropyrazine and bovine serum albumin by fluorescence spectroscopy[J].J.Lumin.,2013,28(2):202-210.
[31]Mandal P,Bardhan M,Ganguly T.A detailed spectroscopic study on the interaction of Rhodamine 6G with human hemoglobin[J].J.Photoch.Photobio.B,2010,99(2):78-86.
[32]Ross P D,Subramanian S.Thermodynamics of protein association reactions:Forces contributing to stability[J].Biochemistry,1981,20(11):3096-3102.
[33]Lloyd J B F.Synchronized excitation of fluorescence emission spectra[J].Nat.Phys.Sci.,1971,231(20):64-65.
[34]Xiao H B,Zhao J H,Yuan H C,et al.Determination of tetracycline content in pork by synchronous fluorescence spectroscopy with CARS method[J].Opt.Precision Eng.(光學精密工程),2013,21(10):2513-2519(in Chinese).

杜傳榮(1988-),女,山東滕州人,博士研究生,2010年于廣西大學獲得學士學位,主要從事天然藥物化學方面的研究。
E-mail:duchuanrong123@163.com

林翠梧(1958-),女,廣西北流人,教授,博士生導師,2000年于中山大學獲得博士學位,主要從事天然藥物化學方面的研究。
E-mail:cuiwulin114@163.com
Synthesis of Three Cinnamamide Derivatives and Their Interaction Mechanism with Human Serum Albumin
DU Chuan-rong1,LU Dong-wei1,SHI Kang2,CHEN Dan-dan1,LIN Cui-wu1,3*
(1.School of Chemistry and Chemical Engineering,Guangxi University,Nanning 530004,China; 2.School of Information and Communication,Guilin University of Electronic Technology,Guilin 541000,China; 3.Guangxi Colleges and Universities Key Laboratory of Applied Chemistry Technology and Resource Development,Nanning 530004,China) *Corresponding Author,E-mail:cuiwulin114@163.com
Because of the excellent properties and wide applications of cinnamamide medicines in clinic,three m-hydroxycinnamic acid derivatives were designed and synthetised by the reaction of mhydroxybenzoic acid with different amino acids,respectively.Their structures were characterized by mass spectrometry,infrared spectroscopy,and nuclear magnetic resonance.The interaction mechanism of derivatives and human serum albumin(HSA)were investigated by AutoDock molecular docking,fluorescence spectroscopy and UV-visible absorption spectroscopy.The results of molecular docking represent that derivatives exist in the hydrophobic pocket of subdomainⅡA(siteⅠ)of HSA.Hydrogen bonds and van der Waals'forces are main acting forces and hydrophobic force is just the secondary consideration.The spectra experiment results indicate that the derivatives can form complexes with HSA respectively and strongly quench the intrinsic fluorescence of HSA through static quenching at different temperatures.Meanwhile,the secondary structure of HSA is influenced. The change in enthalpy(ΔH)and entropy(ΔS)suggest that hydrogen bonds and van der Waals forces are main acting forces.The molecular docking data are consistent with experimental results.
cinnamamide derivatives;spectroscopic methodology;molecular docking;human serum albumin(HSA)
O625.5
:ADOI:10.3788/fgxb20153611.1342
1000-7032(2015)11-1342-11
2015-08-11;
:2015-09-21
廣西研究生教育創新計劃(YCBZ2013011);國家自然科學基金(21362001);廣西自然科學基金重點項目(2013GXNSFDA019005);廣西中藥質量標準研究重點實驗室開放課題(桂中重開201102)資助項目

