例談初中化學教學的拓展與延伸
陳良政
(宿遷中學開發區分校 江蘇 宿遷 223800)
課堂教學中, 教師若能尊重學生的個性差異,因人而異地選擇有效教學策略,并且在立足文本的基礎上突破文本的限制, 對文本進行有效的拓展和延伸,就能全面提升學生的學習能力。幾年來,筆者在課堂教學中就如何進行有效拓展與延伸作了一些實踐和嘗試,旨在進一步深化落實新課程目標,優化課堂教學,提高教學質量;同時讓學生感受到知識的奧妙與博大精深,以此來激發學生的探究欲望,讓學生在求知的道路上欲罷不能。
一、問題的提出
常態課堂中經常會遇到這樣的情況,學生在所學知識的基礎上產生了新的疑問,提出了教師事先沒有預設的問題,而且這個問題不在教學目標范圍內,教師便認為學生提的問題超出課標要求,不愿意把課堂時間浪費在這些問題上,通常對這些問題避而不提、不答。例如:在學習“溶液酸堿性”這節內容時,學生提出了這樣的問題:為什么pH 值越小溶液的酸性越強? pH 值是怎么得出來的? 碳酸氫鈉不是可溶的嗎? 為什么氨鹽水吸收二氧化碳后生成碳酸氫鈉能以晶體形式析出? 再如,為什么原子的核外電子排布第一層最多只能排兩個電子,第二層最多只能排八個電子? 為什么最外層是七個電子的原子不穩定?……。當學生提出這些不解問題時,有的教師往往會說“這個記住就行了,不需要知道為什么,考試又考不到。”“你們把我講的掌握好就足夠了,完全可以面對中考,至于其他的留你們以后再學。”教師的這種做法無可厚非,但是卻反映了這些教師無視學生的心理需求和內心體驗,一味地把自己的觀點強加給學生,用堂而皇之的方法平息了學生的疑問和繼續追問。
二、問題的解決
肖川在《解讀學習的革命》一書中有這樣一段話:“教師,兒童的‘天國引路人’。在我們越來越關注學習者的時候,教師的作用不會受到絲毫的削弱,相反,他們需要承擔更關鍵、更艱巨的職責,體現出更大的‘不可替代性’,教師將面臨新的挑戰。”這段話觸及了我的心靈,引發了我的思考:我在教育教學中面臨的挑戰是什么? 我該如何面對我的課堂和我的學生? 在教學中,我不斷地反思與實踐,漸漸地懂得了教師面臨的教學的挑戰, 那就是喚醒學生已有的經驗和智慧,激發他們的高水平思維,組織有效的合作學習,幫助他們對知識深層的理解, 誘發和激發他們的求知欲望,讓他們在求知路上迎難直上,尋找捷徑,盡情馳騁,而不是在他們的求知路上充當攔路虎。
1.不回避學生提出“超標”問題
俗話說:“站得高,看得遠。”學習要抓住知識間的本質聯系,才能做到一通百通,融會貫通。我發現對學生課堂上提出的生成性問題不回避, 進行及時解答,不僅能激發學生的學習思維, 喚起對知識的渴望,更能讓學生感受到知識的奧妙與博大精深。所以,我在課堂中不回避學生提出的“超課程標準”問題,經常會隨機地“浪費”一點時間給學生簡單的介紹他們想知道的知識。有時也會根據以往的課堂經驗在備課中事先有目的地誘導和設計這些問題。
案例1:教學中發現,學生在學習“溶液的酸堿性強弱和溶液的pH 值的關系”時總是死記硬背,雖然能夠應對習題,但不會變通,對所學知識停留在表面上,沒有真正掌握知識的內在聯系。他們往往提出這樣的問題:為什么pH 值越小溶液的酸性越強? pH 值是怎么得出來的?
針對學生提出的問題,我在教學中試著向他們簡單介紹了溶液中氫離子濃度和氫氧根離子濃度的關系和pH 值的計算方法,告訴他們公式:pH =-lg[H+](即溶液的pH 值用氫離子濃度的負對數來表示),列舉酸性溶液、中性溶液、堿性溶液中pH 值的實例呈現給學生看(PPT)。

常溫下,水溶液中:[H+]×[OH-]=10-14 =Kw(定值,叫水的離子積常數)。例如:當[H+]=0.1 mol·L-1 時,[OH-]=Kw /0.1=10-13 mol·L-1 pH =1當[OH-]=0.01 mol·L-1 時,[H+]=Kw /0.01 =10-12 mol·L-1 pH =12由此得出以下結論:中性水溶液:[H+]=[OH-]=10-7 mol·L-1 pH =7酸性水溶液:[H+]>[OH-],[H+]>10-7 mol·L-1 pH <7堿性水溶液:[H+]<[OH-],[H+]<10-7 mol·L-1 pH >7注意:pH 值與[H+]成負對數關系,[H+]越大,pH 值越小。
雖然學生還沒有學過對數公式,但學生根據以上信息能夠了解pH 值是根據一定的公式計算出來的,這里并不要求學生掌握這個公式及計算方法。通過以上的信息呈現和簡單講解,學生很容易理解為什么在中性溶液中pH =7,酸性溶液中pH <7,堿性溶液中pH >7 。這個部分,在課堂上5 分鐘就可以完成。其實這也是課堂教學中重難點突破的一種手段,學生對知識的理解和掌握上升了高度,更有利于他們以后的學習,記得有位教育家說過,成功的教師是把學生推向求知的道路上欲罷不能。
2.及時解答生成性的“超標”問題
案例2:海水“制堿”的方法:向飽和食鹽水中通入氨氣,再壓入二氧化碳氣體,析出溶解度相對較小的碳酸氫鈉。學生在課堂上提出了這樣的問題:氨鹽水吸收二氧化碳的產物中不是也有氯化銨嗎? 為什么生成碳酸氫鈉以晶體形式析出而氯化銨不析出呢? 碳酸氫鈉不是可溶的嗎? 一般老師都會說“因為碳酸氫鈉溶解度小,氯化銨溶解度大,所以會析出,記住就行了。”這樣,學生便很勉強地接受了這個知識。面對這個問題,我在教學中是這樣處理的。
首先,在PPT 上向學生呈現以下表格和數據:
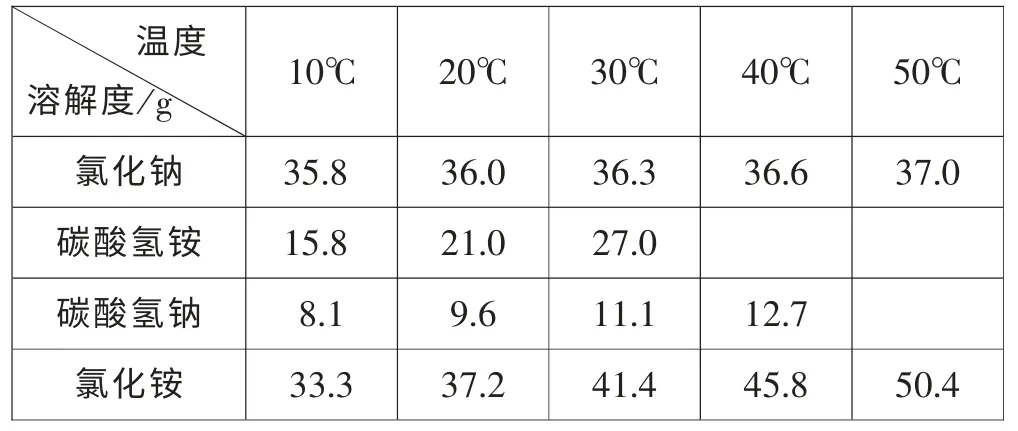
溫度溶解度/g 10℃ 20℃ 30℃ 40℃ 50℃氯化鈉 35.8 36.0 36.3 36.6 37.0碳酸氫銨 15.8 21.0 27.0碳酸氫鈉 8.1 9.6 11.1 12.7氯化銨 33.3 37.2 41.4 45.8 50.4
然后,帶著學生算出假設在20℃,向1000g 水中溶解食鹽達飽和狀態,最多能溶解多少克食鹽? 若向此飽和溶液中通入足量的氨氣和二氧化碳,計算理論上生成碳酸氫鈉和氯化銨的質量。
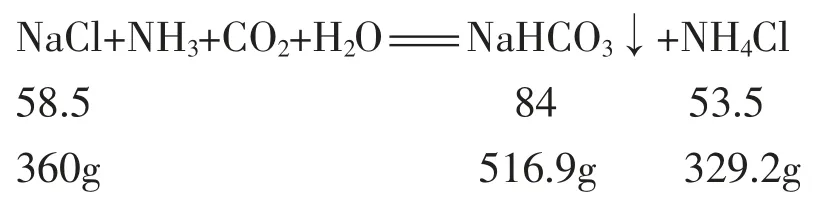
上述計算數據說明:20℃,1000g 水最多能溶解360g 食鹽, 通入氨氣和二氧化碳, 最多生成516.9 g碳酸氫鈉和329.2g 氯化銨; 從表中數據知:1000g 水最多能溶解96g 碳酸氫鈉和372g 氯化銨, 對比知,碳酸氫鈉可以析出420.9g 晶體,而氯化銨未飽和。學生很容易理解為什么碳酸氫鈉會析出來, 同時也知道了生成的氯化銨沒有達到飽和,不會以晶體的形式析出。
3.把握好問題拓展的度
義務教育階段的化學課程以提高學生的科學素養為主旨,目的是為激發學生學習化學的興趣,幫助學生了解科學探究的過程和方法,培養學生的科學探究能力,使學生獲得進一步學習和發展所需要的化學基礎知識和基本技能。教學中拓展內容要在深入研究《課程標準》和《中考說明》基礎上進行,還要建立在學生已有的知識基礎上進行,有些拓展內容可以讓學生理解,但并不一定要求掌握。
教學的魅力在于度的把握,任何事物都是一分為二的,課堂上生成的“超課程標準”的問題把握得好,對學生學習興趣的提升、探究能力的發展能起到一定的推動作用,用得不好可能會對學生的學習產生很大的負面影響。什么問題該拓展,什么問題不宜拓展,拓展到什么程度,完全要由學生的具體情況來定,以學定教永遠是提高教學效率的法寶。
三、經驗與反思
課堂教學并不是只為了學生應對中考,而是為了他們終生的發展奠基。課本出現的是知識,教師傳授的是方法, 不能把孩子對知識的好奇和向往打消,課本知識都是基礎知識,學生通過自己的獨立學習基本上能理解和接受,但學生往往在這些知識的基礎上想知道更多,知其然而更想知其所以然,所以這時候,我們不能讓學生的思維急剎車。課堂上學生的沉默和出錯不就說明他們真正地投入了自主的學習和思考嗎?如果教師對學生的這些情況處理不當,學生的疑問得不到解決,學生在學習新知識時就可能無法全身心投入,影響新知識的學習,更不利于培養學生的學習熱情,易導致學生失去提問的勇氣,最終不愿意、不習慣思考和提問了。這樣,教師不但沒有點燃學生的求知欲望之火,更是將本可成為燎原的火種給澆滅了。學習成了一種簡單的復制。如果, 作為生命活動的場所——課堂,不能讓學生感受自己認真思考而帶來的愉悅,課堂怎能讓學生產生深深的眷戀呢?
近幾年, 我在嘗試著不斷改進我的課堂教學,勇敢面對課堂中的挑戰, 不斷地誘發學生提問題,凡是學生提出的疑問,我覺得對學生有利的,有助于學生對所學知識理解的,學生能夠接受的,我就會積極引導學生去發現和學習,出于內心追求的一種高度自覺,我在課堂中始終要求自己保持求變求新的心態。在我的課堂上,我經常這樣說:“誰要是能把這道題解出來,我喊你老師。” “有疑問就說,機會有限,難道就沒有想知道更多的? ” “你太牛了,你是怎么想到的?快給我們說說。” 在這種激勵下,學生一個接一個問題出現,一個又一個地被解決。
[1]肖川,王文寶.解讀學習的革命[M].北京:中國青年出版社,1999
[2]方明.陶行知教育名篇[M].北京:教育科學出版社,2005

