植物葉綠體SOD的轉錄調控與功能研究進展
郭懷攀,佘文琴
(福建農林大學園藝學院,福建福州350002)
植物體在自然狀態下和各種生物脅迫時均會有活性氧(ROS)產生。植物體自身有著較完善的抑制活性氧產生和活性氧清除機制,能夠有效地清除活性氧。而在復雜的自然環境中,植物體可能會受到干旱、鹽漬、高溫、冷凍、重金屬離子、空氣污染、病蟲害等逆境脅迫,此時機體內會產生大量的活性氧。由于植物體內活性氧代謝能力有限,活性氧積累,從而產生氧化脅迫。在植物體內,超氧化物歧化酶(SOD)在對抗活性氧對細胞膜透性的破壞與保護細胞膜完整性方面有著重要作用。SOD作為活性氧代謝的首要防線,參與O2-等超氧陰離子轉化成O2和H2O2的分解反應[1]。然后,在過氧化物酶(POD)、過氧化氫酶(CAT)以及抗壞血酸過氧化物酶(APX)等的協同作用下,活性氧完全分解。
SOD在植物體內普遍存在,幾乎在所有需氧生物體內都有發現。SOD是一種多聚體金屬蛋白。根據酶活性中心金屬輔基的不同,可分為Cu/Zn SOD(CSD),Fe SOD(FSD),Mn SOD(MSD)和Ni SOD(NSD)4類。綠色植物SOD主要包括前3種;Ni SOD被發現較晚,主要存在于一些低等生物中,在植物中尚沒有被發現[2]。從遺傳進化關系上,FSD是最為原始的SOD,黃褐色,分子結構為四聚體結構,分子量80~90 kDa,在酶活性中心有2~4個Fe離子[3];MSD與FSD在一級、二級和三級結構上高度相似,金屬結合位點的保守殘基相同[4],被認為可能由FSD進化而來,不同的是其活性中心只有一個金屬離子,顏色為紫紅色;CSD與前兩種SOD差異較大,可能是單獨進化而來,為二聚體結構,分子量32~65 kDa,顏色也為紫紅色[3]。植物自身防護機制限制了有害物質在不同細胞器之間的運輸,帶電的O2-離子無法通過細胞質膜。這就要求SOD分布在不同細胞器間隔中進行活性氧清除,保護各細胞器代謝不受O2-離子的危害[3]。大量的研究表明,CSD是分布較廣泛也是最主要的一種,位于植物細胞質、葉綠體、過氧化物酶體、乙醛酸循環體以及胞外間隙;FSD主要位于葉綠體中;MSD則位于線粒體基質和過氧化物酶體中[5-6]。植物通過各種細胞器間SOD酶的廣泛分布以及與其他酶的協同作用來共同確保植物細胞膜的完整性。
1 植物SOD基因克隆與遺傳進化關系
1.1 植物SOD基因的分子克隆 植物SOD基因的克隆開始于20世紀80年代。早期的一些克隆主要有玉米、擬南芥、水稻等。隨著分子生物學技術的迅速發展,人們對SOD基因克隆及轉化表達工作已進行了大量研究,每年都有上千條SOD基因得到克隆驗證。在NCBI數據庫中,在Nucleotide中搜索“superoxide dismutase”,已登錄的SOD核酸序列(mRNA)就有十多萬條,主要是細菌和原核生物,其中綠色植物僅2 583條,綠色植物的克隆中絕大多數是有花植物。植物SOD基因的克隆為植物抗逆性等基因工程研究奠定了基礎。植物SOD基因家族的多態性可能是由植物體對于復雜環境的應對機制引起的,不同類型的SOD在抵御逆境時扮演著不同角色[5]。與其他物種相比,植物體SOD基因種類較多,由多個基因分別編碼,編碼方式相對復雜。各種SOD在亞細胞中的定位不同,對應的基因編碼序列也不一樣,并且同一亞細胞中也會存在多種SOD,如葉綠體中就同時存在CSD和FSD。植物體內SOD序列具有很高的同源性,且相較于其他生物,SOD基因內含子數目與位置具有高度保守性。在內含子數量上,植物體內核基因組中質胞型CSD的內含子有7個[7];葉綠體型的有8個,玉米葉綠體型CSD內含子略有不同,只有7個[7];MSD 基因一般含5個內含子[8],FSD 內含子為6~8個[9]。
1.2 SOD遺傳進化關系 植物SOD基因家族具有多態性,可能是由植物體對于復雜環境的應對機制引起的。不同類型的SOD在抵御逆境中扮演著不同角色。與其他物種相比,植物體SOD基因的編碼方式相對復雜,由多個基因編碼。在各種SOD在亞細胞中的定位不同,對應的基因編碼序列也不一樣。通過對來自23個物種的SOD不同類型基因序列(圖1)的比對,發現各類型SOD在不同的植物間具有很高的保守性;FSD與MSD序列相對接近,具有共同進化來源,而CSD與它們的親緣關系較遠,不同亞細胞分布的CSD之間的差異并不明顯,如葉綠體CSD中三角葉楊CSD序列與質胞型的歐洲山楊CSD序列比較接近。
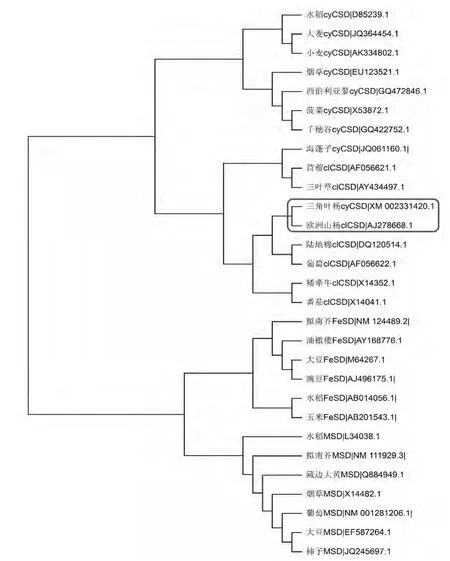
圖1 植物SOD基因系統進化樹
2 葉綠體SOD的表達與調控
2.1 葉綠體SOD基因的轉錄過程 所有植物的SOD基因序列都是由細胞核基因組編碼的,因此這些由80S核糖體轉錄合成的蛋白質需要經過跨膜運輸來送達葉綠體。植物葉綠體中主要存在CSD和FSD 2種SOD。在模式植物擬南芥(Arabidopsis thaliana)葉綠體中主要是 FSD1、FSD2、FSD3和CSD2,其中FSD1的表達量最高。在葉綠體SOD基因的翻譯表達過程中,除FSD1外,其他SOD有專一的可分裂的葉綠體轉運序列,可以結合SOD經TOC/TIC通道蛋白穿過細胞器膜,最終將SOD運送到葉綠體基質中[10]。緊接著,葉綠體基質中的蛋白酶使得葉綠體轉運序列分裂釋放SOD,完成SOD的運輸過程。Jarvis[10]認為,TOC/TIC通道蛋白具有很強的解折疊能力,推測被結合的SOD應該處于伸展狀態。因此,SOD酶的折疊加工與金屬輔基的裝配過程應該在基質中進行。而FSD酶絡合Fe離子的過程尚不明確。銅分子伴侶(Chaperone for Cu/Zn Superoxide dismutase,CCS)在CSD 的合成過程中起到傳遞銅離子的作用,其氨基末端具有銅離子結合位點,中心區域與其靶蛋白CSD酶相似,并且具有額外的半胱氨酸殘基的羧基末端結構域,使得銅離子與CSD亞基之間通過二硫鍵相連,從而激活CSD酶的活性[11]。然而,FSD1作為擬南芥葉綠體SOD中最重要的一種,缺少一個相應的轉運序列[12],FSD1的轉運過程以及之后的進一步修飾也有待進一步的研究。
2.2 Cu離子對葉綠體SOD表達的調控 銅離子調節機理的研究已經十分深入,主要涉及轉錄調控因子啟動子結合蛋白SPL7。SPL7是在植物中的Cu響應轉錄因子[13],其功能是在植物體內調節Cu離子的平衡。在低Cu離子濃度下,SPL7直接與小RNA miR398啟動子的GTAC序列結合,激活miR398表達[13]。miR398能夠降解編碼CSD的mRNA,從而抑制CSD的表達。同時,Cu離子還是CSD和銅分子伴侶CCS不可缺少的金屬輔基。在高的Cu離子濃度下,CSD大量表達,FSD表達幾乎完全被抑制[14],可能是植物將Fe離子用在其他物質的合成;在低的Cu離子濃度下,CSD和CCS的表達被抑制,FSD的活性被激活[15],同時Cu離子被優先靶向轉移到類囊體內腔中合成質體藍素[16]。這說明Cu離子對不同類型SOD在葉綠體中的表達具有選擇性。外源Cu離子對轉CSD、CCS基因的擬南芥突變體中FSD和CSD轉錄水平的影響進一步表明,葉綠體基質中的銅離子含量調節這些核基因的表達[17]。因此,植物葉綠體中可能存在一種信號途徑來感知Cu離子濃度,從而影響植物細胞核中SOD基因的表達。
2.3 脅迫對SOD基因表達的影響 擬南芥葉綠體SOD在各個生長發育階段均保持著較高的表達水平[12]。這說明葉綠體型SOD在SOD基因家族中扮演著重要角色。在不同的脅迫處理下CSD和FSD的表達情況已有較多的研究。主要是外源金屬離子脅迫如 Cu、Fe、Zn、As、Mn 等離子[18],光照脅迫如弱光、紫外光[19],溫度脅迫如高溫、低溫[20],環境脅迫如干旱、鹽漬[21],還有外源激素處理如 ABA、GA3等[22]。干旱、滲透脅迫和外源ABA都會引起葉綠體基質的閉合,影響光合作用中CO2的輸送,在光照條件下基質中的光化還原反應過度還原,從而積累大量的過氧化物質[23]。大多數植物位于上述脅迫環境下都會引起SOD的上調表達。這顯然與SOD的活性氧清除功能有關。大多數處理[24-26]對葉綠體CSD和質胞CSD的表達影響基本上是一致的,表現為同時上調表達,少數情況[27]表現為同時下調。而脅迫對FSD表達的影響不甚相同,在有些情況下為上調,有時為下調表達,FSD的表達機理有待明確[22]。一些外源物質可以引起SOD基因的差異表達,如鹽脅迫條件下水稻幼苗CSD、MSD等抗氧化酶基因表達量增加,但在外源脯氨酸和海藻糖的作用下使這些基因表達量下調,甚至低于沒有進行脅迫處理的幼苗[28]。SOD在金屬離子產生的過氧化脅迫中起著重要作用[29]。錳離子的毒害作用在短期內可以使得黑麥草不同亞型SOD基因產生差異性表達,就整體而言表達量趨勢是上升的[30]。
3 葉綠體SOD功能
葉綠體SOD在植物光合作用過程中起著重要作用,主要是活性氧的清除,可以進行電子傳遞保護正常光合作用以及調節電子轉移與信號傳遞的作用。
3.1 活性氧的清除 葉綠體是植物進行光合作用的重要場所。在葉綠體中類囊體中,光系統Ⅰ(PSⅠ)和光系統Ⅱ(PSⅡ)反應中心是活性氧的主要生成部位。早在1951年,Mehler[31]就發現了PSⅠ光化還原反應將O2轉化成H2O2的反應過程。光合作用的原初光化學反應與一系列的氧化還原反應相銜接。
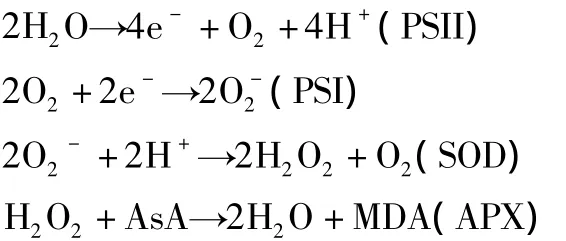
這一系列由光化還原反應產生的電子的傳遞過程,起始物和終止物都有水的存在,因此被稱為W-W循環(Waterwater cycle)[32]。W-W循環起到激能傳遞的作用,同時能夠使得光化還原反應中產生的活性氧得以有效清除。PSⅠ反應中心復合物是由多個膜蛋白組成的超分子復合物,將電子傳遞給H2O形成超氧陰離子[33],PSⅡ和質體醌同樣會產生活性氧[23]。植物葉綠體中存在超過20 種 Fe-S 蛋白[34],而 PSⅠ是還原鐵硫中心的光系統,其中心為Fe-S簇。有研究表明,其復合物蛋白中的Fe-S簇對過氧化物高度敏感,易使其功能喪失[34],同時具有類似結構的FSD1也有可能會喪失酶活性[22]。類囊體外膜的表面被認為是超氧化物產生的主要位置,用免疫標記電子顯微鏡觀察發現大多數葉綠體的CSD緊密地靠近類囊體外膜的表面,與PSⅠ相接近,可能是由于CSD靠近PSⅠ光反應位點會更有效地將活性氧清除[35]。
3.2 保護光合作用與電子傳遞 植物體自身存在一系列光系統保護體系。在葉綠體中,光合作用中的光系統Ⅱ(PSⅡ)易受到光化還原過程中過多激發能的刺激而產生光抑制作用[36],影響植物正常的光合作用。在高光或高CO2濃度條件下,W-W循環并不能夠有效地轉移激發能,此時非光化學猝滅(NPQ)和光呼吸過程可能更有效[23]。W-W循環并非電子傳遞的主要方式。有研究表明,在正常的光合作用條件下,W-W循環電子傳輸估計值不到總電子傳輸量的10%[23]。然而,超表達的FSD在線粒體中會使通過W-W循環傳輸電子量顯著增加,尤其在強光與低溫環境條件下[37]。在煙草中,FSD的超表達會改善除草劑甲基紫精處理引起的光抑制作用[38],在擬南芥中FSD2/FSD3的超表達也具有同樣的效果[12]。SOD在保護光合作用中起到的作用是有限的,對擬南芥CSD2的mRNA進行修飾表達使其成為抗miR398,從而提高其表達量。通過觀察擬南芥在高光、重金屬以及甲基紫精處理下CSD2的表達情況,了解其抗脅迫的能力,結果只有在相對苛刻的處理條件下才能觀察到處理與對照之間的差異[39]。
3.3 SOD功能缺失對植物的影響 值得探討的是,葉綠體SOD功能的一些線索還不是很明確。通過研究SOD的表達模式以及影響這些酶表達的幾個因素,可以尋找這些線索,如SOD的表達調控機理以及各種環境因素產生的影響,包括非生物脅迫和營養物質等。關于SOD功能最直接的證據來自于SOD表達缺失的突變體。擬南芥CCS缺失突變體在葉綠體和胞液沒有檢測到SOD活性。這表明CCS是SOD表達過程中的關鍵酶。CCS缺失突變體生長即便在高濃度的Cu離子環境中,仍會缺乏這FSD和CSD活性[40]。然而,CCS缺失并沒有產生植物表型的變化,而且在高光脅迫下也沒有檢測到其對光合作用產生影響。這些結果表明,CSD不是光合抗氧化劑體系中的一個關鍵組成部分,只是限制了CSD的合成。在這一過程中,植物可能存在其他活性氧清除機制,如APX在葉綠體中起著比SOD更重要的作用[41]。而葉綠體CSD缺失突變體會導致植株生長受抑制,葉綠體變小,同時光合作用能力降低[42]。在一種藍藻菌中,發現FSD缺失突變體會對光反應氧化脅迫敏感[43]。這說明SOD在葉綠體光合作用中具有不可低估的作用。
4 總結
葉綠體SOD在植物體內除了清除活性氧外,還可以進行電子傳遞,保護正常光合作用以及信號傳遞等。SOD在植物體內的功能可能遠不止這些。葉綠體作為植物體內SOD種類和含量較多的部位,葉綠體SOD的功能顯然與光合作用的部分過程密切相關。研究SOD缺失突變體或SOD基因的超表達并結合植物表現型的分析能夠更好地探討SOD的功能,并且發現更多SOD其他方面的應用。
[1]BAFANA A,DUTT S,KUMAR A,et al.The basic and applied aspects of superoxide dismutase[J].Journal of Molecular Catalysis B-Enzymatic,2011,68(2):129 -138.
[2]SILAGHI-DUMITRESCU R.Superoxide interaction with nickel and iron superoxide dismutases[J].Journal of Molecular Graphics and Modelling,2009,28(2):156 -161.
[3]ALSCHER R G,ERTURK N,HEATH L S.Role of superoxide dismutases(SODs)in controlling oxidative stress in plants[J].J Exp Bot,2002,53(372):1331 -1341.
[4]ABREU I A,CABELLI D E.Superoxide dismutases-a review of the metalassociated mechanistic variations[J].Biochimica et Biophysica Acta(BBA)-Proteins and Proteomics,2010,1804(2):263 -274.
[5]LI A M,MARTINSJ,TOVMASYAN A,et al.Differential localization and potency of manganese porphyrin superoxide dismutase-mimicking compounds in Saccharomyces cerevisiae[J].Redox Biology,2014,3:1 -6.
[6]YOUNH D,KIM EJ,ROE JH,et al.A novel nickel-containing superoxide dismutase from Streptomyces spp[J].Biochem J,1996,318(Pt 3):889 -896.
[7]FINK R C,SCANDALIOSJ G.Molecular evolution and structure-function relationships of the superoxide dismutase gene families in angiosperms and their relationship to other eukaryotic and prokaryotic superoxide dismutases[J].Arch Biochem Biophys,2002,399(1):19 -36.
[8]BAEK K H,SKINNER DZ.Differential expression of manganese superoxide dismutase sequence variants in near isogenic lines of wheat during cold acclimation[J].Plant Cell Rep,2006,25(3):223 -230.
[9]KATYSHEV A I,ROGOZIN I B,KONSTANTINOV Y M.Identification of new superoxide dismutase transcripts in plants by est analysis:Alternative polyadenylation and splicing events[M].Kolchanov N,Hofestadt R,2006:61-64.
[10]JARVISP.Targeting of nucleus-encoded proteins tochloroplasts in plants[J].New Phytol,2008,179(2):257 -285.
[11]ABDEL-GHANY SE,BURKHEADJL,GOGOLIN K A,et al.AtCCSis a functional homolog of the yeast copper chaperone Ccs1/Lys7[J].FEBS Lett,2005,579(11):2307 -2312.
[12]MYOUGA F,HOSODA C,UMEZAWA T,et al.A heterocomplex of iron superoxide dismutases defends chloroplast nucleoids against oxidative stress and is essential for chloroplast development in Arabidopsis[J].Plant Cell,2008,20(11):3148 -3162.
[13]YAMASAKI H,HAYASHI M,FUKAZAWA M,et al.SQUAMOSA promoter binding protein-like7 is a central regulator for copper homeostasis in Arabidopsis[J].The Plant Cell Online,2009,21(1):347 -361.
[14]ABDEL-GHANY SE.Contribution of plastocyanin isoforms to photosynthesis and copper homeostasis in Arabidopsis thaliana grown at different copper regimes[J].Planta,2009,229(4):767 -779.
[15]MURAO K,TAKAMIYA M,ONO K,et al.Copper deficiency induced expression of Fe-superoxide dismutase gene in Matteuccia struthiopteris[J].Plant Physiol Biochem,2004,42(2):143 -148.
[16]PILONM,ABDEL-GHANY SE,COHUCM,et al.Copper cofactor delivery in plant cells[J].Curr Opin Plant Biol,2006,9(3):256 -263.
[17]ABDEL-GHANY S E,MULLER-MOULE P,NIYOGI K K,et al.Two P-type ATPases are required for copper delivery in Arabidopsis thaliana chloroplasts[J].Plant Cell,2005,17(4):1233 -1251.
[18]WON E,RA K,KIM K,et al.Three novel superoxide dismutase genes identified in the marine polychaete Perinereis nuntia and their differential responses to single and combined metal exposures[J].Ecotoxicology and Environmental Safety,2014,107:36 -45.
[19]SUNKAR R,KAPOOR A,ZHU J K.Posttranscriptional induction of two Cu/Zn superoxide dismutase genes in Arabidopsis is mediated by downregulation of miR398 and important for oxidative stress tolerance[J].Plant Cell,2006,18(8):2051/2065.
[20]KUMAR A,KAACHRA A,BHARDWAJS,et al.Copper,zinc superoxide dismutase of Curcuma aromatica is a kinetically stable protein[J].Process Biochemistry,2014,49(8):1288 -1296.
[21]HUSEYNOVA I M,ALIYEVA D R,ALIYEV JA.Subcellular localization and responses of superoxide dismutase isoforms in local wheat varieties subjected to continuous soil drought[J].Plant Physiology and Biochemistry,2014,81:54 -60.
[22] PILON M,RAVET K,TAPKEN W.The biogenesis and physiological function of chloroplast superoxidedismutases[J].Biochimicaet Biophysica Acta(BBA)-Bioenergetics,2011,1807(8):989 -998.
[23]FOYER CH,NOCTOR G.Tansley Review No.112 Oxygen processing in photosynthesis:regulation and signaling[Z].2000:146,359 -388.
[24]PERL-TREVESR,GALUN E.The tomato Cu,Zn superoxide dismutase genes are developmentally regulated and respond to light and stress[J].Plant Mol Biol,1991,17(4):745 -760.
[25]ABERCROMBIE JM,HALFHILL M D,RANJAN P,et al.Transcriptional responses of Arabidopsisthaliana plants to As(V)stress[J].BMC Plant Biol,2008,8:87.
[26]WANG G,CAI G,KONG F,et al.Overexpression of tomato chloroplasttargeted DnaJ protein enhances tolerance to drought stress and resistance to Pseudomonas solanacearum in transgenic tobacco[J].Plant Physiology and Biochemistry,2014,82:95 -104.
[27]KUREPA J,HEROUART D,VAN MONTAGU M,et al.Differential expression of Cu、Zn-and Fe-superoxide dismutase genes of tobacco during development,oxidative stress,and hormonal treatments[J].Plant Cell Physiol,1997,38(4):463 -470.
[28]NOUNJANN,NGHIA PT,THEERAKULPISUTP.Exogenous proline and trehalose promote recovery of rice seedlings fromsalt-stress and differentially modulate antioxidant enzymes and expression of related genes[J].J Plant Physiol,2012,169(6):596 -604.
[29]CARTESP,MCMANUS M,WULFF-ZOTTELE C,et al.Differential superoxide dismutase expression in ryegrass cultivars in response to short term aluminium stress[J].Plant and Soil,2012,350(1/2):353 -363.
[30]RIBERA-FONSECA A,INOSTROZA-BLANCHETEAU C,CARTESP,et al.Early induction of Fe-SOD gene expression is involved in tolerance to Mn toxicity in perennial ryegrass[J].Plant Physiol Biochem,2013,73:77-82.
[31]MEHLER A H.Studies on reactions of illuminated chloroplasts.I.Mechanism of thereduction of oxygen and other Hill reagents[J].Arch Biochem Biophys,1951,33(1):65 -77.
[32]ASADA K.Production and scavenging of reactive oxygen species in chloroplasts and their functions[J].Plant Physiology,2006,141(2):391 -396.
[33]RUUSKA SA,BADGER M R,ANDREWSTJ,et al.Photosynthetic electron sinks in transgenic tobacco with reduced amounts of Rubisco:little evidence for significant Mehler reaction[J].J Exp Bot,2000,51:357 -368.
[34]YE H,PILONM,PILON-SMITSE A.CpNifS-dependent iron-sulfur cluster biogenesis in chloroplasts[J].New Phytol,2006,171(2):285 -292.
[35]OGAWA K,KANEMATSU S,TAKABE K,et al.Attachment of CuZn-Superoxide dismutase to thylakoid membranes at the site of superoxide generation(PSI)in spinach chloroplasts:detection by immuno-gold labeling after rapid freezing and substitution method[J].Plant Cell Physiol,1995,36(4):565-573.
[36]NIYOGI K K.Safety valves for photosynthesis[J].Curr Opin Plant Biol,2000,3(6):455 -460.
[37]ARISI A C,CORNIC G,JOUANIN L,et al.Overexpression of iron superoxide dismutase in transformed poplar modifies the regulation of photosynthesis at low CO2partial pressures or following exposure to the prooxidant herbicide methyl viologen[J].Plant Physiol,1998,117(2):565 -574.
[38]VAN CAMP W,CAPIAU K,VAN MONTAGU M,et al.Enhancement of oxidative stress tolerance in transgenic tobacco plants overproducing Fesuperoxide dismutase in chloroplasts[J].Plant Physiol,1996,112(4):1703-1714.
[39]SUNKAR R,KAPOOR A,ZHU J K.Posttranscriptional induction of two Cu/Zn superoxide dismutase genes in Arabidopsis is mediated by downregulation of miR398 and important for oxidative stress tolerance[J].Plant Cell,2006,18(8):2051 -2065.
[40]COHU CM,ABDEL-GHANY SE,GOGOLIN R K,et al.Copper delivery by the copper chaperone for chloroplast and cytosolic copper/zinc-superoxide dismutases:regulation and unexpected phenotypes in an Arabidopsis mutant[J].Mol Plant,2009,2(6):1336 -1350.
[41]MUBARAKSHINA BM,KOZULEVA MA,RUDENKONN,et al.Photosynthetic electron flow to oxygen and diffusion of hydrogen peroxide through the chloroplast envelope via aquaporins[J].Biochim Biophys Acta,2012,1817(8):1314 -1321.
[42]RIZHSKY L,LIANG H,MITTLER R.The water-water cycle is essential for chloroplast protection in the absence of stress[J].JBiol Chem,2003,278(40):38921 -38925.
[43]THOMASDJ,AVENSONTJ,THOMASJB,et al.A cyanobacterium lacking iron superoxide dismutase is sensitized to oxidative stress induced with methyl viologen but is not sensitized to oxidative stress induced with norflurazon[J].Plant Physiology,1998,116(4):1593-1602.

