RSK2與惡性腫瘤的關系及其抑制劑的研究進展*
陳康杏,王籽又,黃燕霞,鐘承志,李凱恒,黃遵楠△(廣東醫學院第二臨床醫學院,中美腫瘤研究所,公共衛生學院,廣東東莞5808)
·綜述·
RSK2與惡性腫瘤的關系及其抑制劑的研究進展*
陳康杏1,王籽又2,黃燕霞3,鐘承志1,李凱恒1,黃遵楠2△
(廣東醫學院1第二臨床醫學院,2中美腫瘤研究所,3公共衛生學院,廣東東莞523808)
[ABSTRACT]Ribosomal S6 kinase 2 (RSK2) is a member of the p90Rsk,which belongs to Ser/Thr kinase family.It is a downstream molecule of Ras/MAPK cascade and regulates a variety of cellular processes.RSK2 plays a key role in the cell proliferation,survival and transformation.Furthermore,the aberrant up-regulation of RSK2 was observed in different malignancies.We here briefly review the structure and function of RSK2,the relationship between RSK2 and tumor,and the existing RSK2 inhibitors.
核糖體S6激酶2;結構;功能;腫瘤;抑制劑
[KEY WORDS]Ribosomal S6 kinase 2; Structure; Function; Tumor; Inhibitors
核糖體S6激酶(ribosomal S6 kinase,RSK) 2屬于Ras-MAPK下游通路的90 kD的RSK家族,該家族包含4個成員(RSK1~4)及2個結構同系物MSK1/2。RSK家族的成員具有高度的序列同源性(75%~80%的氨基酸序列是一致的),只有2個激酶功能域不同。盡管結構相似,它們在組織內的分布及功能卻不盡相同[1],而本文主要介紹RSK2。RSK2的發現起始于它的基因缺陷會導致科-勒二氏綜合征(Coffin-Lowry syndrome,CLS),一種罕見的神經退行性疾病[1]。后來深入的研究發現,RSK2是ERK1/2直接的下游底物,RSK2一旦被激活就會轉入到核中磷酸化多種核蛋白,從而調控細胞的多項生命活動包括細胞的增殖、周期、轉化等。近幾年有不少研究證實RSK2的蛋白水平在惡性腫瘤及組織中較正常細胞及組織明顯偏高[2],而研究者們一直致力于尋找高效低毒的靶向RSK2的抑制劑。由此可見,RSK2是一個很有潛力的抗癌靶標。本文主要就RSK2的結構功能、與腫瘤的關系及現有抑制劑展開介紹。
1RSK2的結構
RSK2的結構比較復雜,包含2個功能不同的激酶結構域,分別是N端激酶結構域(N-terminal kinase domain,NTKD)與C端激酶結構域(C-terminal kinase domain,CTKD) ;另有1個鉸鏈區(linker region,LR)、1個N端結構域(N-terminal domain,NTD)及1 個C端結構域(C-terminal domain,CTD)[1]。NTKD屬于AGC激酶家族,主要負責底物的磷酸化。CTKD則屬于CaMKs家族,主要負責自身的磷酸化(活化)[1]。2個激酶結構域由1個保守的鉸鏈結構相連,在CTD上有1個ERK1/2對接基序(Leu-Arg-Gln-Arg-Arg),而LR中包含ERK介導的RSK2自動磷酸化位點[1,3]。
2RSK2的活化機制
在生長因子等刺激因素的影響下,RSK2的多個磷酸化殘基依次被不同激酶磷酸化,具體活化路線見圖1。RSK2的完全活化需要ERK1/2與3-磷酸肌醇依賴性蛋白激酶1 (3-phosphoinositide-dependent protein kinase-1,PDK1)的共同作用,缺一不可。首先,非活化狀態下的ERK1/2連接到RSK2 CTD的特定結合位點上,這是RSK2活化必不可少的一步[4]。然后刺激信號如分裂素等刺激ERK1/2活化,ERK1/ 2活化后使得RSK2鉸鏈區的Ser369和CTKD上的Thr577磷酸化;這2個位點的磷酸化活化了CTKD;上文提到過CTKD負責自身的磷酸化,所以,CTKD活化后,Ser386發生了磷酸化; Ser386位于鉸鏈區芳香環殘基的疏水部位,它磷酸化后產生了1個可與PDK1對接的位點[5]; PDK1連接上去后,反過來在NTKD的激活回路中磷酸化Ser227[6]。與PDK1分離后,磷酸化的Ser386連接到NTKD的1個磷酸化連接位點上,從而導致芳香環殘基上的疏水基序穩定連接到附近的1個疏水口袋上,部分形成了α螺旋,這個α螺旋同活化環中磷酸化的Ser227將NTKD穩定在一個活性構象中[5]。另外有研究發現,成纖維細胞生長因子受體3(fibroblast growth factor receptor 3,FGFR3)可磷酸化RSK2的Y529,而這一步磷酸化可調控初始階段非活化狀態的ERK1/2連接到RSK2上[4]。
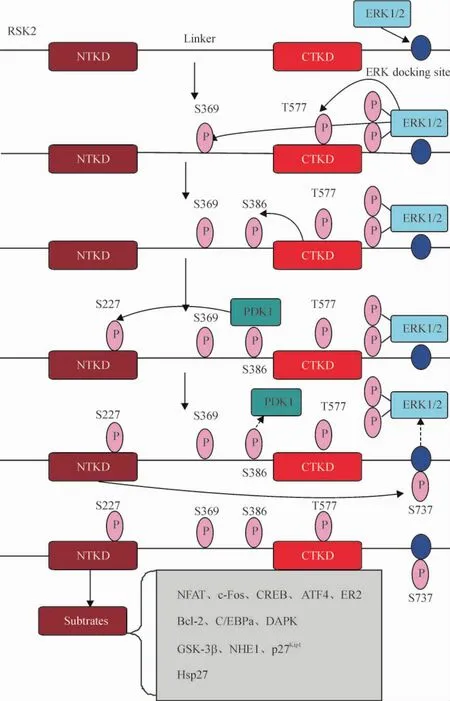
Figure 1.Molecular mechanism of RSK2 activation.圖1 RSK2激活的分子機制
3 RSK2的功能
RSK2一旦活化,就可轉入核中磷酸化多種核蛋白從而調控細胞的各項生命活動。RSK2的底物非常多,見表1,因此RSK2的功能很廣泛。(1) RSK2調節轉錄因子的活化,促進相關蛋白質的表達。比如可調控cAMP反應元件結合蛋白(cAMP response element-binding protein,CREB)[7]、c-Fos[8]、活化T細胞核因子c4(nuclear factor of activated T-cells c4,NFATc4)[9]、活化T細胞核因子3(nuclear factor of activated T-cells 3,NFAT3)[10]、活化轉錄因子4(activating transcription factor 4,ATF4)[11]、神經孤束核受體Nur77[12]和IκBα[13]的磷酸化。(2) RSK2可抑制細胞的凋亡,促進細胞的存活。RSK2可通過磷酸化促凋亡蛋白Bad[14]及死亡相關蛋白激酶(DAPK)[15]使這些蛋白喪失促凋亡的作用。(3) RSK2可促進細胞增殖。通過磷酸化糖原合酶激酶3β(GSK-3β)[16]、Na+/H+交換器1(NHE1)[17]和細胞周期蛋白依賴性激酶抑制劑1B(p27Kip1)[18]促進細胞增殖。(4) RSK2通過磷酸化熱休克蛋白27 (heat shock protein 27,Hsp27)[19]促進腫瘤細胞遷移和侵襲。RSK2就像一個鑰匙,通過激活多個信號網絡的信號效應來促進細胞的存活、增殖和遷移。

表1 RSK2的底物及其作用Table 1.Substrates and effects of RSK2
4RSK2與腫瘤
4.1RSK2與造血系統惡性腫瘤目前已有研究證實RSK2除了是ERK1/2的直接底物外還是FGFR3的底物。FGFR3可磷酸化RSK2的Y529及Y707,有助于ERK1/2連接到RSK2上并使得RSK2保持在活性狀態[4]。FGFR3在一些造血系統惡性腫瘤如急性髓系白血病、淋巴瘤以及多發性骨髓瘤等的發生與發展過程中扮演著重要的角色。而RSK2與FGFR3誘導的造血轉換過程密切相關。FGFR3的失調激活了RSK2進而促進造血系統惡性腫瘤的發生與發展[20]。
4.2RSK2與轉移型頭頸部鱗狀細胞癌頭頸部鱗狀細胞癌(head and neck squamous-cell carcinoma,HNSCC)是一種比較常見的實體瘤,全世界每年超過50 000個病人罹患此病。目前臨床上比較有效的藥物有順鉑、紫杉醇、5-氟尿嘧啶等,然而用藥后,病人的存活率沒有得到提高,病人在4年后的存活率不足50%。存活率不高的主要原因是HNSCC易轉移,可轉移到淋巴結及其它比較遠的器官。有研究證實在轉移HNSCC細胞株中,RSK2的表達量顯著增加。下調RSK2或用RSK2的抑制劑FMK處理后,轉移型的HNSCC細胞的侵襲力下降。穩定敲除RSK2的HNSCC裸鼠模型的淋巴結轉移及肺轉移也明顯減少,究其原因可能是RSK2通過磷酸化Hsp27來促進轉移[21]。
4.3RSK2與前列腺癌迄今為止,前列腺癌依然是世界上主要的一種致死癌癥。有研究發現,RSK2可調控前列腺特異性抗原(prostate-specific antigen,PSA)的表達,PSA是一種重要的前列腺癌診斷標志物。另外發現RSK2在前列腺癌組織中的表達量較正常前列腺組織高出了2.5倍。用RSK特異性的抑制劑3Ac-SL0101處理后,人前列腺癌細胞株的增殖得到抑制。文獻報道AR在前列腺癌的進展中扮演著重要的角色。而RSK2可能的作用機制就是通過磷酸化雄激素受體(androgen receptor,AR)的共激活因子而非直接磷酸化AR來增強AR的活性,從而增加了PSA的表達量并促進前列腺癌細胞株的增殖[22]。
4.4RSK2與皮膚癌皮膚癌是一種比較常見的腫瘤,在美國每年有超過兩百萬患者被診斷患有此病。而近些年來,隨著環境臭氧層的破壞及人口的老齡化,得皮膚癌的患者的人數正在逐年增加[3]。有研究證實相較于正常的皮膚組織,人皮膚癌組織中的RSK2的總蛋白表達量及磷酸化水平明顯偏高。加了UV照射后,不僅RSK2的總蛋白表達增加,磷酸化水平提高,RSK2的mRNA表達水平及核定位水平均增加。敲除RSK2可抑制人皮膚癌細胞株的增殖及轉化。由此可見,RSK2同皮膚癌細胞的增殖及轉化密切相關[23]。
4.5RSK2與三陰性乳腺癌三陰性乳腺癌(triplenegative breast cancer,TNBC)是乳腺癌中的一種特殊種類,因雌激素受體(estrogen receptor,ER)、孕激素受體(progesterone receptor,PR)及人表皮生長因子受體2均為陰性而得名。相較于其它正常的乳腺癌,TNBC的預后更差,雖然它對化療藥物的敏感性高,但因為未知的分子機制,傳統療法對它并不起作用,所以目前臨床研究的發展趨勢是找出一個可能的治療靶標[24]。據文獻報道,在對244例乳腺癌病人進行跟蹤調查后發現,RSK2表達水平高的乳腺癌病人的存活率更低,且RSK2在TNBC細胞株中的含量較非TNBC乳腺癌細胞株的含量高,用siRNA沉默RSK2也是優先抑制TNBC模型,對于非TNBC模型的效果不是那么理想。沉默RSK2或使用RSK抑制劑SL0101或BI-D1870處理細胞后發現超過90% 的TNBC細胞株SUM149的生長受到抑制。RSK2促進TNBC腫瘤生長的分子機制可能是通過磷酸化YB-1最終促進了CD44的表達[25]。所以,RSK2是一個很好的治療TNBC的分子靶標。
5RSK2現有抑制劑的研究進展
近年來,人們根據RSK2的結構通過實驗或計算的方法,發現或設計合成了一系列的抑制劑,這些抑制劑分為選擇性抑制劑和非選擇性抑制劑,見表2。選擇性抑制劑是針對RSK2具有一定的特異性,如SL010、BI-D1870和FMK;非選擇性抑制劑是指這類抑制劑除了抑制RSK2外還能對其它激酶具有活性,如GF109203X。
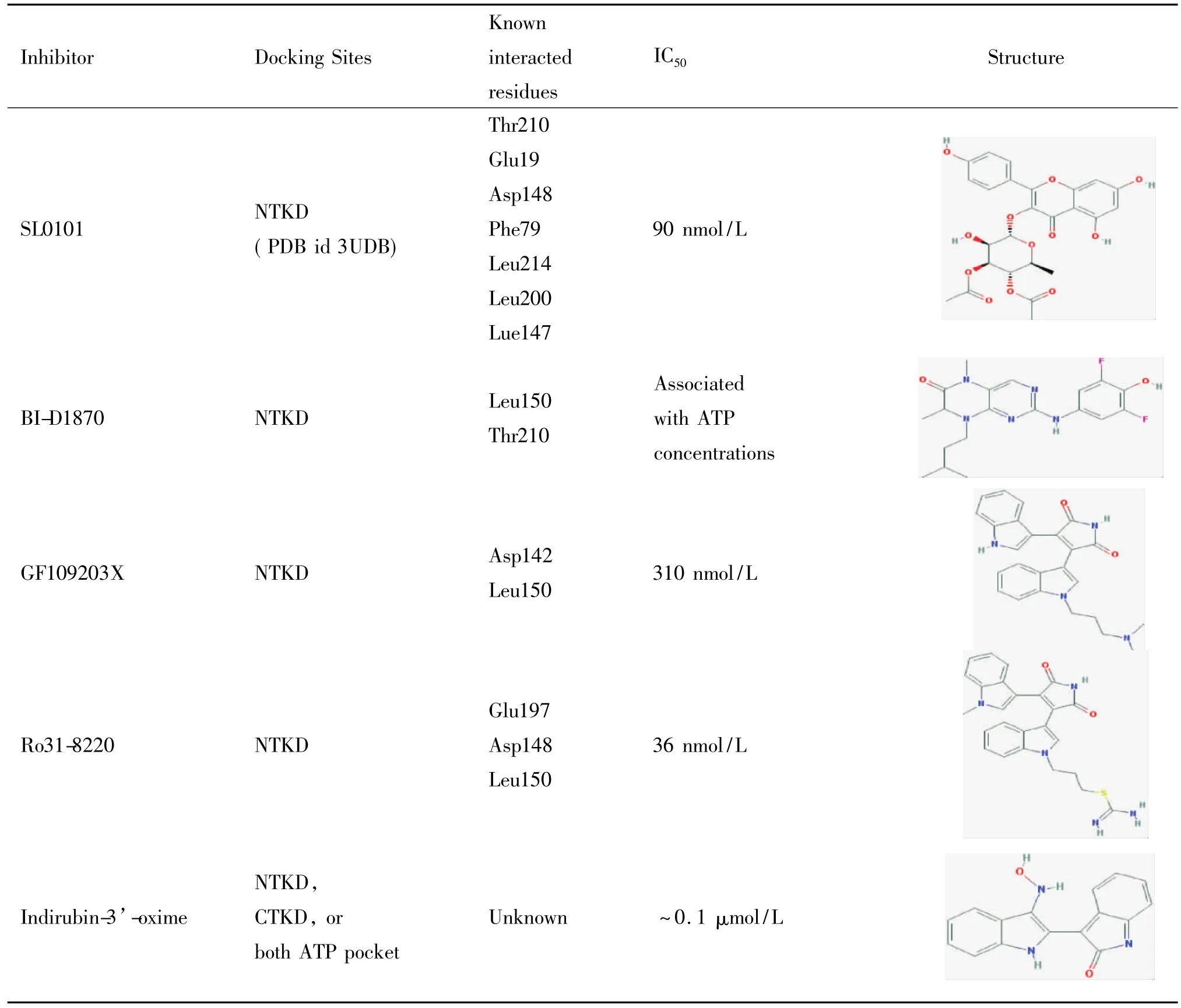
表2 RSK2抑制劑Table 2.RSK2 inhibitors
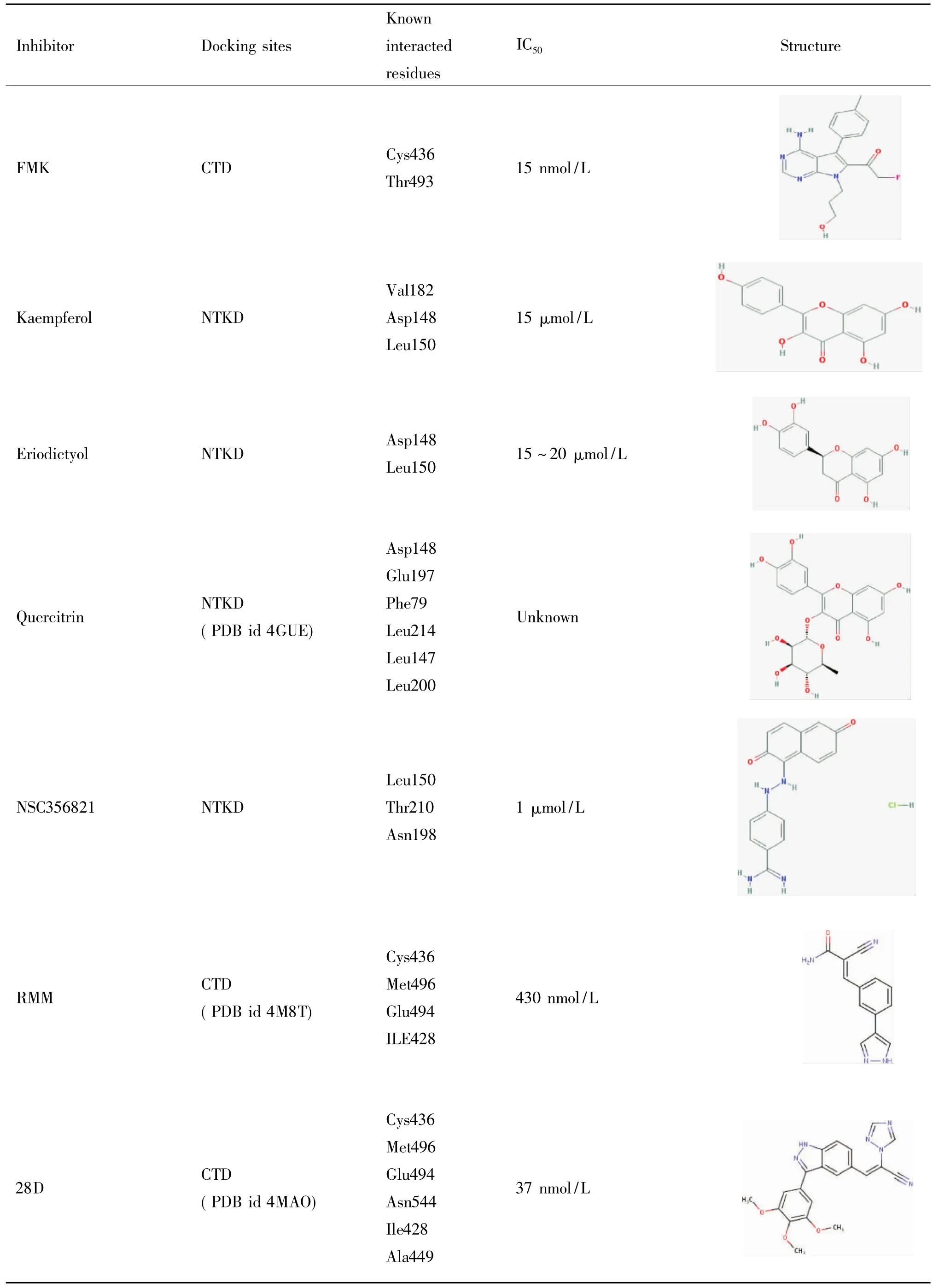
續表2Continued Table 2
5.1RSK2選擇性抑制劑SL0101是被發現的第一種具有相對特異性的RSK2抑制劑。該化合物提取自生長在亞馬遜熱帶雨林的Forsteronia refracta,由4,5,7-三羥基酮醇和乙酰化的鼠李糖組成,其中乙酰化的鼠李糖起主要作用。SL0101能與ATP競爭性地結合到RSK2的N端激酶上從而發揮其抑制作用。使用SL0101后,細胞內>90%的RSK2被抑制,然而這種選擇性并不是絕對的,SL0101無法區分RSK家族的其它成員,不過,純化的SL0101能抑制RSK卻不能抑制P70S6K及MSK1。研究表明,在體外實驗中,ATP濃度為10 μmol/L時,SL0101有效抑制RSK2的IC50約為1 μmol/L。然而在完整細胞中,EC50為50 μmol/L[26]。
BI-D1870是一種合成的小分子化合物,該化合物可抑制RSK1~4的活性。在體外實驗中,BID1870的抑制效果與ATP的濃度有關,當ATP濃度為10 μmol/L時BI-D1870對RSK的IC50為10 nmol/ L,若ATP濃度為100 μmol/L時,BI-D1870對RSK 的IC50為15~30 nmol/L[27]。BI-D1870對RSK1~4的抑制效果并不完全一樣,比如相較于抑制RSK1,BI-D1870對RSK4的抑制效果要好2倍。但不可否認的是,BI-D1870對每種RSK的抑制作用都很強[26]。BI-D1870還可抑制AGC激酶家族的成員,但有效濃度要提高一百倍甚至更多[27]。同樣用0.1 μmol/L BI-D1870處理,98%的RSK2可得到抑制,而MSK1的抑制程度還不足13%[26]。
FMK(吡咯并嘧啶類化合物)是一種作用于RSK2的C末端激酶的選擇性抑制劑。它含有一個親電的氟甲基酮結構,此結構通過與ATP結合區域內的半胱氨酸436(Cys436)共價結合而發揮其抑制作用,為ATP競爭性抑制劑。FMK是一種高度特異性的RSK1和RSK2的抑制劑。在用生物素標記的FMK同人表皮細胞底物發生反應后,發現FMK只與2種蛋白發生了反應,一種是RSK1,另外一種就是RSK2。在體外實驗中,FMK對RSK2的IC50為15 nmol/L。而FMK對RSK2的上游激酶ERK1/2沒有抑制作用,也不可抑制MSK1調控的組蛋白磷酸化。只可抑制RSK2調控的組蛋白磷酸化[26]。
5.2非選擇性抑制劑GF109203X和Ro31-8220是星孢菌素類化合物,這2個化合物是傳統的蛋白激酶C(PKC)抑制劑,除了可抑制PKC的活性外還可抑制RSK1~3的活性。在體外實驗中,ATP濃度為50 μmol/L時,GF109203X對RSK1~3的IC50分別為610、310和120 nmol/L,Ro31-8220對RSK的IC50分別為600、36和5 nmol/L[28]。由于RSK2的 NTKD同PKC的結構具有一定的相似性,所以GF109203X和Ro31-8220主要是通過結合于RKS2 NTKD上ATP口袋中的腺嘌呤識別位點來發揮其抑制作用[26]。
靛玉紅-3’-肟(indirubin-3’-oxime)是一種非選擇性高效的RSK2抑制劑,IC50為0. 1 μmol/L。其作用范圍廣泛,除可作用于RSK外還可作用于CDK5 和GSK-3β,其與CDK5和GSK-3β具有較確定的作用方式,主要是通過與蛋白激酶的腺嘌呤識別環路上的酰胺形成氫鍵而發揮作用。目前還無法證明它是如何抑制RSK2的,但推測作用方式與上述方式相似[26]。
最近幾年內有人發現了新的RSK2抑制劑,該類抑制劑主要通過結合于RSK2的CTD來發揮作用,區別于前述主要作用于NTKD的抑制劑。研究者在設計合成激酶共價抑制劑時發現的系列化合物中,triazole19和triazole20 (ligand ID 28D in PDB code 4MAO)是作用于RSK2 C末端激酶的抑制劑。在RSK2 C末端激酶結構域的激酶分析實驗中,這2種化合物對RSK2的IC50分別為3 nmol/L和37 nmol/ L。它們可與RSK2的C末端殘基Cys436形成共價鍵[29]。另外研究者發現cyanoacrylamide抑制劑也是一種可作用于RSK2 C末端激酶的抑制劑,這種抑制劑同樣通過與RSK2的C末端殘基Cys436形成共價鍵來發揮作用。在ATP濃度為0.1 mmol/L和10 mmol/L時,系列cyanoacrylamide抑制劑中有5種cyanoacrylamides抑制劑對RSK2的IC50<10 μmol/ L,其中,pyridine 21 (ligand ID RMM in PDB code 4M8T)和pyrazole 24是最強大的拮抗野生型RSK2抑制劑(IC50分別為430 nmol/L和370 nmol/L)。另外,以pyridine為模板合成的pyrrolopyrimidine 27通過共價鍵與RSK2相連,尚未在商業上使用,但實驗中發現pyrrolopyrimidine 27比21更有效。Pyrrolopyrimidine 27在體外抑制野生型RSK2激酶的IC50為42 nmol/L,抑制MSK1的EC50<1 μmol/L[30]。
5.3選擇性未知的可能的RSK2抑制劑山奈酚(kaempferol)是一種黃酮類化合物,是SL0101的類似物,兩者的相似度達到90%[26]。有文獻報道山奈酚可與ATP競爭性結合RSK2與MSK1而非RSK1 和RSK3來抑制其活性[31]。山奈酚對RSK2的IC50為15 μmol/L。作用殘基為Asp148與Leu150[26]。圣草酚(eriodictyol)是從散塔草(Eriodictyon californicum)中提取的一種黃酮類化合物,其結構與山奈酚相似。圣草酚可與ATP競爭性結合到RSK2的NTKD,對RSK2上游的MEK1/2、ERK1/2及MAPK的其它成員JNK、p38均無抑制作用。其作用殘基為Asp148和Leu150,對RSK2的IC50約為15~20 μmol/L[32]。另外有文獻報道櫟素(quercitrin)——槲皮苷(quercitin)的衍生物——可連接到RSK2的N端激酶上,結合模式與SL0101非常相似,櫟素甚至可以作為SL0101的替代品作用于細胞[33]。有研究者利用高通量篩選的方法篩選出了RSK2可能的抑制劑2-氨基-7’-苯并惡唑衍生物[34]。也有研究者用分子對接等計算機輔助藥物設計的技術從數據庫中篩選出了RSK2可能的抑制劑吲哚-2-酮類似物,其中抑制作用最強的化合物3s的IC50為0. 5 μmol/ L[35]。另外早在2006年,在RSK2的立體結構尚不清楚的時候,Nguyen等[36]采用PKA和ANP(一種ATP類似物)的復合物為模板,構建了一種比較精確的RSK2 N端結構的模型。隨后這個模型被用來篩選出了NSC356821和NSC51023兩種RSK2的NTD競爭性抑制劑。其中,NSC356821是一種二羥萘衍生物,具有與其它已報道的RSK抑制劑不一樣的化學結構。NSC356281在體外實驗中的IC50為1 μmol/ L,能與RSK2中的Leu150、Thr210和Asn198結合形成氫鍵,抑制ATP對RSK2的激活作用。上述提到的這幾類化合物因缺乏實驗數據,暫且歸類到選擇性未知的RSK2抑制劑。
6發展前景
過去的研究已經證實RSK2在細胞的生長、增殖、凋亡、轉化等各項生命活動中扮演著重要的角色,并且發現RSK2在很多惡性腫瘤組織中的表達量明顯高于正常組織,大大促進了惡性腫瘤的發生與發展。如造血系統惡性腫瘤、頭頸部鱗狀細胞癌、前列腺癌、皮膚癌,乳腺癌等。由此可見RSK2是一個很有潛力的抗癌靶標。然而縱觀近些年來發現或合成的RSK2抑制劑,可以發現這些抑制劑的選擇性不高。撇開非特異性的抑制劑如GF109203X和Ro31-8220不談,具有相對特異性的抑制劑選擇性也不是特別高,比如說BI-D1870和SL0101無法區分RSK家族的其它成員,特異性比較高的抑制劑如FMK除可抑制RSK2外還可抑制RSK1,山奈酚除可抑制RSK2外還可抑制MSK1。目前還未見RSK2抑制劑應用于臨床的報道。因此研發出高效、特異性好的RSK2抑制劑并能應用于臨床研究應是未來的研究方向之一。另外,據文獻報道,在應用小分子抑制劑于臨床十幾年后發現,病人容易產生抗藥性且易復發。在將小分子抑制劑應用于某些腫瘤后,復發甚至可以說是肯定的[37]。所以RSK2抑制劑要真正進入臨床使用還有很長的路要走。
[1]Anjum R,Blenis J.The RSK family of kinases: emerging roles in cellular signalling[J].Nat Rev Mol Cell Biol,2008,9(10) : 747-758.
[2]Cho YY,Yao K,Pugliese A,et al.A regulatory mechanism for RSK2 NH2-terminal kinase activity[J].Cancer Res,2009,69(10) : 4398-4406.
[3]Arul N,Cho YY.A rising cancer prevention target of RSK2 in human skin cancer[J].Front Oncol,2013,3: 201.
[4]Kang S,Dong S,Gu TL,et al.FGFR3 activates RSK2 to mediate hematopoietic transformation through tyrosine phosphorylation of RSK2 and activation of the MEK/ERK pathway[J].Cancer Cell,2007,12(3) : 201-214.
[7]Xing J,Ginty DD,Greenberg ME.Coupling of the RASMAPK pathway to gene activation by RSK2,a growth factor-regulated CREB kinase[J].Science,1996,273 (5277) : 959-963.
[8]Bruning JC,Gillette JA,Zhao Y,et al.Ribosomal subunit kinase-2 is required for growth factor-stimulated transcription of the c-Fos gene[J].Proc Natl Acad Scie U S A,2000,97(6) : 2462-2467.
[9]Yang TT,Xiong Q,Graef IA,et al.Recruitment of the extracellular signal-regulated kinase/ribosomal S6 kinase signaling pathway to the NFATc4 transcription activation complex[J].Mol Cell Biol,2005,25(3) : 907-920.
[10]Cho YY,Yao K,Bode AM,et al.RSK2 mediates muscle cell differentiation through regulation of NFAT3[J].J Biol Chem,2007,282(11) : 8380-8392.
[11]Yang X,Matsuda K,Bialek P,et al.ATF4 is a substrate of RSK2 and an essential regulator of osteoblast biology: implication for Coffin-Lowry syndrome[J].Cell,2004,117(3) : 387-398.
[12]Wingate AD,Campbell DG,Peggie M,et al.Nur77 is phosphorylated in cells by RSK in response to mitogenic stimulation[J].Biochem J,2006,393(Pt 3) : 715-724.
[13]Peng C,Cho YY,Zhu F,et al.RSK2 mediates NF-κB activity through the phosphorylation of IκBα in the TNFR1 pathway[J].FASEB J,2010,24(9) : 3490-3499.
[14]She QB,Ma WY,Zhong S,et al.Activation of JNK1,RSK2,and MSK1 is involved in serine 112 phosphorylation of Bad by ultraviolet B radiation[J].J Biol Chem,2002,277(27) : 24039-24048.
[15]Anjum R,Roux PP,Ballif BA,et al.The tumor suppressor DAP kinase is a target of RSK-mediated survival signaling[J].Curr Biol,2005,15(19) : 1762-1767.
[16]Lee CJ,Lee MH,Lee JY,et al.RSK2-induced stress tolerance enhances cell survival signals mediated by inhibition of GSK3β activity[J].Biochem Biophys Res Commun,2013,440(1) : 112-118.
[17]Jaballah M,Mohamed IA,Alemrayat B,et al.Na+/H+exchanger isoform 1 induced cardiomyocyte hypertrophy involves activation of p90 ribosomal S6 kinase[J].PLoS One,2015,10(4) : e0122230.
[18]Fujita N,Sato S,Tsuruo T.Phosphorylation of p27Kip1at threonine 198 by p90 ribosomal protein S6 kinases promotes its binding to 14-3-3 and cytoplasmic localization [J].J Biol Chem,2003,278(49) : 49254-49260.
[19]Kang S,Elf S,Lythgoe K,et al.p90 ribosomal S6 kinase 2 promotes invasion and metastasis of human head and neck squamous cell carcinoma cells[J].J Clin Invest,2010,120(4) : 1165-1177.
[20]Kang S,Elf S,Dong S,et al.Fibroblast growth factor receptor 3 associates with and tyrosine phosphorylates p90 RSK2,leading to RSK2 activation that mediates hematopoietic transformation[J].Mol Cell Biol,2009,29(8) : 2105-2117.
[21]Kang S,Chen J.Targeting RSK2 in human malignancies [J].Expert Opin Ther Targets,2011,15(1) : 11-20.
[22]Clark DE,Errington TM,Smith JA,et al.The serine/ threonine protein kinase,p90 ribosomal S6 kinase,is an important regulator of prostate cancer cell proliferation [J].Cancer Res,2005,65(8) : 3108-3116.
[23]Cho YY,Lee MH,Lee CJ,et al.RSK2 as a key regulator in human skin cancer[J].Carcinogenesis,2012,33 (12) : 2529-2537.
[24]Bosch A,Eroles P,Zaragoza R,et al.Triple-negative breast cancer: molecular features,pathogenesis,treatment and current lines of research[J].Cancer Treat Rev,2010,36(3) : 206-215.
[25]Stratford AL,Reipas K,Hu K,et al.Targeting p90 ribosomal S6 kinase eliminates tumor-initiating cells by inactivating Y-box binding protein-1 in triple-negative breast cancers[J].Stem Cells,2012,30(7) : 1338-1348.
[26]Nguyen TL.Targeting RSK: an overview of small molecule inhibitors[J].Anticancer Agents Med Chem,2008,8 (7) : 710-716.
[27]Sapkota GP,Cummings L,Newell FS,et al.BI-D1870 is a specific inhibitor of the p90 RSK (ribosomal S6 kinase) isoforms in vitro and in vivo[J].Biochem J,2007,401 (1) : 29-38.
[28]Roberts NA,Haworth RS,Avkiran M.Effects of bisindolylmaleimide PKC inhibitors on p90RSKactivity in vitro and in adult ventricular myocytes[J].Br J Pharmacol,2005,145(4) : 477-489.
[29]Krishnan S,Miller RM,Tian B,et al.Design of reversible,cysteine-targeted Michael acceptors guided by kinetic and computational analysis[J].J Am Chem Soc,2014,136(36) : 12624-12630.
[30]London N,Miller RM,Krishnan S,et al.Covalent docking of large libraries for the discovery of chemical probes [J].Nat Chem Biol,2014,10(12) : 1066-1072.
[31]Yao K,Chen H,Liu K,et al.Kaempferol targets RSK2 and MSK1 to suppress UV radiation-induced skin cancer [J].Cancer Prev Res (Phila),2014,7(9) : 958-967.
[32]Liu K,Cho YY,Yao K,et al.Eriodictyol inhibits RSK2-ATF1 signaling and suppresses EGF-induced neoplastic cell transformation[J].J Biol Chem,2011,286 (3) : 2057-2066.
[33]Derewenda U,Artamonov M,Szukalska G,et al.Identification of quercitrin as an inhibitor of the p90 S6 ribosomal kinase (RSK) : structure of its complex with the N-terminal domain of RSK2 at 1.8resolution[J].Acta Crystallogr D Biol Crystallogr,2013,69(Pt 2) : 266-275.
[34]Costales A,Mathur M,Ramurthy S,et al.2-Amino-7-substituted benzoxazole analogs as potent RSK2 inhibitors [J].Bioorg Med Chem Lett,2014,24(6) : 1592-1596.
[35]Zhong Y,Xue M,Zhao X,et al.Substituted indolin-2-ones as p90 ribosomal S6 protein kinase 2 (RSK2) inhibitors: molecular docking simulation and structure-activity relationship analysis[J].Bioorg Med Chem,2013,21 (7) : 1724-1734.
[36]Nguyen TL,Gussio R,Smith JA,et al.Homology model of RSK2 N-terminal kinase domain,structure-based identification of novel RSK2 inhibitors,and preliminary common pharmacophore[J].Bioorg Med Chem,2006,14(17) : 6097-6105.
[37]Dobbelstein M,Moll U.Targeting tumour-supportive cellular machineries inanticancer drug development[J].Nat Rev Drug Discov,2014,13(3) : 179-196.
(責任編輯:林白霜,羅森)
Progress in association of RSK2 with malignancies and its inhibitors
CHEN Kang-xing1,WANG Zi-you2,HUANG Yan-xia3,ZHONG Cheng-zhi1,LI Kai-heng1,HUANG Zun-nan2
(1The Second Clinical Medical College,2China-American Cancer Research Institute,3School of Public Health,Guangdong Medical University,Dongguan 523808,China.E-mail: zn_huang@yahoo.com)
R363
A
10.3969/j.issn.1000-4718.2015.10.008
1000-4718(2015)10-1772-08
2015-04-13
2015-07-14
國家自然科學基金資助項目(No.31160706) ;廣東省高等學校學科與專業建設專項資金(No.2013KJCX0090) ;廣東醫學院大學生創新實驗項目啟動資金(No.LZDS005)
△Tel: 0769-22896049; E-mail: zn_huang@yahoo.com

