副豬嗜血桿菌感染:宿主免疫應答模型與巨噬細胞活化
陳洪波
(武漢輕工大學動物科學與營養工程學院 動物營養與飼料安全湖北省協同創新中心,武漢 430023)
副豬嗜血桿菌感染:宿主免疫應答模型與巨噬細胞活化
陳洪波*
(武漢輕工大學動物科學與營養工程學院 動物營養與飼料安全湖北省協同創新中心,武漢 430023)
副豬嗜血桿菌是當前世界養豬業中最主要的細菌性病原體之一,感染后臨床表現以格拉澤病為典型特征,嚴重威脅著豬群健康,應用層面的防治工作仍存在很多問題。近年來,該細菌毒力因子與宿主免疫應答等相關研究取得了很大進步,但基礎層面宿主-病原互作的分子機制仍不清楚。基于不同豬對該細菌存在遺傳抗性差異,隨著豬基因組科學技術的飛速發展,越來越多的國內外學者正寄希望于分子抗病育種途徑以從根本上解決細菌感染。為此,本文結合作者所在課題組的以往工作通過綜述現有高通量數據初步提出了宿主免疫應答的分子模型,重點探討巨噬細胞活化對細菌感染或宿主保護性免疫應答可能造成的影響,圍繞其中關鍵的分子調控進行了較為深入的分析,旨在為將來發掘具有應用價值的候選基因素材/分子標記提供借鑒。最后,本綜述就下一步相關工作的開展提出了幾點思考。
豬;育種;副豬嗜血桿菌;免疫應答;巨噬細胞
1 副豬嗜血桿菌(Haemophilus parasuis,HPS)感染
1.1 細菌感染與防治工作中存在的突出問題
副豬嗜血桿菌是一種定居在豬上呼吸道部位的革蘭陰性短小桿菌。毒力菌株侵入機體后可導致嚴重系統性炎癥疾病,臨床表現以格拉澤病(Gl?sser’s disease)——血纖維蛋白性心包炎、多發性關節炎、腦膜炎為典型特征[1],有些感染豬還表現出急性肺炎、急性敗血癥等[2]。據作者不完全統計,該傳染病目前在中國20余省份有報道,幾乎呈全國分布的態勢;另外,HPS感染也是歐美等許多國家養豬業中主要的細菌性疾病之一。值得關注的是,流行病學調查結果顯示:HPS和豬其他重大病原體存在共同感染,如豬呼吸與繁殖綜合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)、豬流感病毒(swine influenza viruses,SIV)、豬圓環病毒II型(porcine circovirus type-2,PCV-2)、豬鏈球菌(S.suis)、豬胸膜肺炎放線桿菌(Actinobacilluspleuropneumoniae,APP)、致病性埃希大腸桿菌(E.coli)等[3-5]。國內外已經將HPS感染視為世界養豬業的嚴重威脅[6]。某些抗生素治療[如泰拉霉素(tulathromycin)]對于包括該細菌在內的豬呼吸系統病原體具有一定的作用[7],而最近一些研究表明:有些抗生素對HPS的作用有限,如馬波沙星(marbofloxacin)[8]、恩氟沙星(enrofloxacin)[9]等。需要指出,由于不同國家和地區豬場中HPS毒力株的流行特點、養殖模式和抗生素抗性等方面存在差異,導致同一種抗生素在這些國家和地區間的治療效果可能存在很大差異,這個問題需要引起我們的充分重視。國內外對于抗生素的使用規定十分嚴格,抗生素濫用嚴重威脅食品安全,已經不符合未來養豬業的綠色發展理念。疫苗是目前國內外預防HPS感染的主要途徑之一,但是問題在于:由于HPS毒力菌株存在多種血清型,所以它們對于HPS感染后宿主的交叉保護非常有限[10-11]。最新研究發現,枯草芽孢桿菌(Bacillussubtilis)和昆蟲體內存在一些抗菌肽(antimicrobial peptides,AMPs)成分對HPS具有較好的殺傷作用[12-13],盡管極具應用前景,但相關研究仍停留在實驗室層面。
1.2 抗病育種途徑解決HPS感染的可行性思考
優良品種對畜牧業的貢獻率達到40%,而育種目標并非一成不變,它是隨著社會需求以及現實生產中遇到的問題不斷調整的。過去30多年間,肉質、繁殖、瘦肉率、飼料利用率構成了豬遺傳育種的主要內容,然而最近幾年已經擴展到存活率和疾病抗性等性狀[14]。未來一段時期,豬的遺傳育種將朝著“高產高效、優質、抗性”的目標繼續努力,也就是說在保持(或者繼續改良)傳統經濟性狀的同時需要額外關注疾病抗性性狀。由于抗病育種能夠從根本上改善豬群健康狀態、提高生產效率、解決抗生素等治療性藥物濫用引發的一系列不利問題,因此在國內外正日益引起大家的高度關注。為此,“動物基因組與健康(animal genomics for animal health,AGAH)”國際研討會于2007年首次召開,旨在召集全球相關方向的優秀學者共同探討未來動物健康和抗病育種中的關鍵問題[15]。
豬中,無論是一般抗病力還是特殊抗病力都有其一定的遺傳基礎。格拉澤病連同PRRSV、SIV、PCV-2感染一起,相關抗病育種工作是未來亟待解決的問題[14]。西班牙學者I.Blanco等最近的一項標志性研究發現:不同豬對HPS感染存在抗性/易感差異,這為下一步深入開展遺傳抗性研究提供了依據[16]。但遺憾的是,截至目前HPS感染過程中宿主保護性免疫應答的分子遺傳基礎研究仍十分有限,這與目前高速發展的基因組科學技術極不相稱。緊隨I.Blanco等的報道[16],筆者利用基因芯片技術于2009年首次對HPS感染后豬脾組織差異轉錄組進行了分析[17],開啟了HPS-宿主互作分子機制的系統研究。但這僅僅是一個開始。結合多年來筆者對這一領域的持續關注,簡單介紹目前相關研究進展的基礎上重點探討HPS感染過程中宿主的免疫應答模型及其早期關鍵的細胞應答與分子事件,并就下一步需要著力解決的問題展開討論,希望能夠為國內學者開展相關研究提供借鑒。
2 HPS感染的宿主早期免疫應答模型
系統揭示HPS感染過程中豬關鍵器官尤其是免疫相關器官或組織中的基因差異表達情況是深入理解宿主保護性免疫應答的第一步。在筆者對脾組織的差異轉錄組研究之后,又有實驗室對肺組織和豬肺泡巨噬細胞(porcine alveolar macrophage,PAM)中的轉錄組差異進行了分析[18-19]。與現有技術相比盡管存在一定的局限,但這三項研究很具有代表性,它們涵蓋了豬中最大的二級免疫器官、最大的呼吸器官,以及對于HPS感染非常重要的細胞免疫應答。經過系統總結(主要數據來源[17-19]),筆者首次構建出豬對于HPS感染的基本免疫應答模型(圖1),為下一步深入開展研究提供了重要線索。
寄生在豬呼吸道部位的HPS毒力菌株如果不能通過物理作用(如黏液流動、咳嗽等)被及時清除,則發生細菌定植和侵襲。在肺泡腔會遇到宿主免疫系統的第一道防線——肺泡巨噬細胞(PAM),此外,細菌也可能依賴其毒力蛋白P2和CDT[20-21]經上皮類型細胞侵襲;我們之前的初步分析結果顯示:TLR2-MyD88信號可能在HPS-宿主互作中發揮關鍵作用[22]。PK-15細胞(豬腎上皮細胞)的體外研究模型揭示HPS感染的促炎效應依賴NF-κB[23];促炎因子釋放可導致附近毛細血管中中性粒細胞的募集,但活化中性粒細胞會使豬鈣粒蛋白S100A8、S100A9、S100A12大量釋放形成強烈的促炎正反饋,這些分子有可能作為損傷相關分子模式(damage-associated molecular pattern,DAMP)加劇宿主組織損傷[22];已經證明:S100A8、S100A9、S100A12是人和小鼠關節炎的生物標志物[24],HPS感染后的關節炎病征可能與此有關。但HPS感染同時還上調表達補體基因(C1R、C4BPA)、病原菌識別蛋白基因(PGLYRP1)和抗菌肽基因(SLC11A1、LTF、CAMP);而且宿主同時表現出促炎(IL-1β↑、IL-8↑)和抗炎(IL-10↑、TGF-β↑)兩種效應(圖1)。從這些數據可以看出:HPS感染過程中細菌免疫逃避與宿主保護性應答之間產生對抗。只不過實際情況是:對抗過程中宿主保護性免疫逐漸處于弱勢,最終使HPS感染加重。那么問題關鍵在于:是什么原因導致宿主保護性免疫不能發揮積極作用?

圖中所示基因均在HPS感染后差異表達極顯著All of the genes displayed in the figure are differentially expressed genes following HPS infection 圖1 副豬嗜血桿菌感染過程中豬的免疫應答模型Fig.1 The proposed model for the host immune response during HPS infection
如圖1所示,無論是在肺泡腔還是通過組織上皮侵染,HPS都會遇到巨噬細胞。筆者推測:HPS感染可能導致巨噬細胞免疫發生了不利于細菌有效清除的應答方式。照此,巨噬細胞保護性免疫廢除不僅導致吞噬作用無法殺滅細菌,相反會導致大量細菌擴散,最終結果是細菌廣泛侵襲、組織器官出現炎性損傷(圖1模型)。最具代表性的是RETN(Resistin),該基因在脾[17]、PAM[19]和易感豬[18]中均表現出非常高的上調表達,暗示靶向該基因/蛋白質的藥物可能具有臨床治療意義。細菌擴散和持續感染還可能導致周圍組織中的巨噬細胞對細菌脂多糖(LPS)產生耐受而上調表達IL-10[25],巨噬細胞耐受是一種重要的免疫調節機制,但代價較高,因為IL-10可以強烈抑制Ⅰ類和Ⅱ類抗原遞呈[26-27]。HPS感染導致脾和肺組織中豬MHCⅠ類和MHCⅡ類基因(豬中稱為SLA)顯著下調表達(圖1),有意思的是:它們在抗性豬肺組織中并未被下調[18];與MHC基因下調相呼應,發病豬中參與T細胞活化的基因(如TCRA、DUSP14、VSIG4、GATA3)也被下調(圖1);提示:動物因其細胞免疫和體液免疫被HPS嚴重削弱而最終發病死亡。與之相反,抗性豬由于在感染早期可以有效清除HPS(表現為細胞外基質ECMs及其調節信號TGF-β被上調)而呈現出較強的組織修復能力[18],這種修復還有助于屏蔽HPS經上皮細胞的侵襲途徑。綜上所述,HPS感染后的一系列差異表達基因初步印證了筆者的推測,二者可互相解釋,所以在目前知識背景下巨噬細胞免疫應答可能是理解HPS感染調控的關鍵。
3 宿主巨噬細胞活化與HPS感染
3.1 巨噬細胞替代激活信號及其與細菌易感性
組織微環境中巨噬細胞在先天免疫和獲得性免疫中十分重要,但功能發揮依賴其自身的活化方式。近年發現:巨噬細胞的不同激活方式與人類疾病(包括感染性疾病)密切相關,是機體免疫調節的重要組成[28]。巨噬細胞根據其激活方式分2種:一種是經典激活的巨噬細胞(classically activated macrophages,CAM),即M1型,主要參與保護性促炎反應和抵抗細菌等病原體感染等;另一種是替代激活的巨噬細胞(alternatively activated macrophages,AAM),即M2型,主要參與抑制炎癥和引發纖維性病變等。巨噬細胞替代激活主要依賴IL-4、IL-13和IL-10信號(圖2);它們通過與細胞膜上的受體結合分別激活細胞質內的分子級聯:Jak1-STAT3/STAT6;Jak2-STAT3、Tyk2-STAT1/STAT6;Jak1-STAT3、Tyk2-STAT1。簡言之,胞質內Jak/Tyk-STAT級聯是發生替代激活的關鍵信號:Jak或Tyk激酶誘導STAT(信號傳導與轉錄激活因子)磷酸化并形成二聚物,之后二聚物入核啟動基因轉錄(包括M2型標志基因)、致使巨噬細胞發生表型和功能轉變。此外,IL-4信號下游PI3K(磷酸肌醇-3-激酶)通路還有利于M2型巨噬細胞的增殖和存活。研究發現,人和小鼠中M2型巨噬細胞表達的標志基因存在差異[29],而且同一物種中(人)IL-4信號和IL-13信號啟動的基因轉錄也不完全相同[30],暗示物種間巨噬細胞替代激活的分子信號及其調節可能具有選擇性。小鼠上研究表明,土拉熱桿菌(Francisellatularensis,Ft)感染后小鼠巨噬細胞發生替代激活導致細胞抗菌效應消失和細菌擴散[31];K.Kyrova等利用腸沙門菌(Salmonellaenterica)鼠傷寒血清型(Typhimurium)感染豬肺泡巨噬細胞后也發現了相同的現象(M2↑,M1↓)[32]。
3.2 HPS感染過程中巨噬細胞免疫應答研究進展
HPS感染與豬巨噬細胞的關系早在1998年曾經被初步報道,M.H.Pampusch等發現,PAM體外吞噬HPS后其NO合成酶(iNOS)和亞硝酸鹽水平并未發生變化,并據此得出結論:PAM中活性氮相關信號通路并非清除HPS的關鍵先天免疫應答[34]。幾乎在同一時間,J.Segalés等的研究結果表明:PAM對HPS的吞噬效率很低,并且PRRSV和HPS共同感染PAM時僅僅伴隨其中吞噬溶酶體數量增加,但PAM活化后的殺傷作用有限[35]。與前項研究相比,J.Segalés等似乎將PAM與HPS的互作研究往前推進了一點點,但是他們認為共同感染時PAM活化主要由PRRSV誘導,并未進一步揭示HPS的作用。一項與之類似的研究還表明,HPS感染后導致血液中單核細胞的吞噬能力下降[36]。西班牙A.J.de la Fuente等對HPS感染與單核細胞的關系做了進一步研究,盡管感染導致外周血單核細胞(PBMC)中SWC3+單核細胞和粒細胞數量增加,但這似乎對宿主的免疫保護貢獻甚微[37];隨后該實驗室改進了流式細胞分析策略,與之前結果相似,他們發現:PBMC中CD172a+CD163+單核細胞于感染后顯著增加,但有意思的是,單核細胞組織相容性分子SLAIIDR卻與此同時發生下調表達[38];這似乎仍不能解釋為什么單核/巨噬細胞對HPS的殺傷作用有限,但是至少為深入理解“數量增加但免疫保護力低”提供了很有價值的線索。免疫應答過程中,單核/巨噬細胞除了我們熟知的病原體吞噬作用外還具有“專業化”抗原遞呈能力,尤其是在對外源性抗原的加工遞呈方面。所以,R.Frandoloso等對于HPS感染后細胞免疫應答的最新研究結果[38]與我們之前以及其他實驗室的基因芯片結果[17-19]所揭示的現象一致:細菌感染抑制了宿主免疫細胞的抗原遞呈能力(圖1)。2012年,筆者在系統總結多個實驗室的基因芯片結果時就有了初步構建細菌感染的宿主免疫應答模型的想法,隨后依據模型(圖1)推測:HPS感染可能導致巨噬細胞免疫發生了不利于細菌有效清除的應答方式。值得關注的是,該推測很快被最近的一項研究所初步證實:M.Costa-Hurtado等比較了HPS強毒力株與無毒力株感染后對PAM細胞表型的影響,發現毒力菌株感染后導致巨噬細胞的早期有效免疫應答(活化)被延遲[39]。綜合以上分析,巨噬細胞活化作為一個具體的免疫應答現象與HPS免疫逃避密切相關,可能并不像M.H.Pampusch等[34]認為的那樣:巨噬細胞介導的先天免疫對于清除HPS“不重要”,相反,對于理解格拉澤病分子致病機制“十分重要”。但截至目前相關分子機制仍不清楚。
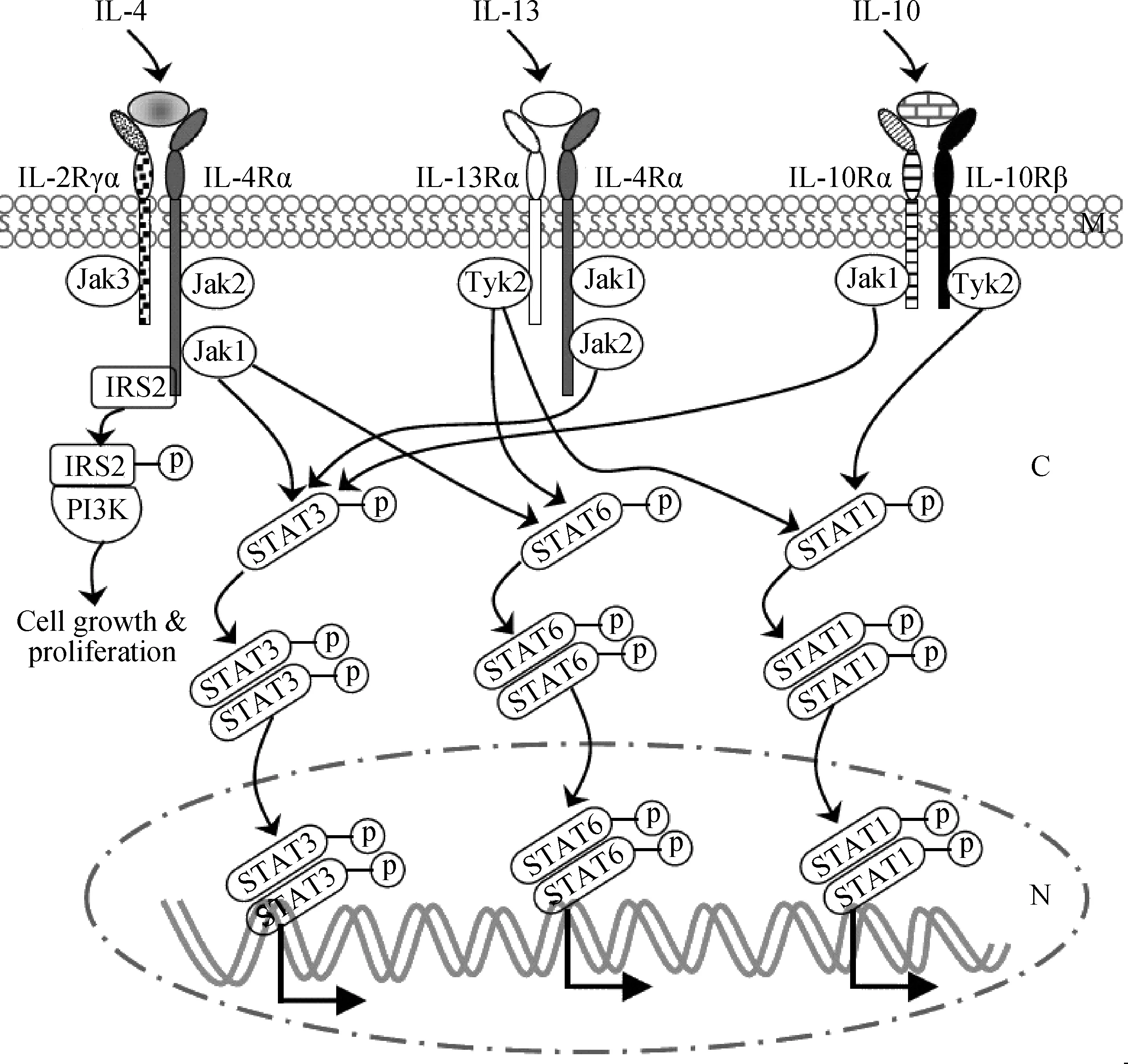
M.細胞膜;C.細胞質;N.細胞核M.Membrane;C.Cytoplasm;N.Nucleus圖2 巨噬細胞替代激活的主要信號通路(人、小鼠)[30,33]Fig.2 Signalings mediating the alternative activation of macrophages
4 HPS感染過程中宿主巨噬細胞活化相關分子表達模式最新進展
為了進一步證明筆者的推測并闡述巨噬細胞活化的重要性,對HPS感染過程中宿主巨噬細胞活化相關分子表達模式做了深入分析。發現:細菌感染后M1型和M2型巨噬細胞的一系列標志基因差異表達,但以M2型為主導(圖3)。脾和PAM中盡管也有M1型標志基因被上調(如FCGR2B、CCL2),但數量較少,而且相關標志基因還被下調(IL1B、IFN-γ)。巨噬細胞激活標志基因在抗性豬(FR)和易感豬(S)之間的差異更有意思:易感豬感染后24和72 h肺中呈現與脾、PAM中類似的情況(M2型占優),而HPS抗性豬與易感豬相比,M2型巨噬細胞明顯減少,尤其在感染早期(24 h)。與脾和PAM相比,肺中差異表達標志存在一定不同,這可能與感染試驗所用組織以及芯片類型有關(詳見圖3中參考文獻)。此外,HPS感染還導致易感豬中STAT3上調表達(+1.8,72 hpi),而抗性豬中PDK4下調表達(-2.5,24 hpi;-2.3,72 hpi);它們均參與巨噬細胞替代激活信號(圖2),其中,STAT3為IL-10誘導的巨噬細胞替代激活所必須[40],PDK4則是銜接PI3K和Akt(位于IL4誘導的替代激活信號下游)的重要分子[33];PDK4在感染發病豬的脾(+7.0)和PAM(+2.2)中均上調表達,這在邏輯上與抗性豬中的情況一致。
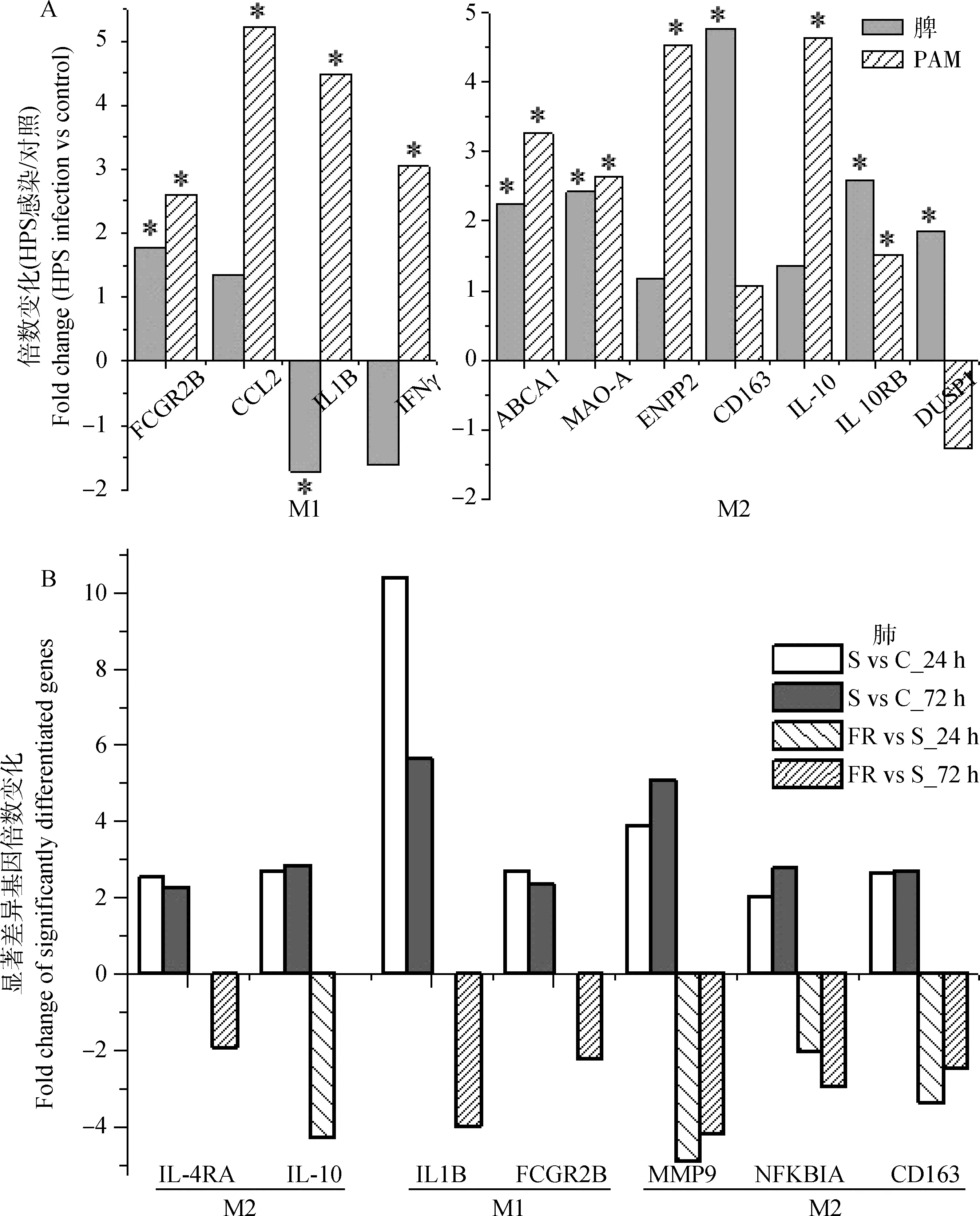
A.脾[17]和PAM[19],6 dpi,“*”表示基因表達較對照組差異極顯著(P<0.01);B.肺[18],24 hpi與72 hpi;S代表HPS易感豬,C代表對照豬,FR代表HPS抗性豬;所示基因均達到顯著差異水平(P<0.01)A.Spleen[17] and PAM[19],6 dpi,“*”:Differentially expressed at the significance level of P<0.01;B.Lung[18],24 hpi and 72 hpi;S:HPS susceptive pigs,C:control,FR:fully resistant pigs;All genes in this figure are differentially expressed at the significance level of P<0.01圖3 HPS感染后巨噬細胞經典激活(M1)與替代激活(M2)標志基因的表達模式Fig.3 Gene expression patterns for classically activated macrophages(M1) and alternatively activated macrophages(M2) after HPS infection
5 ABCA1:巨噬細胞替代激活的重要調控分子
5.1 ABCA1簡介
ABCA1(ATP-binding cassette transporter A1)即ATP結合盒式蛋白1,屬于ATP驅動泵家族成員;該基因于HPS感染后呈顯著上調表達(圖3A);最近研究發現,它不僅是巨噬細胞替代激活的典型標志,還發揮著極其重要的調節作用。L.C.Pradel等研究發現,鼠ABCA1特異性地在Ly6Clow單核細胞和M2型巨噬細胞中表達;而且ABCA1-/-小鼠腹膜巨噬細胞經IL-4(M2型誘導)和INF-γ(M1型誘導)刺激后分別影響到STAT6(↓)和STAT1(↑)的磷酸化水平[41];在人的研究表明,ABCA1通過介導Jak2活化(酪氨酸磷酸化)從而激活STAT3、抑制巨噬細胞促炎反應(IL-1B、IL-6、TNF-α)[42];不僅如此(正調控STAT1、3、6的磷酸化),ABCA1還可以增強小鼠巨噬細胞中TLR4信號依賴的IL-10表達而進一步促使巨噬細胞替代激活[43]。總之,ABCA1是截至目前發現的唯一參與正調巨噬細胞3個替代激活信號(圖2)的關鍵分子。值得指出:與正常小鼠相比,ABCA1-/-小鼠對單核細胞增多性李斯特菌(Listeriamonocytogenes,Lm)的感染抗性明顯增強[44],暗示ABCA1是細菌(或者某些細菌)的易感/抗性基因。
5.2 HPS感染過程中豬ABCA1介導宿主免疫應答的分子調控
關于該基因在人和小鼠中的研究可能不能真實反映豬中的實際情況,但是鑒于前期發現的一系列重要線索,對于豬ABCA1的研究可能非常有意思。筆者發現,豬ABCA1基因在很多器官/組織中廣泛表達,但在不同的組織類型中存在一定差異;其中,在單核/巨噬細胞含量豐富的器官中如脾、肺、肝、胸腺、淋巴結表達量很高,而在胃、皮膚、背肌等組織中表達量很低(圖4),暗示豬ABCA1基因在免疫應答中具有重要作用。HPS感染后(脾)ABCA1參與一系列免疫應答,尤其是吞噬細胞遷移、發育及其相關功能,介導凋亡、炎癥反應和(免疫細胞的)活性氧族產生,此外,ABCA1還參與脂類與糖類等重要細胞代謝(圖5A);豬ABCA1被多種轉錄因子調節,與IL6、CFS2等細胞因子關系密切(圖5B),有意思的是:HPS感染后ABCA1與其他差異表達基因一起調節呼吸系統發育與功能(respiratory system development and function),暗示其對于豬免疫調節的重要作用(圖5C)。至今,豬ABCA1介導巨噬細胞活化的分子機制仍不清楚,深入研究將有助于揭示細菌致病機制和/或宿主保護性免疫的關鍵方面,目前筆者正在開展這部分工作。

圖4 豬ABCA1基因在免疫相關組織中存在較高水平的表達(內參:ACTB)Fig.4 Higher abundance of porcine ABCA1 gene transcriptions in immune related tissues (Internal control:ACTB)

A.ABCA1介導的重要免疫應答與代謝功能;B.ABCA1的轉錄調節(不含microRNA);C.HPS感染過程中豬ABCA1調節呼吸系統發育及相關功能,灰色加亮表示HPS感染后脾中的差異表達基因,其中ABCA1基因及其直接分子關系加粗表示。基因芯片原始數據引自GSE11787[17],分子功能與網絡利用IPA?在線分析、繪制A.Key IRs and metabolism mediated by ABCA1;B.Transcriptional regulations of ABCA1(not include microRNA);C.Porcine ABCA1 regulates “Respiratory System Development and Function” during HPS infection,molecules that highlighted in gray are differentially expressed in porcine spleen following HPS infection,ABCA1 and its direct relationships with other molecules are presented in bold.Raw data involved in the analysis,which is performed by using IPA? software online,is cited from GSE11787[17]圖5 ABCA1的功能、調控與分子網絡分析Fig.5 Functions,regulations,and molecular networks of ABCA1
6 展 望
HPS感染后組織中相關差異表達基因數以千計,它們(上調/下調)必然有其特定的生物學意義并遵循一定的規律(假如排除假陽性因素),其中宿主免疫應答規律處于核心地位,其余諸如代謝、發育、細胞凋亡、組織修復等均隨著宿主的易感或抗性程度而作出對應調整。所以,在基礎研究層面應首先深入理解免疫應答,重點明辨宿主的保護性免疫與細菌免疫逃避對宿主免疫系統造成的破壞。HPS感染后宿主免疫應答涉及到不同層面(先天免疫、抗原遞呈、獲得性免疫)的諸多內容[17-19],它們都是非常重要的,因為免疫系統的各條“戰線”只有“通力合作”才能有效對抗感染。最聰明、最經濟、最有效的宿主總是能夠把病原體控制在感染早期,從而保證機體正常生長發育盡可能地不受牽連,然而自然情況下面對大多數強毒力病原體感染這可能非常困難。但新技術的發展可以把這變成現實。豬分子育種科研工作者在關注“分子”之前如果首先能理解宏觀意義上的“生物現象”可能是一個不錯的策略。來自多個實驗室的數據表明:HPS感染削弱了巨噬細胞的免疫力從而造成豬對細菌易感。鑒于HPS的致病特點以及PAM在呼吸系統感染疾病中的特殊地位,有理由相信巨噬細胞免疫在其中的關鍵作用。盡管可能還不夠全面,但巨噬細胞某些重要調控分子/基因可能是解決問題的突破口。
正如前述,關注巨噬細胞活化并非是唯一內容,如果把它在免疫應答系統中的各種功能“串”起來可能會使我們的認識更深入、全面;此外,近年HPS毒力因子研究方面進展很大[45-47],發現不同血清型間保守的毒力因子對于新型交叉保護疫苗的開發很有價值,反過來,探討這一類毒力因子對宿主巨噬細胞免疫應答乃至其他免疫應答的影響對于抗病育種工作也很有意義;功能基因組、蛋白質組和免疫學諸多新技術可以幫助我們做到這些。與豬其他方面的分子育種相比,抗病育種可能會遇到更多困難和挑戰(例如高投入),不僅僅是分子層面的問題,其落腳點還在于表型;HPS感染的宿主免疫應答與臨床癥狀評分方面目前已經有了一定積累(圖6),這些極具價值的研究為表型評價體系的建立提供了參考。國內存在很多優良抗逆性品種(盡管抗逆性與抗病不能完全等同),有廣闊的挖掘空間。因此,最佳途徑是:從“比較”出發利用科學、易行的感染方案[48-49]做“big work”[15]有望獲得令人振奮和信服的結果。長遠來看,HPS與其他病原體混合感染的現實局面也將不得不面對。
文獻來源:www.ncbi.nlm.nih.gov/pubmedFrom:www.ncbi.nlm.nih.gov/pubmed圖6 HPS感染相關宿主免疫應答與臨床癥狀評分的代表性文獻發表情況Fig.6 Typical publications on host IRs and scoring of HPS infection
致謝:農業動物遺傳育種與繁殖教育部重點實驗室(華中農業大學)趙書紅教授提供的基因芯片原始數據,美國農業部農業研究院動物寄生蟲病研究室(USDA/ARS/APDL)Joan K.Lunney研究員提供IPA基因網絡分析上的便利,武漢輕工大學劉玉蘭教授、張晶博士、郭玲博士等在組織樣本采集上提供的幫助。
[1] OLIVEIRA S,PIJOAN C.Haemophilusparasuis:new trends on diagnosis,epidemiology and control[J].VetMicrobiol,2004,99(1):1-12.
[2] NEDBALCOVA K, SATRAN P, JAGLIC Z, et al.Haemophilusparasuisand Glasser’s disease in pigs:a review[J].VetMed,2006,51:168-179.
[3] FABLET C,MAROIS C,KUNTZ-SIMON G,et al.Longitudinal study of respiratory infection patterns of breeding sows in five farrow-to-finish herds[J].VetMicrobiol,2011,147(3-4):329-339.
[4] YU J, WU J, ZHANG Y, et al.Concurrent highly pathogenic porcine reproductive and respiratory syndrome virus infection acceleratesHaemophilusparasuisinfection in conventional pigs[J].VetMicrobiol, 2012,158(3-4):316-321.
[5] KARG G, BILKEI G.The effect of season and vaccination for Gl?sser’s disease and post-weaning Colibacillosis in an outdoor pig unit endemically infected with virulent strain ofHaemophilusparasuisserotype 5 and pathogenicEscherichiacoli[J].JVetMedBInfectDisVetPublicHealth,2002,49(10):464-468.
[6] XU Z, YUE M, ZHOU R,et al.Genomic characterization ofHaemophilusparasuisSH0165,a highly virulent strain of serovar 5 prevalent in China[J].PLoSOne,2011,6(5):e19631.
[7] NUTSCH R G, HART F J, ROONEY K A, et al.Efficacy of tulathromycin injectable solution for the treatment of naturally occurring swine respiratory disease[J].VetTher,2005,6(2):214-224.
[8] VILALTA C,GALOFRé N,ARAGON V,et al.Effect of marbofloxacin onHaemophilusparasuisnasal carriage[J].VetMicrobiol,2012,159(1-2):123-129.
[9] MACEDO N, ROVIRA A, OLIVEIRA S, et al.Effect of enrofloxacin in the carrier stage ofHaemophilusparasuisin naturally colonized pigs[J].CanJVetRes,2014,78(1):17-22.
[10] BAK H, RIISING H J.Protection of vaccinated pigs against experimental infections with homologous and heterologousHaemophilusparasuis[J].VetRec,2002,151(17):502-505.
[11] BAUMANN G, BILKEI G.Effect of vaccinating sows and their piglets on the development of Gl?sser’s disease induced by a virulent strain ofHaemophilusparasuisserovar 5[J].VetRec,2002,151(1):18-21.
[12] TEIXEIRA M L, DALLA R A, BRANDELLI A.Characterization of an antimicrobial peptide produced byBacillussubtilissubsp.spizezinii showing inhibitory activity towardsHaemophilusparasuis[J].Microbiology,2013,159(Pt5):980-988.
[13] HU H, WANG C,GUO X, et al.Broad activity against porcine bacterial pathogens displayed by two insect antimicrobial peptides moricin and cecropin B[J].MolCells,2013,35(2):106-114.
[14] MELLENCAMP M A, GALINA-PANTOJA L, GLADNEY C D,et al.Improving pig health through genomics:a view from the industry[J].DevBiol(Basel),2008,132:35-41.
[15] BISHOP S C, LUNNEY J K, PINARD-VAN DER LAAN M H, et al.Report from the second international symposium on animal genomics for animal health:critical needs,challenges and potential solutions[J/OL].BMCProc,2011,5(Suppl4):S1.[2014-12-09].http://www.biomedcentral.com/1753-6561/5/S4/S1.
[16] BLANCO I, CANALS A, EVANS G, et al.Differences in susceptibility toHaemophilusparasuisinfection in pigs[J].CanJVetRes,2008,72(3):228-235.
[17] CHEN H, LI C, FANG M, et al.UnderstandingHaemophilusparasuisinfection in porcine spleen through a transcriptomics approach[J/OL].BMCGenomics,2009,10:64.[2014-12-09].http://www.biomedcentral.com/1471-2164/10/64.
[18] WILKINSON J M, SARGENT C A,GALINA-PANTOJA L,et al.Gene expression profiling in the lungs of pigs with different susceptibilities to Gl?sser’s disease[J/OL].BMCGenomics,2010,11:455.[2014-12-09].http://www.biomedcentral.com/1471-2164/11/455.
[19] WANG Y, LIU C, FANG Y, et al.Transcription analysis on response of porcine alveolar macrophages toHaemophilusparasuis[J/OL].BMCGenomics,2012,13:68.[2014-12-09].http://www.biomedcentral.com/1471-2164/13/68.
[20] ZHANG B, HE Y, XU C, et al.Cytolethal distending toxin(CDT) of theHaemophilusparasuisSC096 strain contributes to serum resistance and adherence to and invasion of PK-15 and PUVEC cells[J].VetMicrobiol,2012,157(1-2):237-242.
[21] ZHANG B, XU C, LIAO M.Outer membrane protein P2 of theHaemophilusparasuisSC096 strain contributes to adherence to porcine alveolar macrophages cells[J].VetMicrobiol,2012,158(1-2):226-227.
[22] CHEN H, LUNEEY J K, CHENG L, et al.Porcine S100A8 and S100A9:molecular characterizations and crucial functions in response toHaemophilusparasuisinfection[J].DevCompImmunol,2011,35(4):490-500.
[23] CHEN Y, JIN H, CHEN P, et al.Haemophilusparasuisinfection activates the NF-κB pathway in PK-15 cells through IκB degradation[J].VetMicrobiol,2012,160(1-2):259-263.
[24] FOELL D, WITTKOWSKI H, ROTH J.Mechanisms of disease:a 'DAMP' view of inflammatory arthritis[J].NatClinPractRheumatol,2007,3(7):382-390.
[25] BISWAS S K, LOPEZ-COLLAZO E.Endotoxin tolerance:new mechanisms,molecules and clinical significance[J].TrendsImmunol,2009,30(10):475-487.
[26] DE WAAL MALEFYT R, HAANEN J, SPITS H,et al.Interleukin 10(IL-10) and viral IL-10 strongly reduce antigen-specific human T cell proliferation by diminishing the antigen-presenting capacity of monocytes via downregulation of class II major histocompatibility complex expression[J].JExpMed,1991,174(4):915-924.
[27] FIORENTINO D F,ZLOTNIK A,VIEIRA P,et al.IL-10 acts on the antigen-presenting cell to inhibit cytokine production by Th1 cells[J].JImmunol,1991,146(10):3444-3451.
[28] KARP C L,MURRAY P J.Non-canonical alternatives:what a macrophage is 4[J].JExpMed,2012,209(3):427-431.
[29] GORDON S,MARTINEZ F O.Alternative activation of macrophages:mechanism and functions[J].Immunity,2010,32(5):593-604.
[30] BHATTACHARJEE A,SHUKLA M,YAKUBENKO V P,et al.IL-4 and IL-13 employ discrete signaling pathways for target gene expression in alternatively activated monocytes/macrophages[J/OL].FreeRadicBiolMed,2013,54:1-16.[2014-12-09].http://www.sciencedirect.com/science/article/pii/S0891584912017959.
[31] SHIREY K A, COLE L E,KEEGAN A D,et al.Francisella tularensis live vaccine strain induces macrophage alternative activation as a survival mechanism[J].JImmunol,2008,181(6):4159-4167.
[32] KYROVA K, STEPANOVA H,RYCHLIK I, et al.SPI-1 encoded genes ofSalmonellaTyphimurium influence differential polarization of porcine alveolar macrophagesinvitro[J/OL].BMCVetRes,2012,8:115.[2014-12-09].http://www.biomedcentral.com/1746-6148/8/115.
[33] 吳媛媛,李 龍,沈萍萍.巨噬細胞替代激活及調控[J].中國細胞生物學學報,2011,33(2):197-203. WU Y Y,LI L,SHEN P P.Progress of studies on macrophage alternative activation and its regulation mechanisms[J].ChineseJournalofCellBiology,2011,33(2):197-203.(in Chinese)
[34] PAMPUSCH M S,BENNAARS A M,HARSCH S,et al.Inducible nitric oxide synthase expression in porcine immune cells[J].VetImmunolImmunopathol,1998,61(2-4):279-289.
[35] SEGALéS J,DOMINGO M,BALASCH M,et al.Ultrastructural study of porcine alveolar macrophages infectedinvitrowith porcine reproductive and respiratory syndrome(PRRS) virus,with and withoutHaemophilusparasuis[J].JCompPathol,1998,118(3):231-243.
[36] MüLLER G,K?HLER H,DILLER R,et al.Influences of naturally occurring and experimentally induced porcine pneumonia on blood parameters[J].ResVetSci,2003,74(1):23-30.
[37] DE LA FUENTE A J,GUTIéRREZ-MARTN C B,RODRGUEZ-BARBOSA J I,et al.Blood cellular immune response in pigs immunized and challenged with Haemophilus parasuis[J].ResVetSci,2009,86(2):230-234.
[38] FRANDOLOSO R,MARTNEZ-MARTNEZ S,YUBERO S,et al.New insights in cellular immune response in colostrum-deprived pigs after immunization with subunit and commercial vaccines against Gl?sser’s disease[J].CellImmunol,2012,277(1-2):74-82.
[39] COSTA-HURTADO M,OLVERA A,MARTINEZ-MOLINER V,et al.Changes in macrophage phenotype after infection of pigs withHaemophilusparasuisstrains with different levels of virulence[J].InfectImmun,2013,81(7):2327-2333.
[40] RILEY J, TAKEDA K, AKIRA S, et al.Interleukin-10 receptor signaling through the JAK-STAT pathway.Requirement for two distinct receptor-derived signals for anti-inflammatory action[J].JBiolChem,1999,274(23):16513-16521.
[41] PRADEL L C,MITCHELL A J,ZARUBICA A,et al.ATP-binding cassette transporter hallmarks tissue macrophages and modulates cytokine-triggered polarizationprograms[J].EurJImmunol,2009,39(8):2270-2280.
[42] TANG C, LIU Y, KESSLER P S,et al.The macrophage cholesterol exporter ABCA1 functions as an anti-inflammatory receptor[J].JBiolChem,2009,284(47):32336-32343.
[43] MA L, DONG F, ZAID M, et al.ABCA1 protein enhances Toll-like receptor 4(TLR4)-stimulated interleukin-10(IL-10) secretion through protein kinase A(PKA) activation[J].JBiolChem,2012,287(48):40502-40512.
[44] ZHU X, WESTCOTT M M,BI X, et al.Myeloid cell-specific ABCA1 deletion protects mice from bacterial infection[J].CircRes,2012,111(11):1398-1409.
[45] ZHANG B, TANG C, LIAO M, et al.Update on the pathogenesis ofHaemophilusparasuisinfection and virulence factors[J].VetMicrobiol,2014,168(1):1-7.
[46] COSTA-HURTADO M,ARAGON V.Advances in the quest for virulence factors ofHaemophilusparasuis[J].VetJ,2013,198(3):571-576.
[47] BLACKALL P J, TURNI C.Understanding the virulence ofHaemophilusparasuis[J].VetJ,2013,198(3):549-550.
[48] OLIVEIRA S, GALINA L, BLANCO I,et al.Naturally-farrowed,artificially-reared pigs as an alternative model for experimental infection byHaemophilusparasuis[J].CanJVetRes,2003,67(2):146-150.
[49] BLANCO I, GALINA-PANTOJA L, OLIVEIRA S, et al.Comparison betweenHaemophilusparasuisinfection in colostrums-deprived and sow-reared piglets[J].VetMicrobiol,2004,103(1-2):21-27.
(編輯 白永平)
HaemophilusparasuisInfection:Model for the Host Immune Response and the Macrophage Activation
CHEN Hong-bo*
(HubeiCollaborativeInnovationCenterforAnimalNutritionandFeedSafty,SchoolofAnimalScienceandNutritionalEngineering,WuhanPolytechnicUniversity,Wuhan430023,China)
Haemophilusparasuis(HPS) is one of the main virulent bacteria that threating the pig industry worldwide.HPS infection typically causes serious inflammations,namely Gl?sser’s disease.But there are still many troubles in disease prevention and control.Though much progress has been made in the basic research fields of bacterial virulent factors and host immune responses(IR) recently,the mechanisms of host-bacillus interaction are largely unknown.As the different susceptibilities in pigs exist,genomic selection based on molecular breeding strategy will receiving increasing attention from scientists and commercial breeders.Here,some high through-out data from our and other labs are reviewed in brief and the model for the host IR is proposed.We hypothesize that the activation of macrophage during the early stage of IR may play pivotal roles in determining bacillus escape and/or host protective IRs.In addition,key molecules and pathways involved in the IR of macrophage are discussed,which we hope will be helpful for the marker identifications in objectives of molecular breeding.Still,there is much work to be done and some suggestions are proposed in the article.
pig;breeding;Haemophilusparasuis;immune response;macrophage
10.11843/j.issn.0366-6964.2015.01.001
2014-06-09
武漢市科技局應用基礎研究計劃項目(2013020501010178);湖北省自然科學基金(2013CFB324);國家自然科學基金(31301939)
陳洪波(1981-),男,山東定陶人,講師,博士,主要從事分子生物學與動物育種研究
*通信作者:陳洪波,E-mail:chen_hong_bo@126.com,Tel:027-83956175
S852.61
A
0366-6964(2015)01-0001-11

