Tempol預處理對七氟醚麻醉下老齡大鼠術后認知功能的影響
西安市紅會醫院麻醉科(西安710054)
蘇 晗 張 潔
Tempol預處理對七氟醚麻醉下老齡大鼠術后認知功能的影響
西安市紅會醫院麻醉科(西安710054)
蘇 晗 張 潔
目的:探討Tempol對七氟醚麻醉下老齡大鼠術后認知功能的影響。方法:老齡雄性SD大鼠32只,體重500~600g,20月齡,采用隨機數字表法,分為4組(n=8):正常對照組(C組),Tempol預處理組(T組),七氟醚組(S組)和七氟醚+Tempol組(ST組)。T組和ST組連續3d腹腔注射Tempol 100mg/kg,C組和S組相應給予腹腔注射等容量0.9%生理鹽水,S組和ST組大鼠分別給予連續3d,每天1次,1次4h的七氟醚麻醉,C組和T組僅置于麻醉箱內對照,不進行七氟醚麻醉,采用Morris水迷宮對各組大鼠進行認知功能測定。完成水迷宮行為學測試后,隨機處死4只大鼠采用高爾基染色方進行海馬樹突棘密度測定,剩余4只大鼠處死后采用 ELISA法測定海馬內丙二醛(MDA)和超氧化物歧化酶(SOD)的含量。結果:與C組相比,S組和ST組大鼠游泳路程和逃避潛伏期延長,穿越平臺次數和平臺所在象限停留時間縮短(P< 0.05);與S組相比,ST組大鼠游泳路程和逃避潛伏期縮短,穿越平臺次數和平臺所在象限停留時間增加(P<0.05)。與C組相比,S組海馬內MDA含量升高,SOD含量和樹突棘密度下降(P< 0.05)。與S組相比,ST組海馬內MDA含量下降,SOD含量和樹突棘密度升高(P<0.05)。C組和T組大鼠海內馬MDA和SOD含量及神經元樹突棘密度變化無統計學差異(P>0.05)。結論:Tempol預處理可緩解七氟醚麻醉所引起的老齡大鼠術后認知功能障礙,其機制可能與Tempol抑制氧化應激反應及增加其海馬內樹突棘密度有關。
術后認知功能障礙(Postoperative cognitive dysfunction,POCD)是指術前無認知功能障礙的病人,在麻醉及手術后出現焦慮、記憶受損、語言理解能力和社會融合能力減退為主的并發癥,其中老年患者為易發人群[1]。有研究證實七氟醚可引起老年人術后認知功能障礙,促進淀粉樣蛋白β的寡聚化和纖維體形成,從而抑制認知功能[2-3],其機制在于七氟醚可激活內皮細胞鈣依賴蛋白酶產生大量氧自由基,從而誘發海馬神經元脂質過氧化損傷[4]。Tempol(1-氧-4-羥基-2,2,6,6-四甲基哌啶)作為新型自由基清除劑,具有分子量小,穩定性強及細胞膜通透性好等優點,可清除自由基,抑制脂質過氧化,抑制神經細胞的氧化損傷[5]。有研究表明Tempol預處理來改變腦組織的氧化環境,對缺血缺氧損傷的腦組織神經功能的恢復具有保護作用[6]。本研究旨在探討Tempol對七氟醚麻醉下老齡大鼠術后認知功能的影響,為研究POCD的防治提供可能的理論依據。
材料與方法
1 動物選擇及分組 健康清潔級老齡雄性SD大鼠32只,體重500~600g,20月齡,采用隨機數字表法,將其分為4組(n=8):正常對照組(C組),Tempol預處理組(T組),七氟醚組(S組)和七氟醚+Tempol組(ST組)。
2 Tempol預處理及七氟醚麻醉 T組和ST組連續3d腹腔注射Tempol(Sigma公司,美國) 100mg/kg,C組和S組相應給予腹腔注射等容量0.9%生理鹽水(Baxter制藥公司);腹腔注射后將S組和ST組大鼠置于自制麻醉箱(50cm×30cm×30cm)進行七氟醚麻醉,箱底鋪鈉石灰,麻醉箱放于37℃恒溫水浴箱內。麻醉箱有兩個通氣孔,上孔連接麻醉機,用于通入七氟醚(雅培公司,美國),氧流量2L/min,氧濃度50%,下孔位于對側,連接Ohmeda麻醉氣體監測儀(Datex- Ohmeda公司,芬蘭)監測MAC值維持在2.0MAC。S組和ST組大鼠分別給予連續3d,每天1次,1次4h的七氟醚麻醉,C組和T組僅置于麻醉箱內對照,不進行七氟醚麻醉。常規監測心率、血壓和脈搏血氧飽和度。發生脈搏血氧飽和度低于95%或平均動脈壓下降幅度超過基礎值的20%者從研究中剔除。
3 大鼠認知功能的測定 參考文獻[7]的方法在完成七氟醚麻醉后1d開始對各組大鼠進行認知功能測定。采用ZH0065型Morris水迷宮系統測定認知功能,持續5d,前4d進行定位航行實驗,第5天進行空間探索實驗,實驗均于上午9點開始,維持水溫23℃。將各組大鼠從一個固定入水點面向池壁置入水中,記錄120s內尋找平臺的時間為逃避潛伏期,讓其在平臺上停留30s。若120s內未能找到將其引上平臺停留30s。于第5天撤去隱匿于水中的平臺,將子代大鼠從固定點放入水中,記錄120s內大鼠游過前期放置平臺所在象限的次數(穿越平臺次數)及其在平臺所在象限的停留時間(平臺所在象限停留時間)。整個測試過程中,保證實驗室內燈光和物品擺放等室內環境一致,以排除環境干擾。
4 大鼠海馬內MDA和SOD含量的測定 各組大鼠完成水迷宮行為學測試后,隨機取4只進行迅速斷頭處死后于冰臺上分離海馬,參考文獻[8]采用 ELISA方法測定海馬內MDA和SOD的含量,按25ml·g-1加入相當體積的冰生理鹽水,勻漿器研磨組織,冰浴下超聲波粉碎制成勻漿,4℃離心后取上清液。按ELISA測定試劑盒(武漢博士德生物工程有限公司)說明書步驟進行操作對海馬內MDA和SOD的含量進行測定。采用NK3酶標儀 (Ladsystems公司,芬蘭),測定吸光度OD值的波長為490nm,96孔培養板,對應標準曲線,得出MDA和SOD的含量。
5 大鼠海馬樹突棘密度的測定 各組剩余4只大鼠海馬樹突棘密度測定。采用腹腔內注射10%水合氯醛350mg/kg麻醉后,進行快速灌注Golgi染色。0.5%亞硝酸鈉液快速灌注后用4%多聚甲醛固定1h。隨后媒體液(5%水合氯醛+5%重鉻酸鉀+10%甲醛混合液)慢速灌注,至流出濃厚橘紅色液。開顱取出大腦半球,從前中1/3處向后取組織塊,修塊后將其浸泡于媒染液中,置于37℃溫箱內24h,用1%硝酸銀染色浸泡鍍銀后,置于37℃溫箱內3d,更換鍍銀液1次/d。冰凍切片機連續切片,厚度100μm,切片經2%重鉻酸鉀溶液及蒸餾水漂洗,依次脫水、透明、封片。在光鏡下進行采圖。在每只大鼠的背側海馬水平CAl進行樹突棘密度分析,隨機選擇10個的椎體細胞,觀察其第二級頂樹突,以每10μm為計數單位,每個細胞觀察3支分支。于LEICA顯微鏡×1000油鏡下進行采圖計數,最終數據以每10μm長度的樹突棘個數為表現。
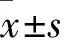
結 果
1 大鼠生理指標變化 各組大鼠在麻醉處理過程中血氧飽和度均>95%,心率及平均動脈壓與其基礎值比較無差異,呼吸均勻,膚色紅潤,血糖均維持在正常范圍內。
2 大鼠水迷宮行為學指標變化 見表1。與C組相比,S組和ST組大鼠游泳路程和逃避潛伏期延長,穿越平臺次數和平臺所在象限停留時間縮短(P< 0.05)。與S組相比,ST組大鼠游泳路程和逃避潛伏期縮短,穿越平臺次數和平臺所在象限停留時間增加(P<0.05)。C組和T組大鼠水迷宮行為學指標變化指標比較無統計學差異(P>0.05)。

表1 各組大鼠水迷宮行為學指標變化的比較
注:與C組比較,aP<0.05;與S組比較,bP<0.05
3 大鼠海內馬MDA和SOD含量及神經元樹突棘密度變化 見表2。與C組相比,S組海馬內MDA含量升高,SOD含量和樹突棘密度下降(P< 0.05)。與S組相比,ST組海馬內MDA含量下降,SOD含量和樹突棘密度升高(P<0.05)。C組和T組大鼠海內馬MDA和SOD含量及神經元樹突棘密度變化無統計學差異(P>0.05)。

表2 大鼠海內馬MDA和SOD含量及神經元樹突棘密度變化的比較
注:與C組比較,aP<0.05;與S組比較,bP<0.05
討 論
本研究的實驗模型是選用易在麻醉后出現POCD老年大鼠作為對象,并在濃度較高的七氟醚進行長時間多次麻醉后,檢測水迷宮行為學證實出現了POCD,從而探討Tempol的保護作用及機制。各組大鼠麻醉期間生理指標均在正常范圍內,無低血糖發生,排除了生理性干擾對其影響。
七氟醚以其起效快、排出快,肌松效果良好,麻醉效果確切,對循環和呼吸功能抑制輕等特點,廣泛應用于老年患者的臨床麻醉中。研究表明七氟醚能通過促進腦內β淀粉樣單體寡聚化的作用引起海馬內tau蛋白過度磷酸化,使其喪失生理功能,引起POCD[9],同時,七氟醚亦可激活內皮細胞鈣依賴蛋白酶產生大量氧自由基[5]。突觸可塑性障礙均可導致認識功能障礙,樹突表面的樹突棘是形成突觸的具體位點,在神經元信息傳遞和加工中起至關重要的作用[10],七氟醚可抑制突觸后膜乙酰膽堿突觸的傳遞,從而抑制了突觸可塑性[11]。本研究結果顯示單純七氟醚麻醉組麻醉后出現嚴重的認知功能障礙,海馬內MDA含量升高且樹突棘密度減少,與前人研究結果一致。
Tempol是的SOD擬似物,具有分子量小,穩定性強,細胞膜通透性好等特點,對脊髓,肝臟,腎臟的缺血再灌注損傷具有保護作用[12]。本研究證實給予Tempol預處理后大鼠的學習記憶能力明顯改善,說明抗氧化劑Tempol能夠改善七氟醚所致POCD大鼠的學習記憶能力。此外,由于七氟醚所致POCD特征性病理改變之一是海馬內氧化應激損傷和樹突棘減少,因此我們檢測了氧化應激損傷和保護的標志物MDA和SOD以及樹突棘密度的變化。我們的實驗結果顯示給予Tempol預處理能夠明顯改善大鼠七氟醚所致的氧化應激損傷而提高保護性物質SOD的含量,并增加神經元樹突棘密度。因此,我們推測Tempol可能通過對抗了氧化應激損傷及增加樹突棘密度,從而改善了大鼠的學習記憶能力,產生治療七氟醚麻醉下老齡大鼠術后認知功能的效果。
綜上所述,Tempol預處理可緩解七氟醚麻醉所引起的老齡大鼠POCD,其機制可能與Tempol抑制氧化應激反應及增加其海馬內樹突棘密度有關。
[1] Hovens IB, Schoemaker RG, van der Zee EA,etal.Postoperative cognitive dysfunction:Involvement of neuroinflammation and neuronal functioning[J].Brain Behav Immun, 2014, 38:202-210.
[2] Hu N,Guo D,Wang H,etal.Involvement of the blood-brain barrier opening in cognitive decline in aged rats following orthopedic surgery and high concentration of sevoflurane inhalation[J]. Brain Res,2014,1551:13-24.
[3] Rortgen D. Kloos J. Fries M,etal. Comparison of early cognitive function and recovery after desflurane or sevoflurane anaesthesia in the elderly:a double-blinded randomized controlled trial[J]. Br J Anaesth,2010, 104(2):167-174.
[4] 杜敏逸,劉毓和,吳新民. 反復吸入七氟醚對老年大鼠認知功能的影響[J].中華麻醉學雜志,2009,29(3):233-235.
[5] Xiong Y, Singh IN, Hall ED. Tempol protection of spinal cord mitochondria from peroxynitrite-induced oxidative damage[J]. Free Radic Res, 2009, 43(6): 604-612.
[6] 曹巖巖,孟凌新,趙柏松.Tempol預處理對大鼠心肺復蘇后腦內HIF-1α及VEGF變化的影響[J].廣東醫學,2014,35(4):497-500.
[7] 李夢圓,趙為祿,湯 洋,等.孕早期七氟醚麻醉對子代大鼠認知功能的影響[J].中華麻醉學雜志,2011,31(12):1431-1433.
[8] Zhao BS, Ding YY, Meng LX,etal. Hyperbaric oxygen treatment produces an antinociceptive response phase and inhibits astrocyte activation and inflammatory response in a rat model of neuropathic pain[J]. J Mol Neurosci,2014,53(2):251-261.
[9] Lu Y,Wu X,Dong Y,etal.Anesthetic sevoflurane causes neurotoxicity differently in neonatal naive and Alzheimer disease transgenic mice[J]. Anesthesiology,2001,112(6):1404-1416.
[10] Glynn IM. A hundred years of sodium pumping[J]. Annu Rev Physiol ,2002, 64:1-18.
[11] Zheng H,Dong Y,Xu Z,etal. Sevoflurane Anesthesia in Pregnant Mice Induces Neurotoxicity in Fetal and Offspring Mice[J]. Anesthesiology,2013,118(3):516-526.
[12] Rak R,Chao DL,P1uta RM,etal.Neuroprotection by the stable nitroxide Tempol during reperfusion in a rat model of transient focal ischemia[J]. J Neurosurg, 2000, 92:646-651.
(收稿:2014-09-17)
甲醚類 麻醉 認知障礙 氧化性應激 樹突棘 自由基清除劑 @ Tempol
R614.2
A
10.3969/j.issn.1000-7377.2015.02.008

