沉淀法回收氧化酸浸—絡合法浸出液中的銻和銅
楊慧芬 張瑩瑩 王傳龍 譚海偉 孟家樂
(1.北京科技大學土木與環境工程學院,北京100083;2.金屬礦山高效開采及安全教育部重點實驗室,北京100083)
鉛渣煤基直接還原—磁選尾礦中含有銻、銅等有價組分,經氧化酸浸—絡合法浸出后,其所含的銻、銅以離子形式進入浸出液[1],具有較高的回收價值。從浸出液中回收銅的方法主要有萃取法、化學沉淀法、置換沉積法、電沉積法、離子交換吸附法等。謝曉峰等[2]采用N902 萃取劑從銅渣氯化煙塵鹽酸浸出液中萃取回收銅,獲得了銅回收率達98.51% 的指標。王海云等[3]采用ZJ988 溶劑從鉛冰銅浸出液中萃取分離銅,獲得了銅回收率為98.13%的指標。李志仁等[4]采用Na2S 法從高酸濕法煉鋅渣浸出液中分離回收銅,得到了銅品位、回收率分別為19.71%、89.04%的銅精礦。許玉東等[5]采用廢鐵片從線路板污泥酸浸液中置換回收銅,得到了銅品位、回收率分別為98.96%、91.82%的海綿銅。Amélie Janin 等[6]采用電沉積方法從含鉻砷酸銅酸浸液中回收銅,得到了銅回收率99%以上的純金屬銅。Amélie Janin 等[7]采用螯合、強酸性樹脂聯合方法從含鉻砷酸銅酸浸液中回收銅、鉻,銅、鉻的回收率分別達到96%和68%。從浸出液中回收銻主要采用沉淀回收法。徐潤澤等[8]采用雙氧水氧化沉淀法從銅陽極泥分銀渣低溫堿性還原熔煉浸出液中直接制取銻酸鈉,獲得了銻沉淀率99%、質量符合HG/T 3254—2001 的一級銻酸鈉產品。鄭雅杰等[9]采取水解沉淀法從漂浮陽極泥鹽酸浸出液中回收銻,獲得了銻品位、回收率分別為50.41%、94.2%的銻產品。Yang Jianguang 等[10]采用水解沉淀法從輝銻礦氯化—氧化浸出液中回收銻,獲得了Sb2O3含量99.9%的高純Sb2O3產品。
從浸出液中同時回收銻、銅的文獻較少。Espen Mariussen 等[11]比較了木炭、橄欖石+ 鐵粉、氫氧化鐵3 種物質對小型武器靶場廢水中銅、銻、鉛的吸附作用,發現木炭對其中銅、銻、鉛的吸附率分別是84%、66%、85%,氫氧化鐵的相應吸附率分別是58%、78%、69%,橄欖石+5%鐵粉的相應吸附率分別是81%、87%、36%。木炭對銻的吸附率較低,對銅、鉛的吸附率較高,而氫氧化鐵對銅、鉛的吸附率較低,對銻的吸附率較高。為此,Espen Mariussen 等[12]綜合木炭、氫氧化鐵的特點,采用木炭和氫氧化鐵分步對靶場廢水進行聯合吸附,取得了銅、銻、鉛吸附率分別為89%、90%、93%的良好指標。鑒于沉淀法是比較常見的回收浸出液中銻、銅的方法,本研究采用水解沉淀—Na2S 沉淀法分步對浸出液中的銻、銅進行回收研究,以期對這種浸出液中銅、銻的回收提供技術支持。
1 試驗原料與試驗方法
1.1 試驗原料
試驗所用浸出液為廣西河池某冶煉廠鼓風爐水淬鉛渣經煤基直接還原—磁選、尾礦經氧化酸浸—絡合法浸出獲得的含銻、銅浸出液,其pH <1.5。表1為采用電感耦合等離子發散光譜儀測得的浸出液中主要元素含量。
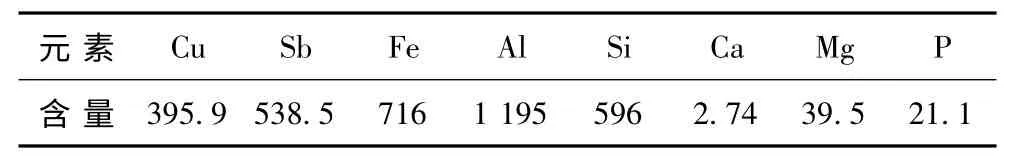
表1 浸出液中主要元素含量Table 1 Main element contents of treated Leachatemg/L
由表1 可見,浸出液中Al、Fe、Sb、Cu、Si 含量較高,Ca、Mg、P 等元素含量較低。其中,Al、Fe、Sb、Cu、Ca、Mg 以陽離子形式存在[1],Si 以Si(OH)4形式存在[13],P 以H2PO4-形式存在。由于Si 在浸出液中含量高,Si(OH)4的溶解度很低,因此,很容易析出。此外,浸出液中還含有浸出過程加入的硫酸根、酒石酸根離子,濃度分別為160 mg/L、25 mg/L。
1.2 試驗原理和方法
不同pH 條件下,浸出液中離子水解能力不同。表2 為浸出液中主要陽離子的氫氧化物水解溶度積及其水解起止pH 值[14]。

表2 浸出液中主要陽離子的水解產物及溶度積及水解起止pH 值Table 2 Main cationic hydrolysate solubility product in leachate and its hydrolysis initial and final pH value
由表2 可見,Sb3+發生水解的pH 范圍為0.98 ~1.87,大大低于浸出液中其他陽離子水解的pH 范圍,Cu2+發生水解的pH 范圍雖大大低于Ca2+、Mg2+,但與Fe3+、Al3+的部分水解pH 范圍重疊,說明Sb3+可采用水解沉淀法回收,Cu2+則不能。而Cu2+極易與Na2S 生成CuS 沉淀,Al3+、Fe3+、Ca2+、Mg2+與S2-反應生成的產物溶度積較大,即較難生成相應的硫化物沉淀,因此可采用Na2S 沉淀法回收沉銻殘余液中的銅。本研究先采用堿性較低的氨水調節浸出液pH,使Sb3+發生水解,生成Sb(OH)3沉淀回收銻,再向沉銻殘余液中添加Na2S,使Cu2+生成CuS沉淀回收銅,試驗流程見圖1。試驗中用品位和沉淀率指標衡量產品的回收效果。在水解沉銻階段,銻沉淀率越高,銻、銅沉淀率差值越大,表明銻的回收率越高,銅、銻的分離效果越好。在Na2S 沉淀銅階段,銅沉淀率越高,表明銅的回收率越高。由于Si(OH)4在pH=0 ~9 范圍內溶解度均很低,水解沉淀回收銻和Na2S 沉淀回收銅的過程均極易析出,將影響沉淀產品的純度。
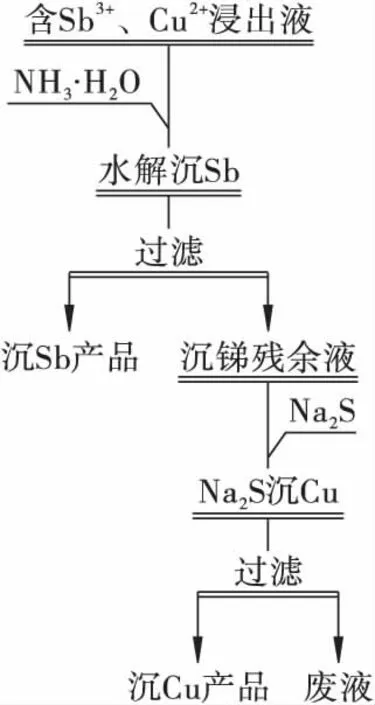
圖1 試驗流程Fig.1 Experiment process
2 試驗結果與討論
2.1 水解沉淀回收銻
2.1.1 反應終了pH 對浸出液中Sb 沉淀的影響
在反應溫度為50 ℃、反應時間為25 min、攪拌速度為500 r/min 條件下,考察反應終了pH 對浸出液中Sb 沉淀的影響,結果見圖2。

圖2 反應終了pH 對Sb 沉淀的影響Fig.2 Effect of reaction end pH on precipitation of Sb ion
由圖2 可見:隨著反應終了pH 的提高,Sb、Cu 的沉淀率均迅速提高后趨于穩定;沉淀物Sb 品位在pH=2.42 時達到最大值,為18.05%,沉淀物Cu 品位隨pH 的升高逐漸提高;當pH=6.29 時,Sb 的沉淀率達到99.53%,此時Cu 的沉淀率為69.67%。為了盡量減少Cu 在Sb 沉淀物中的損失,同時考慮生產成本,確定反應終了pH 為3.15,此時Sb、Cu 的沉淀率分別為77.76%、3.23%。
2.1.2 反應溫度對浸出液中Sb 沉淀的影響
在反應終了pH =3.15、攪拌強度為500 r/min、反應時間為25 min 條件下,考察反應溫度對浸出液中Sb 沉淀的影響,結果見圖3。

圖3 反應溫度對Sb 沉淀的影響Fig.3 Effect of reaction temperature on precipitation of Sb ion
由圖3 可見:隨著反應溫度的升高,Sb 沉淀率小幅升高,Cu 沉淀率變化不明顯,沉淀物Sb 品位先升高后降低。因此,選定反應溫度為56 ℃,此時Sb、Cu的沉淀率分別為81.05%、2.42%,沉淀物的Sb 品位為11.75%、Cu 品位僅0.26%。
2.1.3 反應時間對浸出液中Sb 沉淀的影響
在反應終了pH =3.15、攪拌強度為500 r/min、反應溫度為56 ℃條件下,考察反應時間對浸出液中Sb 沉淀的影響,結果見圖4。
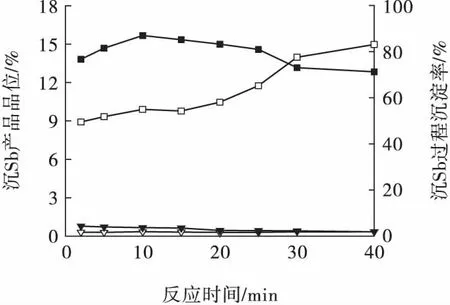
圖4 反應時間對Sb 沉淀的影響Fig.4 Effect of reaction time on precipitation of Sb ion
由圖4 可見:隨著反應時間的延長,Sb 沉淀率先略有上升后逐漸降低,沉淀物的Sb 品位逐漸提高,而Cu 的沉淀率略有降低,沉淀物的Cu 品位變化不大。試驗過程發現,延長反應時間,沉淀物的粒度不但沒有增大,還會增加沉淀物過濾的難度,部分微細沉淀物難以截留,造成Sb 的沉淀率下降。綜合而言,選定反應時間為20 min,此時Sb、Cu 的沉淀率分別為83.29%、2.47%。
2.1.4 攪拌強度對浸出液中Sb 沉淀的影響
在反應終了pH =3.15、反應溫度為56 ℃、反應時間為20 min 條件下,考察攪拌強度對浸出液中Sb沉淀的影響,結果見圖5。
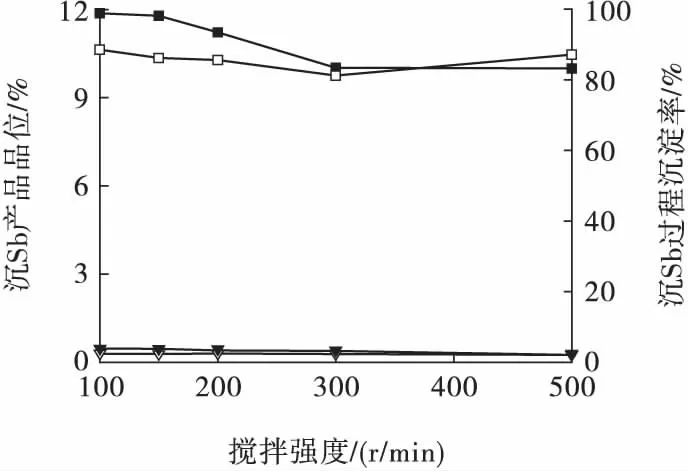
圖5 攪拌強度對Sb 沉淀的影響Fig.5 Effect of stirring speed on precipitation of Sb ion
由圖5 可見:隨著攪拌強度的增大,Sb、Cu 的沉淀率逐漸降低,而沉淀物的Sb、Cu 品位變化不明顯。試驗過程發現:攪拌強度較低時,生成的沉淀物粒度較大,易于過濾,但沉淀物粒度均勻性較差;攪拌強度≥300 r/min 時,生成的沉淀物粒度較細且均勻,濾液中損失的細粒沉淀物較多。綜合而言,選定攪拌強度為150 r/min,此時Sb、Cu 的沉淀率分別為98.23%、3.84%,沉淀物的Sb、Cu 品位分別為10.35%、0.30%。水解沉淀生成的Sb 產品由于混入大量硅酸,采用重力方法較難過濾,宜采用離心方式過濾。
2.2 Na2S 沉淀法回收沉銻殘余液中Cu
Na2S 沉淀法回收沉銻殘余液中Cu 時的攪拌強度均采用150 r/min。
2.2.1 反應終了pH 對Cu 沉淀的影響
S2-在溶液中的存在狀態和有效濃度受溶液pH的影響。為了有效提高S2-在反應過程的利用率,首先考察反應終了pH 對Cu 沉淀的影響。在Na2S 用量為1.0 g/L、反應溫度為56 ℃、反應時間為20 min、反應后無靜置條件下進行試驗,結果見圖6。

圖6 反應終了pH 對Cu 沉淀的影響Fig.6 Effect of reaction end pH on precipitation of Cu ion
由圖6 可見:隨著反應終了pH 的提高,Cu 的沉淀率略有升高,但沉淀物Cu 品位卻迅速下降;pH 從3.32(未添加pH 調整劑的沉銻殘液pH)升高到8.33,Cu 沉淀率從90.88%提高到99.63%,而沉淀物Cu 品位則從43.09%降低到3.48%。要獲得Cu品位較高的產品,pH 越小越好,因此選取不添加pH調整劑的方法沉淀Cu。
2.2.2 Na2S 用量對Cu 沉淀的影響
在反應溫度為56 ℃、反應時間為20 min、反應后無靜置條件下,考察Na2S 用量對Cu 沉淀的影響,結果見圖7。

圖7 Na2S 用量對Cu 沉淀的影響Fig.7 Effect of Na2S usage on precipitation of Cu ion
由圖7 可見:隨著Na2S 用量的增加,Cu 沉淀率小幅上升,而沉淀物Cu 品位迅速降低;Na2S 用量從1.0 g/L 升高到5.0 g/L,Cu 品位從43.09%下降到8.40%,而Cu 沉淀率僅從90.88%提高到98.27%。綜合考慮,選擇Na2S 用量為2.5 g/L,此時Cu 沉淀率為95.40%、沉淀物Cu 品位為35.37%。
2.2.3 反應溫度對Cu 沉淀的影響
在Na2S 用量為2.5 g/L、反應時間為20 min、反應后無靜置條件下,考察反應溫度對Cu 沉淀的影響,結果見圖8。
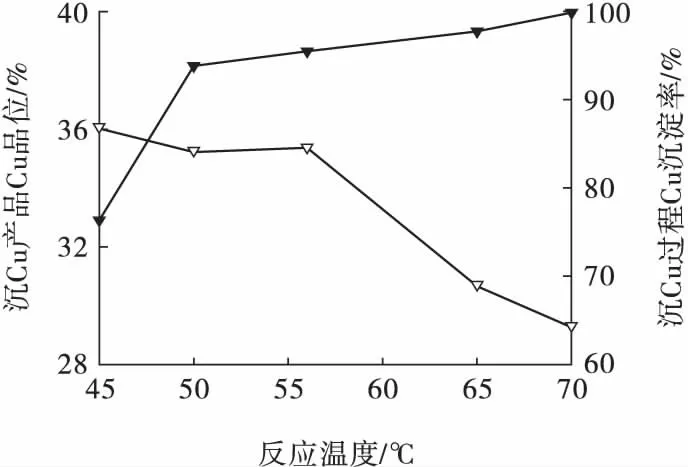
圖8 反應溫度對Cu 沉淀的影響Fig.8 Effect of reaction temperature on precipitation of Cu ion
由圖8 可見:隨著反應溫度的升高,Cu 沉淀率逐漸提高,沉淀物Cu 品位逐漸降低;當反應溫度大于56 ℃時,Cu 品位降幅增大,而Cu 沉淀率提高幅度較小。綜合考慮,確定反應溫度為50 ℃,此時Cu 沉淀率為93.86%、沉淀物Cu 品位為35.22%。
2.2.4 反應時間對Cu 沉淀的影響
在Na2S 用量為2.5 g/L、反應溫度為50 ℃、反應后無靜置條件下,考察反應時間對Cu 沉淀的影響,結果見圖9。
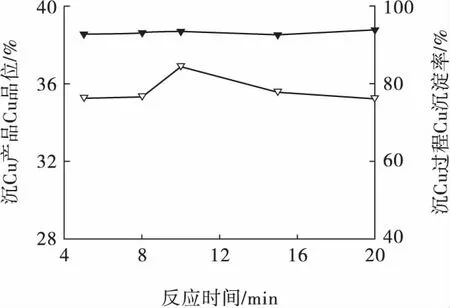
圖9 反應時間對Cu 沉淀的影響Fig.9 Effect of reaction time on precipitation of Cu ion
由圖9 可見,隨著反應時間的延長,Cu 沉淀率變化不明顯,沉淀物Cu 品位先小幅升高后降低。試驗過程發現:隨著反應時間的延長,沉淀物逐漸形成細小而均勻的顆粒,過濾難度提高;反應時間為15 min時,反應液自然分層,固液分離容易,但分離產生的濾液含有細小的黑色顆粒,造成了Cu 的損失;反應時間為20 min 時,雖然濾液中未見黑色顆粒,但反應液不分層,較難過濾。綜合而言,確定反應時間為10 min,此時Cu 沉淀率為93.48%、沉淀物Cu 品位為36.88%。
2.2.5 靜置時間對Cu 沉淀的影響
為提高沉淀物的過濾效果,減少Cu 的損失,在Na2S 用量為2.5 g/L、反應溫度為50 ℃、反應時間為10 min 條件下,考察反應后靜置時間對Cu 沉淀的影響,結果見圖10。

圖10 靜置時間對Cu 沉淀的影響Fig.10 Effect of reaction time on precipitation of Cu ion
由圖10 可見,隨著靜置時間的延長,Cu 沉淀率逐漸提高,而沉淀物Cu 品位無明顯變化。試驗過程發現:靜置10 min 時,濾液中仍見黑色細小的CuS 顆粒;靜置時間大于20 min 時,濾液才清澈透明,且沉淀物的過濾速度顯著提高。因此,確定靜置20 min后進行過濾,此時Cu 沉淀率為98.38%、沉淀物Cu品位為36.92%,產品外觀黑色,可直接送冶煉廠作為銅冶煉原料使用。
回收了銻、銅的殘余廢液,其pH =3.63,Cu2+、Sb3+濃度分別為0.32 mg/L、3.41 mg/L,可部分返回本流程,部分返回鉛渣煤基直接還原—磁選尾礦氧化酸浸—絡合法浸出銻、銅[1]作業作為溶劑使用。
3 結 論
(1)廣西河池某冶煉廠浸出液Sb 含量為538.5 mg/L、Cu 含量為395.9 mg/L。在反應溫度為56 ℃、反應時間為20 min、反應終了pH=3.15、攪拌強度為150 r/min 條件下進行水解沉淀銻,可獲得Sb、Cu 的沉淀率分別為98.23%、3.84%,沉淀物Sb、Cu 品位分別為10.35%、0.30%的沉銻產品;沉銻殘余液在Na2S 用量為2.5 g/L、反應溫度為50 ℃、反應時間為10 min、攪拌速度為150 r/min、反應后靜置20 min 條件下,可獲得Cu 品位、沉淀率分別為36.92%、98.38%的沉銅產品。
(2)水解沉銻、Na2S 沉銅分步回收浸出液中銻、銅的方法理論上合理,實際上高效,且反應過程溫度低、時間短、藥劑用量少、成本低,是回收氧化酸浸—絡合法浸出液中銻、銅的有效方法。
[1] 楊慧芬,李彩虹,王傳龍,等. 氧化酸浸—酒石酸絡合法從鉛渣選鐵尾礦中回收銻銅[J].金屬礦山,2015(9):175-180.
Yang Huifen,Li Caihong,Wang Chuanlong,et al.Antimony and copper recovery from iron tailings generated from lead slag using oxidizing acid leaching-tartaric acid complexation[J]. Metal Mine,2015(9):175-180.
[2] 謝曉峰,李 磊,王 飛,等. 銅渣氯化煙塵中銅的濕法回收[J].過程工程學報,2015,15(3):424-429.
Xie Xiaofeng,Li Lei,Wang Fei,et al.Recovery of copper from chlorination dust of copper-containing slag by hydrometallurgical methods[J].The Chinese Journal of Process Engineering,2015,15(3):424-429.
[3] 王海云,俞小花,華宏全,等. 從鉛冰銅浸出液中萃取分離銅[J].礦冶,2014,23(6):43-46.
Wang Haiyun,Yu Xiaohua,Hua Hongquan,et al.Separation and recovery of copper from leaching liquor of lead matte[J].Mining and Metallurgy,2014,23(6):43-46.
[4] 李志仁,許萬祥,朱 軍,等. 從高酸濕法煉鋅渣浸出液中分離鐵及回收銅鋅試驗研究[J].濕法冶金,2013,32(5):326-328.
Li Zhiren,Xu Wanxiang,Zhu Jun,et al.Test research on separate of iron and recovery of copper,zinc from acidic leaching solution of zinc hydrometallurgy slag[J]. Hydrometallurgy of China,2013,32(5):326-328.
[5] 許玉東,張雅瓊,黃啟成. 線路板污泥酸浸液中銅的置換回收[J].環境工程學報,2012,6(11):4083-4088.
Xu Yudong,Zhang Yaqiong,Huang Qicheng. Recovery of copper from circuit board sludge acid leaching solution by replacement and its kinetics[J].Techniques and Equipment for Environmental Pollution Control,2012,6(11):4083-4088.
[6] Amélie Janin,Fran?ois Zaviska,Patrick Drogui,et al. Selective recovery of metals in leachate from chromated copper arsenate treated wastes using electrochemical technology and chemical precipitation[J].Hydrometallurgy,2009,96(4):318-326.
[7] Amélie Janin,Jean Fran?ois Blais,Guy Mercier,et al. Selective recovery of Cr and Cu in leachate from chromated copper arsenate treated wood using chelating and acidic ion exchange resins[J].Journal of Hazardous Materials,2009,169(1/2/3):1099-1105.
[8] 徐潤澤,郭學益,李 棟.從銅陽極泥分銀渣低溫堿性熔煉浸出液中回收銻錫的研究[J]. 金屬材料與冶金工程,2015,43(1):44-49.
Xu Runze,Guo Xueyi,Li Dong. Recovery antimony and tin from leaching solution of sliver separated residues after low temperature alkaline reduction smelting[J].Metal Materials and Metallurgy Engineering,2015,43(1):44-49.
[9] 鄭雅杰,洪 波.漂浮陽極泥富集金銀及回收銻鉍工藝[J]. 中南大學學報:自然科學版,2011,42(8):2221-2226.
Zheng Yajie,Hong Bo.Enrichment of Au and Ag and recovery of Sb and Bi from floating anode slime[J].Journal of Central South University:Science and Technology,2011,42(8):2221-2226.
[10] Yang Jianguang,Wu Yongtian.A hydrometallurgical process for the separation and recovery of antimony[J]. Hydrometallurgy,2014,143:68-74.
[11] Espen Mariussen,Marita Lj?nes,Arnljot Einride Str?mseng. Use of sorbents for purification of lead,copper and antimony in runoff water from small arms shooting ranges[J].Journal of Hazardous Materials,2012,243(12):95-104.
[12] Espen Mariussen,Ida Vaa Johnsen,Arnljot Einride Str?mseng. Selective adsorption of lead,copper and antimony in runoff water from a small arms shooting range with a combin ation of charcoal and iron hydroxide[J]. Journal of Environmental Management,2015,150(1):281-287.
[13] 湯鴻霄. 無機高分子絮凝理論與絮凝劑[M]. 北京:中國建筑工業出版社,2006.Tang Hongxiao.Inorganic Polymer Flocculation Theory and Flocculant[M].Beijing:China Building Industry Press,2006.
[14] 朱元保,沈子琛,張傳福,等.電化學數據手冊[M]. 長沙:湖南科學技術出版社,1985.
Zhu Yuanbao,Shen Zichen,Zhang Chuanfu,et al. Electrochemical Datasheet[M]. Changsha:Hunan Science and Technology Press,1985.

