全饑餓對腦皮質細胞凋亡及Bcl-2、Bax、Caspase-3表達的影響
李媛媛 張小平 劉鐵軍 李建民 張樹波 程光
相關研究證明饑餓對神經系統的影響非常明顯[1,2],大腦與學習記憶功能、呼吸、運動以及攝食、生殖、情緒控制等行為有關,因此饑餓狀態對腦細胞損傷可能最終造成大腦功能的損害。在人類中各種疾病引起的患者昏迷或其他原因患者長期不能進食,嚴重消化道疾病導致營養吸收障礙,或者某些災難(如礦井、建筑物坍塌、野外迷路等)、自然災害(如地震、海嘯、山體滑坡等)發生時,常造成遇難人員得不到食物,以及人為的長期過度節食等均可因嚴重營養缺乏造成大腦組織結構和功能損害,從而影響患者腦功能的恢復。因此,對于這類患者應重視支持療法,保證維持腦功能所必需的營養供給,從而有利于腦功能保護和恢復。本實驗通過制備全饑餓模型,觀察全饑餓狀態對大腦皮質凋亡相關因子Bcl-2、Bax和Caspase-3的表達變化,探討饑餓時限對腦組織損害機制及程度的影響。
1 材料與方法
1.1 材料
1.1.1 實驗動物:健康成年雄性SD大鼠60只,清潔級,體重(350±30)g,12周齡,由河北聯合大學動物實驗中心提供[動物合格證號:SCXK(冀)2009-0003]。
1.1.2 試劑:實驗所需的儀器由河北聯合大學臨床醫學院臨床實驗中心提供。TUNEL試劑盒(Millipore公司);PCR反應試劑盒、逆轉錄試劑盒和引物(Invitrogen公司);BCA蛋白濃度測定試劑盒(碧云天公司);Bcl-2一抗(上海Bioworlde公司);兔抗Caspase-3(Active)一抗、兔抗Bax一抗、兔抗GAPDH一抗、山羊抗兔IgG二抗、ECL發光液(Affinity公司)。
1.2 方法
1.2.1 動物分組:60只SD大鼠隨機分為6組,分別為正常對照組、饑餓3 d、5 d、7 d、9 d和11 d組。其后又將每組隨機分為2個亞組Ⅰ、Ⅱ,每個亞組5只。每組Ⅰ組應用TUNEL法檢測皮質區的凋亡細胞,Ⅱ組用RT-PCR和Western blot法檢測皮質區 Bcl-2、Bax和Caspase-3的mRNA及蛋白表達。
1.2.2 全饑餓模型的復制:大鼠實驗前置(25±2)℃室溫,自由飲食,分籠適應性喂養2周后進行實驗。正常對照組給予正常飲食,饑餓3 d、5 d、7 d、9 d、11 d 組在相應的饑餓天數內禁食,但給予足量的飲水。每組Ⅰ組大鼠在達到饑餓天數后,立即以10%水合氯醛以0.30 ml/100 g體重腹腔內注射麻醉動物,在深度麻醉下用0.9%氯化鈉溶液、4%多聚甲醛溶液經左心室、主動脈灌注,之后斷頭。用特制的咬骨鉗從枕骨大孔處鉗開,仔細分離整個大腦組織,在視交叉和乳頭體處將腦組織垂直橫斷后,將含頂葉腦組織(厚約4 mm)置于4℃0.1 mol/L的4%多聚甲醛溶液浸泡后固定以備制作石蠟標本,用于Tunel檢測。Ⅱ組大鼠在深麻下斷頭取腦,分離皮質,用于 RT-PCR和Western blot檢測。
1.2.3 皮質神經元凋亡檢測:采用TUNEL法檢測大鼠皮質神經元凋亡情況。切片入水,滴加新鮮稀釋的蛋白酶K(20 g/ml),室溫消化15 min;3%H2O2孵育5 min,PBS沖洗5 min×2次;加入平衡液,4℃孵育60 min;加入TdT酶反應液,37℃孵育60 min;加入終止液,室溫孵育10 min;PBS沖洗1 min×3次,加入Anti-digoxigenin,室溫孵育30 min;PBS沖洗2 min×4次,DAB顯色。高倍鏡下大腦皮質頂葉區截圖(來自不同切片),采用Image-ProPlus 6.0圖像分析軟件進行凋亡細胞計數。
1.2.4 RT-PCR法檢測大鼠皮質:Bcl-2、Bax、Caspase-3 mRNA的表達 PCR反應體系(參考PCR說明書):Taq Master Mix 17 μl,上下游引物各 1 μl,模板 DNA 1 μl,共 20 μl。PCR 反應條件:預變性 94℃ 4 min,變性 94℃ 30 s、退火58℃ 30 s、延伸72℃ 1 min(39個循環),終延伸72℃ 5 min。PCR反應產物經2%瓊脂糖凝膠電泳檢測,用LeicaQ5100W型全自動圖像分析儀分析電泳結果。用全自動數碼成像分析系統對結果進行分析。見表1。
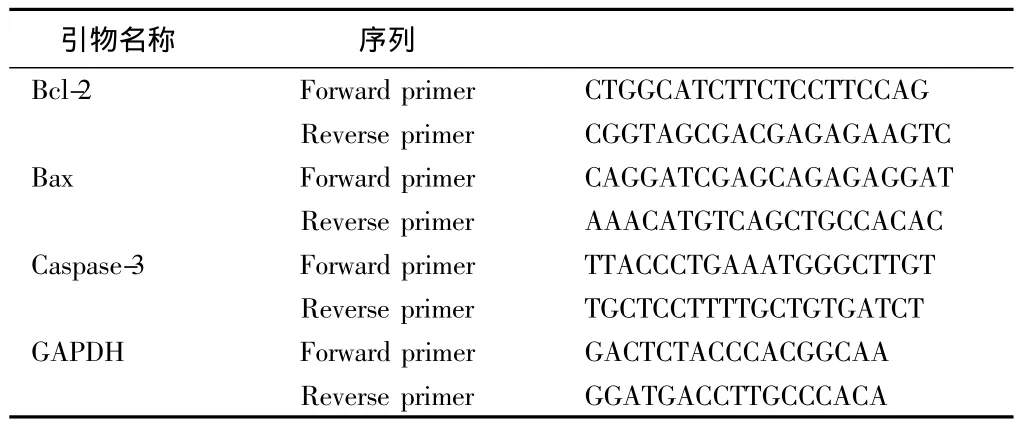
表1 引物序列
1.2.5 Western blot檢測大鼠皮質 Bcl-2、Bax、Caspase-3蛋白表達:按照WIP組織細胞裂解液說明書提取蛋白,用BCA法檢測樣本蛋白濃度。樣品的上樣體積為30 μl(總蛋白量為25 μg),用15%的分離膠進行SDS-PAGE電泳;轉膜后以5%的脫脂奶封閉液封閉1 h;一抗(1∶500)孵育4℃過夜;用TBST洗膜3次(5 min/次);二抗(11∶3 000)孵育1 h;洗膜。用ECL發光試劑盒發光、顯影、定影。
1.3 統計學分析 應用SPSS 17.0統計軟件,計量資料以表示,采用單因素方差分析,相關性采用Pearson法分析,P<0.05為差異有統計學意義。
2 結果
2.1 皮質神經細胞凋亡情況 與正常對照組比較,饑餓3 d組凋亡細胞百分比無明顯增加(P>0.05),饑餓5 d組稍有增加(P<0.05),而饑餓7 d、9 d和11 d組明顯增加(P<0.01)。見表2,圖1~8。
表2 大鼠皮質區TUNEL陽性細胞及凋亡細胞陽性率n=5,±s
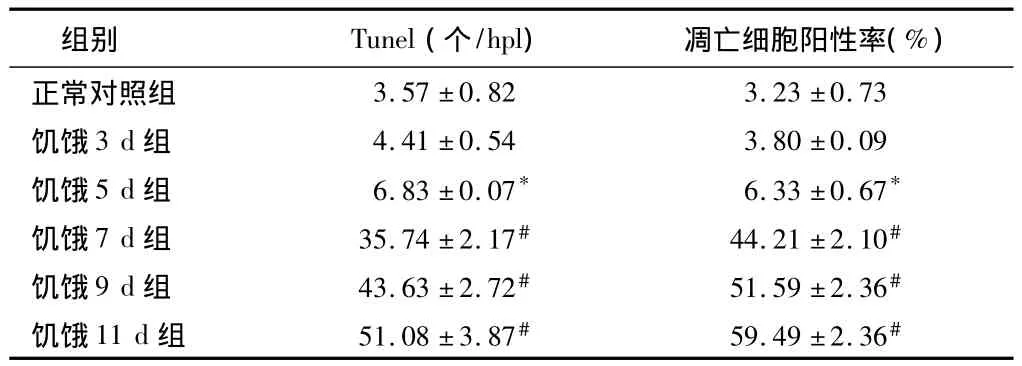
表2 大鼠皮質區TUNEL陽性細胞及凋亡細胞陽性率n=5,±s
注:與正常對照組比較,*P <0.05,#P <0.01
組別 Tunel(個/hpl) 凋亡細胞陽性率(%)正常對照組3.57±0.82 3.23±0.73饑餓3 d組 4.41±0.54 3.80±0.09饑餓5 d組 6.83±0.07* 6.33±0.67*饑餓7 d組 35.74±2.17# 44.21±2.10#饑餓9 d組 43.63±2.72# 51.59±2.36#饑餓11 d組 51.08±3.87# 59.49±2.36#
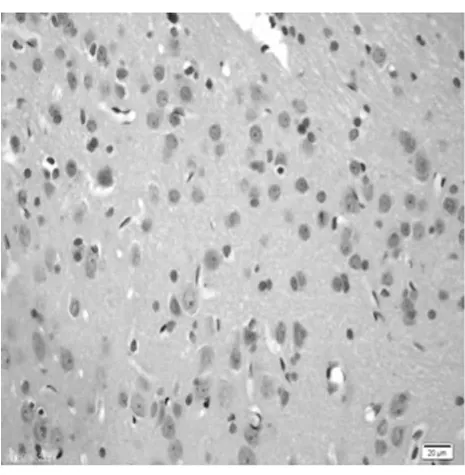
圖1 陰性對照皮質區(TUNEL×400)
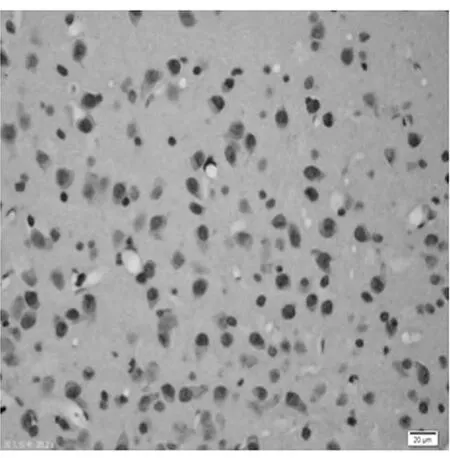
圖2 陽性對照皮質區(TUNEL×400)
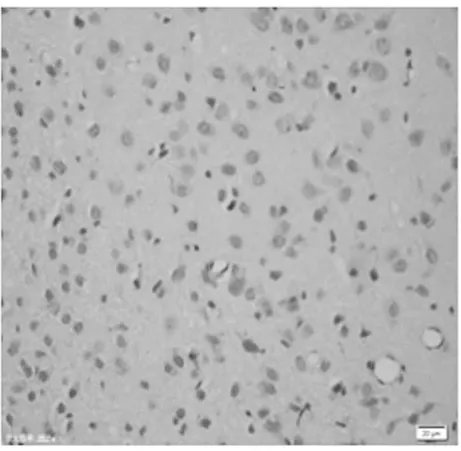
圖3 正常對照組皮質區(TUNEL×400)
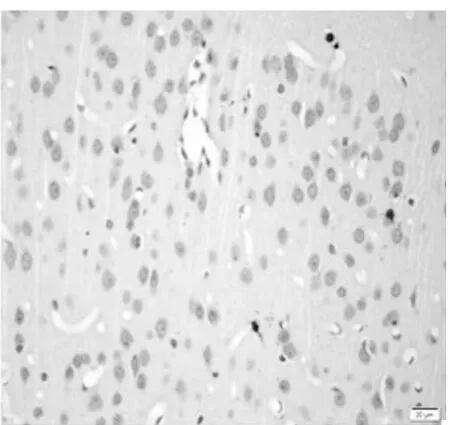
圖4 饑餓3 d組皮質區(TUNEL×400)
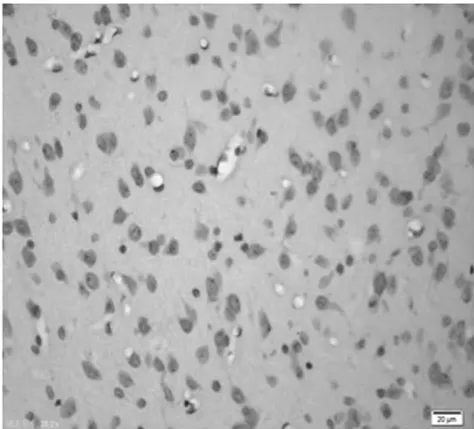
圖5 饑餓5 d組皮質區(TUNEL×400)
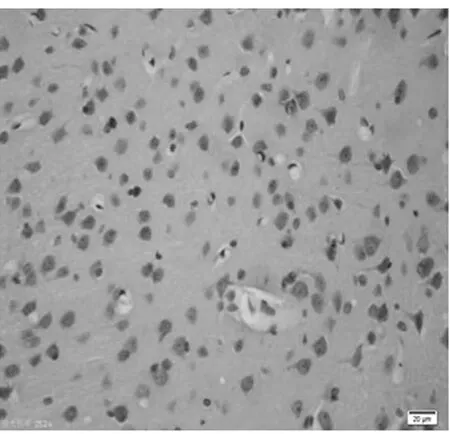
圖6 饑餓7 d組皮質區(TUNEL×400)
圖7 饑餓9 d組皮質區(TUNEL×400)
圖8 饑餓11 d組皮質區(TUNEL×400)
2.2 RT-PCR法檢測大鼠皮質 Bcl-2、Bax、Caspase-3 mRNA的表達 與正常對照組比較,饑餓3 d組Bax和Caspase-3 mRNA表達無明顯增加(P>0.05),而饑餓5 d、7 d、9 d、11 d 組Bax和Caspase-3 mRNA 表達均明顯增加(P<0.01);饑餓3 d、5 d、7 d組 Bcl-2 mRNA的表達均增高(P<0.05),5 d組表達量最高(P<0.01),9 d、11 d 組表達降低(P<0.05),11 d組表達量最低(P<0.01)。見表2,圖9。
表2 大鼠皮質區Bcl-2、Bax、Caspase-3mRNA相對表達量n=5,±s
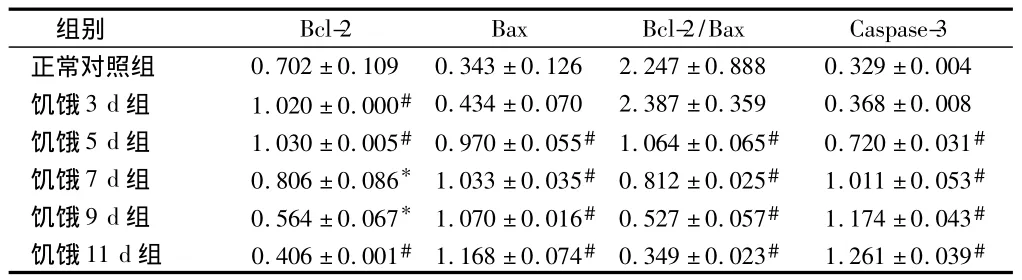
表2 大鼠皮質區Bcl-2、Bax、Caspase-3mRNA相對表達量n=5,±s
注:與正常對照組比較,*P <0.05,#P<0.01
組別Bcl-2 Bax Bcl-2/Bax Caspase-3正常對照組 0.702±0.109 0.343±0.126 2.247±0.888 0.329±0.004饑餓3 d組 1.020±0.000# 0.434±0.070 2.387±0.359 0.368±0.008饑餓5 d組 1.030±0.005# 0.970±0.055# 1.064±0.065# 0.720±0.031#饑餓7 d組 0.806±0.086* 1.033±0.035# 0.812±0.025# 1.011±0.053#饑餓9 d組 0.564±0.067* 1.070±0.016# 0.527±0.057# 1.174±0.043#饑餓11 d組 0.406±0.001# 1.168±0.074# 0.349±0.023# 1.261±0.039#
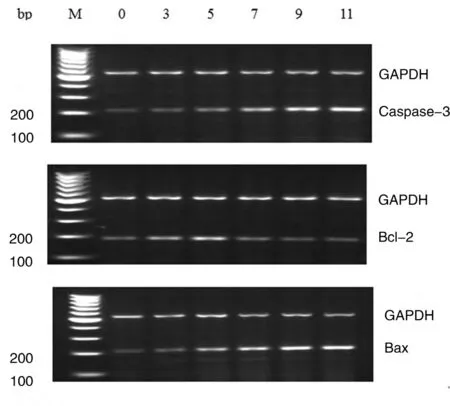
圖9 各組大鼠皮質區Bcl-2、Bax、Caspase-3 mRNA的表達水平
2.3 Western Blot檢測 Bcl-2、Bax、Caspase-3 蛋白表達
與正常對照組比較,饑餓3 d組Bax和Caspase-3蛋白表達無明顯增加(P>0.05),饑餓5 d組Caspase-3表達增加(P<0.05),Bax蛋白表達明顯增加(P<0.01),而饑餓7 d、9 d、11 d組 Bax和 Caspase-3 蛋白表達均明顯增加(P<0.01);饑餓3 d、5 d、7 d組Bcl-2蛋白的表達均明顯增高(P<0.01),5 d組表達量最高,9 d、11 d組表達降低,11 d組表達量最低(P<0.01)。見圖10,表3。

圖10 各組大鼠皮質區Bcl-2、Bax、Caspase-3蛋白的表達水平
表3 大鼠皮質區Bcl-2、Bax、Caspase-3蛋白相對表達量n=5,±s
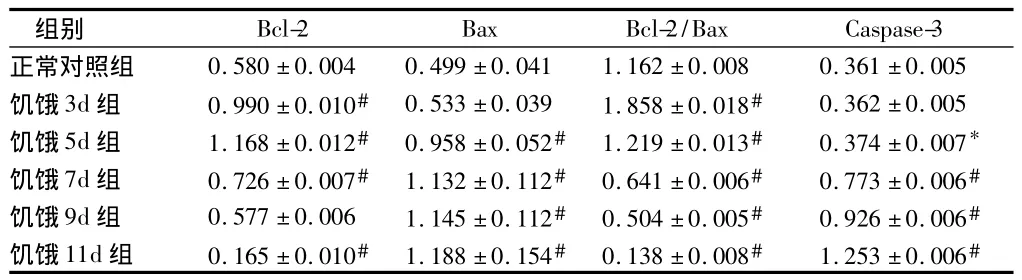
表3 大鼠皮質區Bcl-2、Bax、Caspase-3蛋白相對表達量n=5,±s
注:與正常對照組比較,*P <0.05,#P <0.01
組別Bcl-2 Bax Bcl-2/Bax Caspase-3正常對照組 0.580±0.004 0.499±0.041 1.162±0.008 0.361±0.005饑餓3d組 0.990±0.010# 0.533±0.039 1.858±0.018# 0.362±0.005饑餓5d組 1.168±0.012# 0.958±0.052# 1.219±0.013# 0.374±0.007*饑餓7d組 0.726±0.007# 1.132±0.112# 0.641±0.006# 0.773±0.006#饑餓9d組 0.577±0.006 1.145±0.112# 0.504±0.005# 0.926±0.006#饑餓11d組 0.165±0.010# 1.188±0.154# 0.138±0.008# 1.253±0.006#
2.4 對細胞凋亡與Bcl-2、Bax、Bcl-2/Bax和Caspase-3蛋白之間的相關性進行分析 見表4。

表4 大鼠皮質區細胞凋亡與Bcl-2、Bax、Caspase-3及Bcl-2/Bax比值之間的相關性(r值)
3 討論
相關研究證明饑餓對神經系統的影響非常明顯[1],可引起腦細胞內鈣增加,導致細胞內鈣超載,而鈣超載被認為是導致神經元遲發型死亡的關鍵因素之一。本實驗結果顯示饑餓可引起腦皮質區神經細胞凋亡數增加,饑餓后期數目明顯增多,提示可能已存在凋亡過度。細胞凋亡是涉及多基因調控的復雜的嚴格控制的主動死亡過程,Bcl-2家族是一個參與細胞死亡調控的基因家族,由兩組功能相互拮抗的蛋白組成,在細胞凋亡的調控過程中具有重要作用[3]。
本研究顯示,饑餓7 d內大鼠Bcl-2基因的表達增加,而隨著饑餓期延長,Bcl-2的表達明顯減少。結果表明短期的饑餓應激后皮質神經元中Bcl-2被誘導表達,提示Bcl-2可能是成年腦組織中的一種可誘導的內源性神經保護劑。相關研究證明饑餓早期時大鼠學習記憶能力稍有增強。Bcl-2蛋白可以降低細胞膜通透性、減少細胞色素C釋放、減少內質網釋放鈣,在內源性細胞凋亡的過程中起著關鍵性的調控作用[4,5]。饑餓后期Bcl-2表達減少可能會是皮質區凋亡增加的影響因素之一。
Bax具有孔形成能力,并能誘導細胞色素C的釋放,使 Bcl-2與 Apaf-1分離,然后 Apaf-1激活Caspase[6,7],啟動凋亡級聯反應[6]。饑餓 3 d 時大鼠Bax基因的表達略有增加,而隨著饑餓期延長大鼠皮質區Bax基因的表達明顯增加。結果提示在全饑餓狀態下Bax的表達受到影響,結合Bax基因表達具有促進凋亡的作用,考慮全饑餓狀態下皮質區細胞凋亡增加可能與Bax表達增加相關,而相關性分析顯示二者呈正相關。
Caspase蛋白酶家族在凋亡發生時瀑布式啟動過程中Caspase-3是凋亡的最終執行者,在凋亡信號傳遞中起關鍵作用[8,9]。本研究檢測各組大鼠皮質的Caspase-3基因的表達,與正常對照組比較發現,各組皮質Caspase-3 mRNA表達均上調,Caspase-3活性增高,其在饑餓后期7 d、9 d、11 d組中變化更顯著,故可知饑餓后期更容易誘導細胞凋亡。
目前有研究認為,Bcl-2與Bax的比值是決定細胞是否發生凋亡的基本檢驗點[10]。當二者的比率<1,Bax起到的作用占優勢,細胞色素C從線粒體釋放,從而導致細胞凋亡發生的一連串瀑布反應。當二者比率≥1,Bcl-2起到的作用占優勢,細胞色素C不再釋放,線粒體途徑的凋亡不起作用,細胞凋亡因此大大減少[11,12]。本實驗中饑餓 3 d、5 d 組皮質區 Bcl-2/Bax比值較正常對照組明顯增加,而饑餓7 d、9 d、11 d組較正常對照組比較明顯下降。說明在饑餓早期,大鼠Bcl-2/Bax比值明顯增加,抑制神經細胞的凋亡,而隨著饑餓期延長,在饑餓后期大鼠皮質區Bcl-2/Bax比值明顯減少。相關性分析顯示凋亡細胞數與二者比值呈負相關。在不同疾病模型研究中,Bcl-2/Bax比值的大小與TUNEL陽性細胞數的增減呈現出相互平行的變化關系,說明 Bcl-2/Bax比值有可能成為判斷細胞凋亡程度及與相關疾病發生的一個預示指標。在不同組織細胞凋亡的相關研究中,Bcl-2和Bax雖單獨具有調控細胞凋亡的功能,但在二者共表達的細胞中,其相互間的比例對細胞凋亡的影響更為重要。在不同刺激因子作用下,這些都提示Bcl-2家族成員間的動態平衡可能是決定細胞命運的核心機制之一,尤其是這一家族的兩個代表性成員Bcl-2和Bax。
綜上所述,短期饑餓應激可能有一定的腦保護作用;長期饑餓應激可能通過上調大鼠皮質細胞Bax、Caspase-3的表達,抑制 Bcl-2的表達,破壞了 Bcl-2/Bax的平衡,進而誘導細胞凋亡。
1 安翠紅,張小平,程愛國.全饑餓狀態以及復食后對大鼠腦損傷的影響.醫學信息,2014,27:64-65.
2 謝靜濤,唐晉.饑餓狀態對注意力的影響.湖南中醫學院學報,2004,24:53-54.
3 Tichy A.Apoptotic machinery:the Bcl-2 family protein in the roleof inspectors and su-perintendents.Acta Medica(Hradec Kralove),2006,49:13-18.
4 Broughton BR,Reutens DC,Sobey CG.Apoptotic mechanisms after cerebral ischemia.Stroke,2009,40:331-339.
5 興桂華,李雪巖,林春榮,等.老年性癡呆模型大鼠海馬區 Bcl-2、Bax的表達及七福飲的干預作用.中國老年學雜志,2010,30:1389-1391.
6 Mendoza-Paredes A,Liu H,Schears G,et al.Resuscitation with 100%,compared with 21%,oxygen following brief,repeated periods of apnea can protect vulnerable neonata1 brain regions from apoptotic injury.Resuscitation,2008,76:261-270.
7 Tan KO,Fu NY,Sukumaran SK,et al.MAP-1 is a mitochondrial effector of Bax.Proc Natl Acad Sci USA,2005,102:1462-1468.
8 張雪梅,李景亮,呂德華.Caspase-3、Bcl-2與皮膚病.中國麻風皮膚雜志,2008,24:291-294.
9 Sultana R,Banks WA,Butterfield DA.Decreased levels of PSD95 and two associated proteins and increased levels of BCl-2 and caspase-3 in hippocampus from subjects with amnestic mild cognitive impairment:Insights into their potential roles for loss of synapses and memory,accumulation of Abeta,and neurodegenera-tion in a prodromal stage of Alzheimer’s disease.J Neurosci Res,2010,88:469-477.
10 王衛東,陳正堂.bcl-2/bax比率與細胞“命運”.中國腫瘤生物治療雜志,2007,4:393-395.
11 Swerdlow S,Mccoll K,Rong Y,et al.Apoptosis inhibition by Bcl-2 gives way to autophagy in glu cocorticoid-treated lymph cytes.Autophagy,2008,4:612-620.
12 Salah-Eldin AE,Inous S,Tsukamoto S,et al.An association of Bcl-2 phosphotylation and Bax localizes their functions after hyp erthermia and paclitaxel treatment.Int J Cancer,2003,103:53-60.

