長牡蠣(Crassostrea gigas)Wnt4基因cDNA克隆與表達分析*
楊 梅 許 飛 劉 俊 李 莉 張國范①
(1. 中國科學院海洋研究所海洋生態養殖技術國家地方聯合工程實驗室 青島 266071; 2. 中國科學院大學 北京 100049)
Wnt蛋白是一類由Wnt基因編碼并經脂質化修飾的分泌性糖蛋白(Smolichet al,1993)。Wnt基因最初由 Nusse等人于 1982年發現于鼠類乳腺癌病毒(mouse mammary tumor vious, MMTV)誘導的小鼠乳腺癌, 稱為 int-1基因。后發現, 該基因與 1973年發現的果蠅wingless基因為同源基因, 故將兩者合并命名為Wnt(Nusseet al, 1992)。在隨后的研究中人們在從線蟲到脊椎動物的體內均發現了該類蛋白,且成員數目越來越多(Parret al, 1994; Bergstainaet al, 1997)。由Wnt蛋白所介導的Wnt信號通路參與了動物體內多種生物學過程的調控, 包括胚胎的生長發育、組織的穩定、能量代謝的平衡及干細胞多功能性的維持等(韓琳等, 2008)。Wnt信號通路被阻斷或有異常時, 動物胚胎的生長發育會遭到破壞,甚至誘發多種癌癥(Klauset al, 2008; 尹定子等,2011)。
Wnt4是Wnt家族成員之一, 其蛋白序列富含半胱氨酸殘基, 迄今該基因已在人、小鼠(Mus musculus)、斑馬魚(Daniorerio)、沙蠶(Platynereis dumerilii)、果蠅(Drosophila melanogaster)、櫛孔扇貝(Chlamys farreri)、日本血吸蟲(Schistosoma japonicum)等多個物種中進行了相關的表達和功能研究。人類和小鼠中,Wnt4在控制雌性發育、參與調節繆勒氏管的形成、控制卵巢內固醇的生成及抑制睪丸的形成中起關鍵作用; 同時, Wnt4是腎發育的正調控因子,其突變小鼠會在出生后 24小時內因腎較小并退化而死于腎衰(向陽等,2007); 另外, Sato等(2006)發現, 果蠅的Wnt4蛋白能夠參與調控視網膜成像的特異性, 并通過調節細胞的運動來參與卵巢的形態發生; 日本血吸蟲Wnt4在調控蟲體表皮生長和雌蟲產卵過程中發揮重要作用(陶麗紅等, 2007); 櫛孔扇貝的Wnt4基因在多個組織中(外套膜, 鰓, 閉殼肌, 肝胰腺, 精巢和卵巢)均有表達, 并可能參與兩性性腺的發育(李海龍等, 2013)。目前, Wnt4在貝類發育中的表達特點和功能鮮有報道。長牡蠣是一種具有較高營養和經濟價值的濾食性貝類, 是目前我國乃至全球產量最大的經濟貝類(王如才等, 2008),同時也是研究得較為充分的貝類(Hedgecocket al, 2005)。本研究采用RACE技術克隆了長牡蠣(Crassostrea gigas)的Wnt4基因全長cDNA序列,并結合熒光定量 RT-PCR技術分析該基因在成體不同組織和幼體不同發育時期中的表達特點, 旨在探究 Wnt4基因在長牡蠣個體發育過程中的作用,為進一步開展雙殼貝類 Wnt基因家族的功能研究提供基礎。
1 材料與方法
1.1 實驗動物
長牡蠣親貝來自青島嶗東海珍品良種培育有限公司。解剖雌貝收集卵子, 放入10L過濾海水中; 收集雄性親貝精子放入一個大燒杯中。卵子先用 90μm尼龍網過濾, 然后用25μm尼龍網漂洗, 最后放入5L過濾海水中并調節卵子濃度為50000個/mL。受精前收集卵子樣品放入液氮。向卵子中添加精子使其密度保持在10—20個精子包圍1個卵子, 獲得受精卵, 在26oC 25m3的砂濾海水中孵育, 鹽度保持在30。幼蟲生長發育時期的樣品包括未受精的卵, 胚胎(二細胞期, 桑葚前期, 桑葚期, 囊胚期, 原腸前期, 原腸期),擔輪幼蟲, D形幼蟲, 殼頂幼蟲, 眼點幼蟲, 稚貝和幼貝(具體的取樣見表1)。另外, 解剖獲取 5只長牡蠣的各組織樣本(外套膜、閉殼肌、鰓、唇瓣、消化腺、血淋巴, 精巢和卵巢), 液氮中速凍后轉移到–80°C冰箱保存, 用于不同組織總RNA的提取。
1.2 長牡蠣Wnt4基因的克隆、測序
采用 Trizol法提取長牡蠣的總 RNA。用 NanoDrop 2000(Thermo Scientific)檢測提取的RNA濃度; 1.5%瓊脂糖凝膠檢測 RNA完整性。按照操作指南, 使用PrimeScript II 1st Strand cDNA Synthesis Kit (TaKaRa,Japan)合成RACE cDNA第一條鏈。
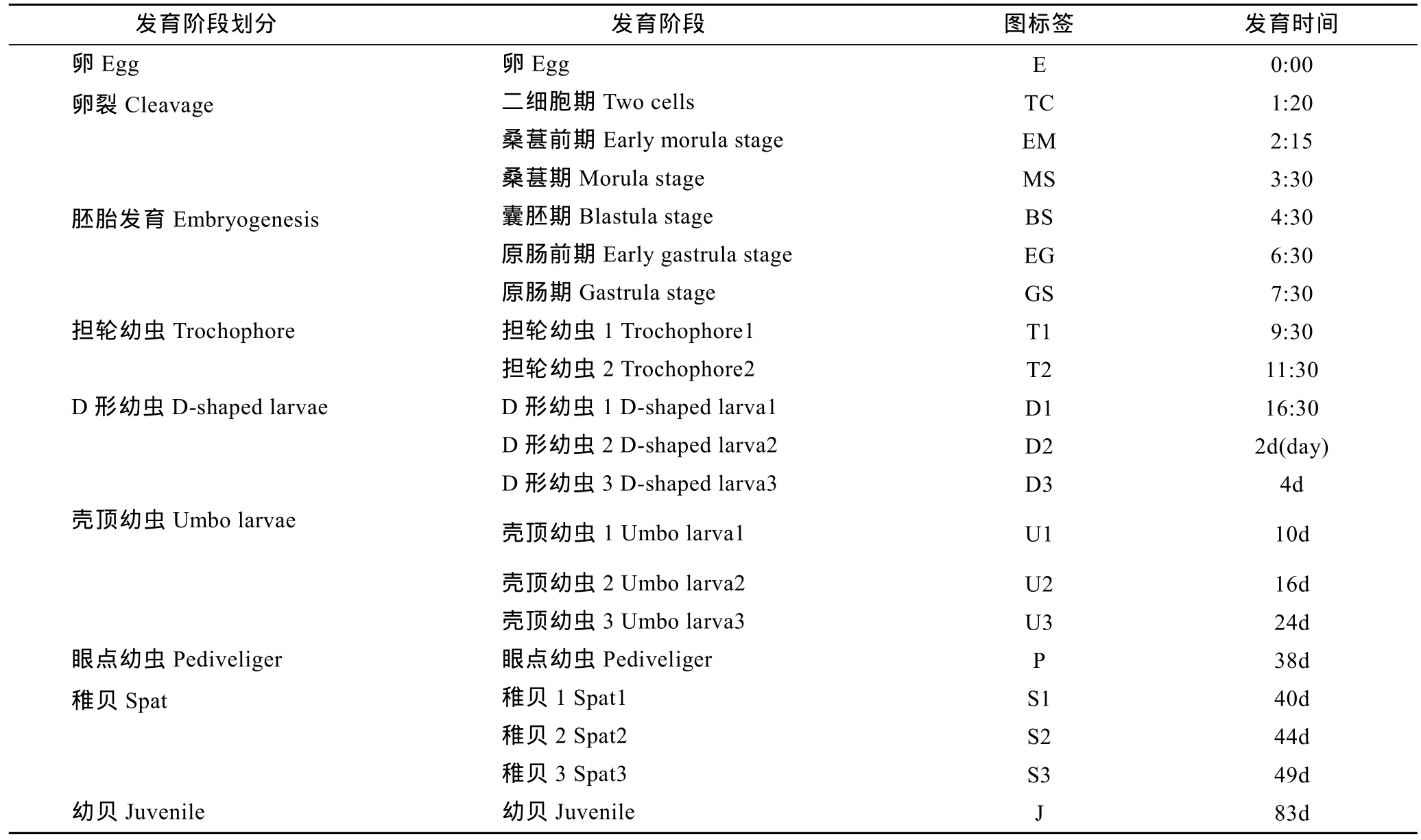
表1 長牡蠣幼蟲不同發育時期樣品取樣Tab.1 Sampling of C. gigas different developmental stages
從GenBank下載人、小鼠、沙蠶、櫛孔扇貝等物種的Wnt4蛋白序列, 并將這些序列與長牡蠣基因組數據庫進行比對,獲得長牡蠣Wnt4基因的片段。然后,根據獲得的Wnt4基因片段設計引物, 對該基因片段進行驗證后, 根據測序結果設計RACE引物, 采用巢式PCR擴增得到長牡蠣 Wnt4基因的全長, 所用引物見表2。

表2 長牡蠣Wnt4基因引物信息Tab.2 The information of C.gigasWnt4 primers
1.5%瓊脂糖凝膠電泳檢測PCR產物后用DNA凝膠純化試劑盒(Axygen)回收目的片段產物, 純化后連接到pEASY-T1載體(北京全式金生物技術公司)上并轉化到大腸桿菌 DH5α 感受態細胞(北京全式金生物技術公司)中, 涂平板, 37°C培養過夜, 挑取抗氨芐青霉素的陽性克隆, 經菌液PCR檢測后, 交由上海生工生物工程有限公司進行測序。
1.3 長牡蠣Wnt4基因序列分析及系統進化分析
用Lasergene軟件包對測序得到的序列進行拼接,理論分子量Mw(Molecular weight)和等電點pI (Isoelectric point)采用 Expasycompute pI/Mw(http:// web.expasy.org/compute_pi/)進行預測, 氨基酸的多重比對采用Clustal X和 DNAMAN 完成, 信號肽區域預測用SignalP 4.1(http://www.cbs.dtu.dk/services/ SignalP/)進行, 系統發生樹的構建采用在線軟件phyML3.0(http://www.atgc-montpellier.fr/phyml/)進行。
1.4 熒光定量RT-PCR
分別取長牡蠣未受精的卵, 胚胎(二細胞期, 桑葚前期, 桑葚期, 囊胚期, 原腸前期, 原腸期), 擔輪幼蟲, D形幼蟲, 殼頂幼蟲, 眼點幼蟲, 稚貝和幼貝的樣本, 以及成體長牡蠣各組織樣本(外套膜、閉殼肌、鰓、唇瓣、消化腺、血淋巴, 精巢和卵巢), 并分別獲得它們的cDNA模板。由已獲得的cDNA全長序列設計長牡蠣 Wnt4基因特異性引物 Wnt4-real F(5′AAGAACGCCGCCTACCCA3′), Wnt4-real R(5′ACA GCCACAGTTGTCCAG3′)(擴增片段長度 239bp), 以18S rRNA(RS18)基因的表達量作為內參(RS18-real F:5′GCCATCAAGGGTATCGGTAGAC 3′; RS18-real R:5′CTGCCTGTTAAGGAACCAGTCAG 3′; 擴增片段長度168bp)(Duet al, 2013)。使用ABI7500 Fast熒光定量 PCR儀進行 Wnt4 基因在長牡蠣不同幼體發育階段和成體不同組織中的定量表達分析, 每個樣本做3個平行檢測。熒光定量RT-PCR反應條件: 94°C 30s, 1 個循環; 94°C 5s, 60°C 30s, 40 個循環。利用溶解曲線峰的單一性和 1.5%瓊脂糖凝膠電泳檢測, 確保產物沒有引物二聚體的影響。通過 ABI7500 Fast SDS software V2.0軟件輸出數據, 采用2–△△Ct法對基因的相對表達量進行分析, 使用SPSS 11.0軟件進行數據統計分析。
2 結果與討論
2.1 長牡蠣 Wnt4基因全長 cDNA序列特征和系統進化分析
Wnt蛋白是分泌性糖蛋白, 成員均為由350—380個氨基酸構成的保守蛋白, 含23—24個保守的半胱氨酸殘基, 有很強的疏水性, 其合成、加工和分泌過程需要保守半胱氨酸殘基的棕櫚酰化、內質網Porcupine脂蛋白修飾作用和脂蛋白顆粒分子的協同完成(Bergsteinaet al, 2006)。其首個保守的半胱氨酸殘基的棕櫚酰化對維持Wnt蛋白的疏水性和Wnt與Frizzled間的結合作用必不可少(Mikelset al, 2006)。本研究表明, 長牡蠣Wnt4基因完整cDNA序列全長1999bp, 5′非編碼區(Untranslated region, 5'UTR)466bp,3′UTR465bp, 開放閱讀框(open reading frame, ORF)為1068bp, 編碼355個氨基酸(圖1)。長牡蠣Wnt4蛋白的理論分子質量為40.397kD, 等電點為9.12。該蛋白序列含100多個保守的Wnt4蛋白保守位點; 24個Wnt蛋白家族最重要的半胱氨酸殘基, 可交聯形成二硫鍵(圖1; 圖2), 同時還含有一段長為22個氨基酸的信號肽序列。
長牡蠣Wnt4蛋白序列與人(Homo sapiens), 文昌魚(Branchiostoma floridae), 沙蠶(Platynereis dumerilii)、小頭蟲(Capitella teleta)、烏賊(Euprymna scolopes)和櫛孔扇貝(Chlamys farreri)Wnt4蛋白的相似性分別為44%, 43%, 48%, 45%, 42%和46%(圖2)。使用phyML 3.0軟件構建的Wnt4蛋白序列系統進化樹顯示, 長牡蠣Wnt4首先與同為雙殼貝類的櫛孔扇貝聚為一支,之后依次與冠輪動物沙蠶和脊索動物文昌魚聚類(圖3), 表明該基因的系統進化關系與傳統的物種進化地位基本一致。
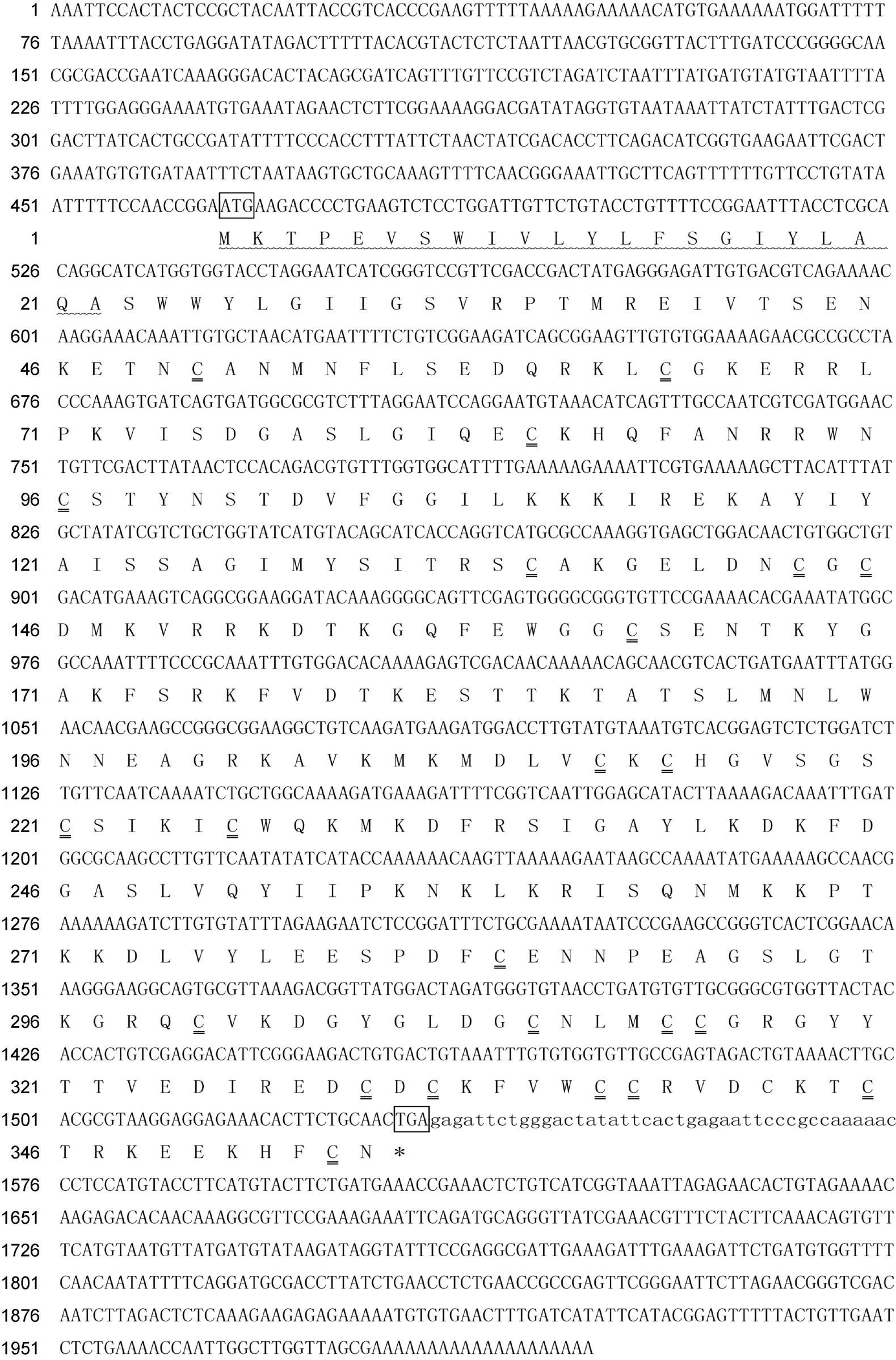
圖1 長牡蠣Wnt4基因完整cDNA序列與推導的氨基酸序列Fig.1 The cDNA sequence of C. gigas Wnt4 gene and the deduced amino acids sequence
2.2 長牡蠣 Wnt4基因在成體各組織及不同幼體發育階段中的定量表達分析
熒光定量RT-PCR結果表明, 長牡蠣Wnt4mRNA在外套膜、鰓、唇瓣、消化腺、雄性性腺、雌性性腺中均有表達, 但各組織間存在差異, 在唇瓣、鰓和消化腺中的表達量相對較高, 同時在雌性性腺中的表達量高于雄性性腺(圖4)。
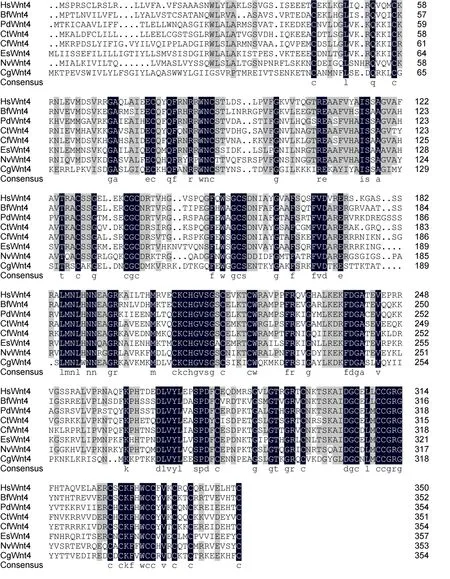
圖2 不同物種Wnt4蛋白序列多重比對分析Fig.2 Multiple alignment of Wnt4 proteins from different species
在長牡蠣個體發育過程中, 我們發現 Wnt4基因在卵(E)、二細胞期(TC)和桑葚前期(EM)幾乎沒有表達, 桑葚期(MS)表達量升高, 并在接下來的囊胚期(BS)出現最高表達, 約為桑葚期的 3倍(P<0.05); 原腸胚期(GS)的表達量次之, 在隨后的擔輪幼蟲期(T1,T2)和 D形幼蟲期(D1,D2,D3)表達量基本呈逐步下降的態勢, 殼頂幼蟲期(U1, U2, U3)至稚貝期(S1, S2,S3), 表達量相對穩定但較低, 僅為囊胚期的 20%左右, 幼貝期(J)該基因的表達量已經很低了(圖5)。
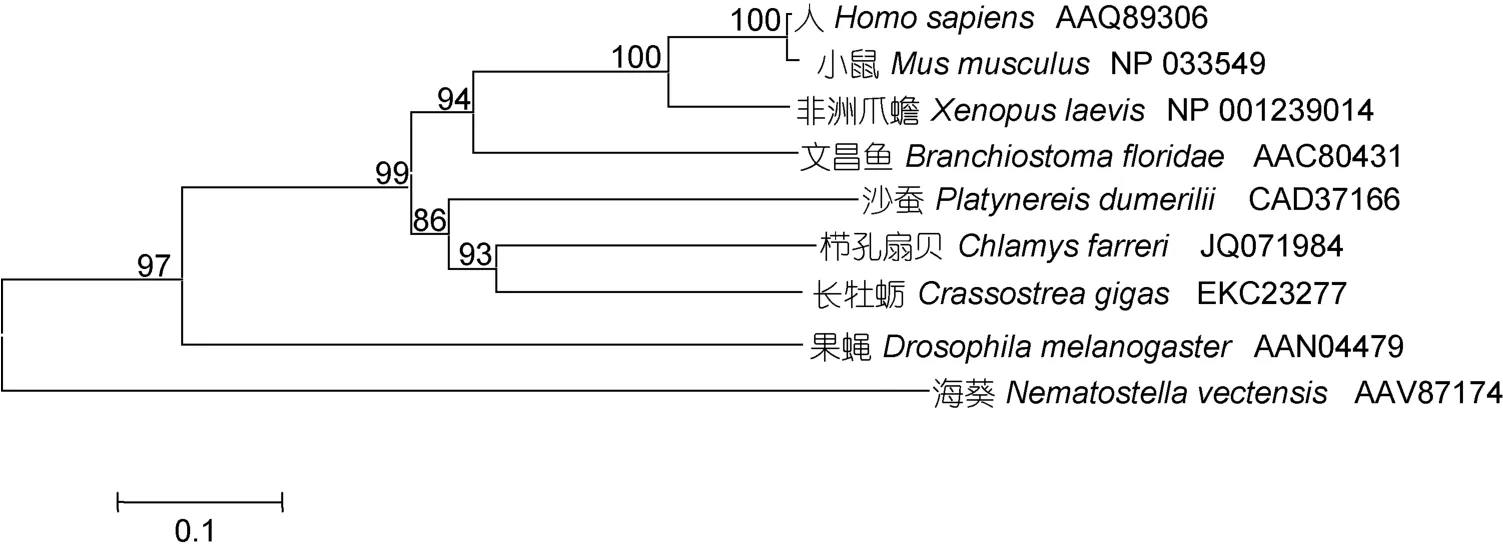
圖3 基于最大似然法 (ML) 構建的長牡蠣Wnt4氨基酸序列系統進化樹Fig.3 Molecular phylogenetic analysis of Wnt4amino acids sequences in C. gigas based on maximum likelyhood(ML) method
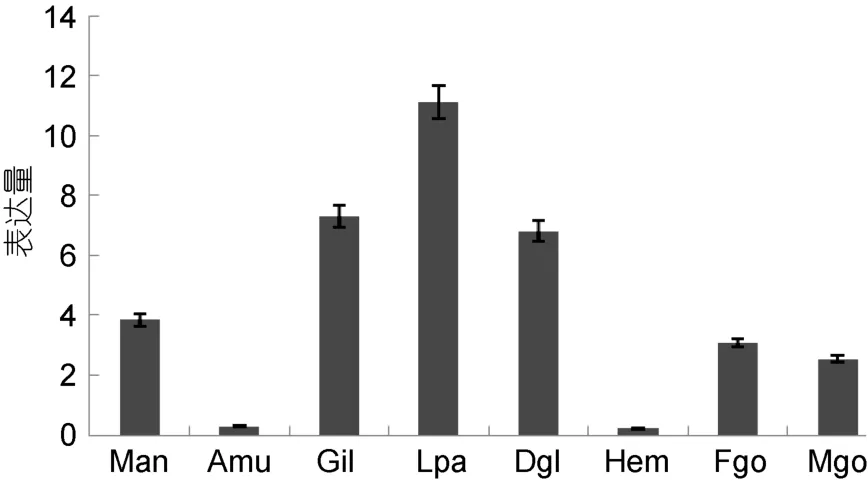
圖4 長牡蠣Wnt4 基因在成體不同組織中的表達情況Fig.4 Relative expression of the Wnt4 gene in different tissues of C.gigas
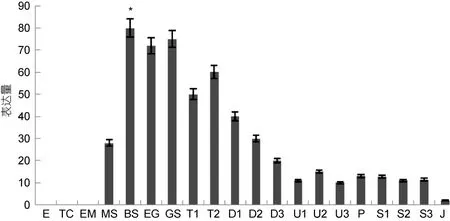
圖5 Wnt4 基因在長牡蠣幼蟲不同發育時期的表達情況Fig.5 Relative expression of the Wnt4 gene in different developmental stages of C.gigas.
Wnt4基因參與動物體的多種生命活動。Yu等(2006)發現, 袋鼠Wnt4基因在肌肉、肝、腎、肺、精巢和卵巢組織中都有表達; 在青鳉、斑馬魚、虹鱒等魚類中存在兩種Wnt4基因, Wnt4a和Wnt4b(李建中等, 2012; Nicolet al, 2012)。虹鱒Wnt4a蛋白與人、小鼠等脊椎動物Wnt4蛋白序列同源性大于80%, 并且其mRNA在多種組織, 包括腦、鰓、肝、肌肉、皮膚、頭腎、卵黃發生晚期的卵巢和Ⅱ期精巢中都有表達; 而Wnt4b蛋白與上述脊椎動物Wnt4蛋白的同源性低于 60%,僅在神經系統如腦和垂體中表達(Nicolet al, 2012)。李海龍等(2013)通過半定量RT-PCR表明,櫛孔扇貝的Wnt4 mRNA在外套膜、閉殼肌、鰓、肝胰腺、精巢和卵巢組織中均有表達, 但表達量較低。與已有研究的結果類似, 長牡蠣 Wnt4基因也具有廣泛的組織表達特點, 在所檢測的多種組織(外套膜、鰓、唇瓣、消化腺、雄性性腺、雌性性腺)中均有表達, 但最高表達水平僅為發育過程中囊胚期表達水平的17%左右(圖4), 所以我們推測長牡蠣的Wnt4基因可能也以信號分子的形式參與多種組織細胞的生命過程。
之前的研究表明, Wnt4基因與多種動物的性別決定和性別分化緊密相關(Bernardet al, 2007)。小鼠Wnt4mRNA在性別決定之前的性腺中均存在表達,性別決定之后, 在卵巢中仍持續表達,但精巢中的表達特異性地下調(Barrionuevoet al, 2006)。Wnt4 基因在牙鲆雌雄魚各組織中廣泛表達, 有卵巢強于精巢1.5倍的性別二態性, 并在幼魚性腺分化期起到了一定的作用(翁申達, 2012)。本實驗中, 長牡蠣Wnt4mRNA在成體的成熟期兩性性腺中亦均有表達, 同時雌性性腺的表達量是雄性性腺的1.2倍。而櫛孔扇貝的研究發現, Wnt4基因在扇貝不同發育時期的性腺中均有表達, 在成熟期性腺中的表達量最高, 而且成熟期精巢的表達量約為同時期卵巢表達量的兩倍(李海龍等, 2013)。同時, 在某些非哺乳動物如海龜和蛙中,Wnt4 基因在性腺分化中卻沒有性別表達差異(Yukiet al, 2005), 因此關于 Wnt4基因在多種動物雌雄個體間的差異表達并不具有保守性, 在不同物種中的功能以及在進化中的變異有待深入研究。雖然, 長牡蠣Wnt4mRNA在雌性性腺中的表達量高于雄性性腺,但在其個體發育過程中, 在卵里并未檢測到該基因的表達, 暗示該基因可能參與兩性性腺的發育并在性腺的其他組織細胞類型中發揮作用。
長牡蠣中Wnt4基因的高表達主要集中在胚胎發育的早期, 早期胚胎發育是個體形成不可逾越的初始階段, 又是組織器官形成的基礎, 該基因可能在早期發育階段參與了某些器官的形成。Wnt4基因在哺乳動物胚胎發育過程中,參與很多器官及系統的發育,例如腎臟、腎上腺、乳腺和生殖系統的形成(Bernardet al, 2007)。長牡蠣Wnt信號通路的其它關鍵成員, Frizzled,glycogen synthase kinase 3β(GSK-3β), Dishevelled, βcatenin和T-cell factor (TCF)等基因也主要在胚胎發育的早期進行表達(Yanget al, 2014), 而動物在早期發育過程中, 體軸極性的建立乃至整個體軸的形成,都需要這類表達于胚胎發育早期的基因的參與(錢光輝等, 2011)。
3 結語
Wnt4基因是Wnt基因家族的重要成員之一, 在動物的早期發育和器官發生過程中都發揮著重要的作用。長牡蠣的Wnt4基因具有廣泛的組織表達特點,在所檢測的多種組織中均有表達, 推測長牡蠣的Wnt4蛋白會以信號分子的形式參與多種組織細胞的生命過程。長牡蠣中Wnt4基因的高表達主要集中在胚胎發育的早期, 作為研究得較為充分的雙殼貝類,長牡蠣的個體發育涉及到復雜的形態和生理學轉變,該基因可能在早期發育階段參與了某些器官的形成。
王如才, 王昭萍, 2008. 海水貝類養殖學. 青島: 中國海洋大學出版社, 116—140
尹定子, 宋海云, 2011. Wnt信號通路: 調控機理和生物學意義.中國細胞生物學學報, 33(2): 103—111
向陽, 高基民, 胡志明等, 2007. Wnt基因的類別及功能. 生命的化學, 27(2): 138—141
李建中, 劉瓊, 王德壽等, 2012.日本青Wnt4基因的克隆與鑒定. 水生生物學報, 36(5): 983—986
李海龍, 劉建國, 劉曉玲等, 2013. 櫛孔扇貝Wnt4基因cDNA克隆及表達分析. 中國水產科學, 20(2): 260—268
翁申達,2013. 牙鲆相關性別基因的克隆與表達分析. 青島:中國科學院海洋研究所碩士學位論文, 63
錢光輝, 王義權, 2011. Wnt信號通路與后口動物體軸的進化發育. 遺傳, 33(7): 684—694
陶麗紅, 姚利曉, 傅志強等, 2007. 日本血吸蟲信號轉導蛋白Sjwnt-4基因的克隆、表達及功能分析. 生物工程學報,23(3): 392—397
韓琳, 馮新港, 2008. Wnt信號通路及其在動物生長發育過程中的作用. 中國獸醫寄生蟲病, 16(3): 47—52
Banziger C, Soldini D, Schutt Cet al, 2006. Wntless, a conserved membrane protein dedicated to the secretion of Wnt proteins from signaling cells. Cell, 125(3): 509—522
Barrionuevo F, Bagheri-Fam S, Klattig Jet al, 2006.Homozygous inactivation of Sox9 causes complete XY sex reversal in mice. Biology of Reproduction, 74(1): 195—201
Bergsteina I, Eisenbergb L M, Bhaleraoc Jet al, 1997. Isolation of two novel WNT genes, WNT14 and WNT15, one of which (WNT15) is closely linked to WNT3 on human chromosome 17q21. Genomics, 46(3): 450—458
Bernard P, Harley V R, 2007. Wnt4 action in gonadal development and sex determination. International journal of biochemistry & cell biology, 39(1): 31—43
Du Y S, Zhang L L, Xu Fet al, 2013. Validation of housekeeping genes as internal controls for studyinggene expression during Pacific oyster (Crassostreagigas) development by quantitative real-time PCR. Fish and Shellfish Immunology,34(3): 939—945
Hedgecock D, Gaffney P M, Goulletquer Pet al, 2005. The case for sequencing the Pacific oyster genome. Journal of Shellfish Research, 24(2): 429—441
Klaus A, Birchmeier W, 2008. Wntsignalling and its impact on development and cancer. Nature Reviews Cancer, 8(5):387—398
McElroy M D, Elrefaei M, Jones Net al, 2006. Coinfection withSchistosomamansoniis associated with decreased HIVSpecific cytolysis and increased IL-10 production. Journal of Immunology, 174(8): 5119—5123
Mikels A J, Nusse R, 2006. Wnts as ligands: processing,secretion and reception. Oncogene, 25: 7461—7468
Nicol B, Guerin A, Fostier Aet al, 2012. Ovary-predominant wnt4 expression during gonadal differentiation is not conserved in the rainbow trout (Oncorhynchus mykiss).Molecular Reproduction and Development, 79(1): 51—63
Nusse R, Varmus H E, 1982. Many tumors induced by the mouse mammary tumor virus contain a provious integrated in the same region of the host genome. Cell, 31(1): 99—109
Nusse R, Varmus H E, 1992. Wnt genes. Cell, 69(7): 1073—1087
Oshima Y, Hayashi T, Tokunaga Set al, 2005. Wnt4 Expression in the differentiating gonad of the frogRana rugosa.Zoological Science, 22(6): 689—693
Parr B A, McMahon A P, 1994. Wnt genes and vertebrate development. Current Opinion in Genetics & Development,4(4): 523—528
Sato M, Umetsu D, Murakami Set al, 2006. DWnt4 regulates thedorsoventral specificity of retinal projections in theDrosophilamelanogastervisual system. Nature Neuroscience,9(1): 67—74
Smolich B D, McMahon J A, McMahon A Pet al, 1993.Wnt family proteins are secreted and associated with the cell surface. Molecular Biology of The Cell, 4(12): 1267—1275
Ungar A R, Kelly G M, Moon R T, 1995. Wnt4 affects morphogenesis when misexpressed in the zebrafish embryo.Mechanism of Development, 52(2—3): 153—164
Yang M, Xu F, Liu Jet al, 2015 Identification and expression patterns of Wnt signaling pathway-related genes inCrassostrea gigas. Unpublished
Yu H S, Pask A J, Shaw Get al, 2006. Differential expression of Wnt4 in testicular and ovarian development in a marsupial.BMC Developmental Biology, 6(44): 1—13
Yuki O, Toshiyuki H, Shuichi Tet al, 2005. Wnt4 expression in the differentiating gonad of the frog Rana rugosa. Zoological Science, 22(6): 689—693

