鹽度脅迫下中肋骨條藻和東海原甲藻的生長及內源多胺含量的變化*
朱曉文 趙衛紅 苗 輝
(1. 中國科學院海洋研究所海洋生態與環境科學重點實驗室 青島 266071; 2. 中國科學院大學 北京 100049)
多胺是一類含有兩個以上氨基的脂肪族生物胺的小分子化合物, 廣泛存在于真核和原核生物中。植物體內的多胺主要有: 腐胺(Put)、亞精胺(Spd)、精胺(Spm)、尸胺(Cad)及鯡精胺(Agm)等, 按其在細胞內的存在形態可分為游離態(Free), 結合態(Conjugated)和束縛態(Bound)。作為一種普遍存在的代謝調節物,多胺對于植物體的細胞增殖、形態構成、環境脅迫響應及延緩衰老等方面發揮著特殊的作用。現階段, 多胺在植物體內參與生長調節和逆境響應的作用機制的研究已廣泛存在于高等植物領域, 以實現提高農作物的綜合逆境抗性的目的。研究成果顯示, 多胺可以調節代謝和基因表達, 增強抗氧化酶活性, 消除活性氧自由基, 激活或抑制細胞膜上的各種離子通道活性等過程來保護細胞膜、蛋白質及核酸等生物大分子, 維持正常的生理活動, 提高植物的逆境抗性(Nayyaretal, 2004; 向玥如等, 2014)。然而多胺在微藻體內所起的抗逆作用, 目前報道的比較少。
中肋骨條藻(Skeletonema costatum s.l.)和東海原甲藻(Prorocentrum donghaiense)是我國東海海區發生赤潮的主要肇事種之一(周名江等, 2003)。已有觀測數據表明, 在各種環境因素和赤潮生物生態學過程的作用下, 東海的赤潮高發區在特定季節呈現著以這兩種優勢種交互演替的硅藻和甲藻赤潮(周名江等,2006)。赤潮的研究表明了環境條件在赤潮暴發優勢種的篩選和演替中的重要作用, 而鹽度是影響優勢種形成的重要物理因子。此外, 在赤潮暴發期間, 伴隨著浮游植物的大量繁殖, 海水中的多胺濃度會呈現升高的趨勢(Nishiboriet al, 2003; 李彩艷等, 2012);有實驗顯示, 微藻體內游離態多胺與其生長周期具有一定的相關性, 在指數期內游離態的亞精胺與藻細胞的生長速率呈現良好的線性關系(Nishiboriet al,2004; 趙衛紅等, 2014)。本研究依托鹽度開展了脅迫實驗, 以探究多胺在兩種赤潮藻生長和應對不利鹽度環境時的響應機制。
1 材料與方法
1.1 材料準備和實驗設計
取天然海水, 經Φ47mmGF/F(Whatman)濾膜過濾,蒸發濃縮后再稀釋來獲得各個鹽度的海水, 添加 f/2配方, 120°C高壓滅菌冷卻。中肋骨條藻(Skeletonema costatum s.l.)和東海原甲藻(Prorocentrum donghaiense)由中國科學院海洋研究所藻種庫提供, 鹽度設4個水平, 每個水平設置2個平行樣。中肋骨條藻是廣鹽型的近岸硅藻, 最適增殖鹽度范圍為 20—30(霍文毅等,2001)。而東海原甲藻的最適鹽度范圍則為28—35(潘光等, 2011)。本實驗中中肋骨條藻的鹽度為14、17、20、36, 東海原甲藻為16、21、30、36, 培養體積為1L, 培養溫度為(20±1)°C, 光照強度為 55—70μmol/(m2·s), 光暗比為 L︰D=12︰12, 每日隨機調換錐形瓶并搖動3次, 結束后所剩藻液應不少于初始藻液的2/3, 中肋骨條藻和東海原甲藻的初始接種密度分別約為 1×108cell/L 和 1×106cell/L。
1.2 培養過程中取樣
于接種后每隔12h進行取樣, 取樣時間為每日的開始時和結束后, 藻液搖勻后取 10mL藻液, 用TU-1810紫外-可見分光光度進行測定藻細胞密度。中肋骨條藻和東海原甲藻分別在440nm和465nm下測定吸光度, 藻細胞濃度(N)根據吸光度值(A)換算得到。換算公式如下, 中肋骨條藻:N=213.48A–6.0046(107/L), (n=7,R2=0.9938); 東海原甲藻:N=53.916A–3.7397(107/L), (n=7,R2=0.994)。取培養至指數生長期后期的各實驗組藻液, 用于測定 MDA, POD, DAO,PAO和多胺。
1.3 測定方法
1.3.1MDA的測定丙二醛(MDA)是膜脂過氧化的產物, 是衡量逆境下植物膜系統受損害程度的重要指標。產生活性氧是植物遭遇逆境脅迫的常見反應之一, 當植物體細胞內的有大量活性氧且無法得到及時清除時, 將引起 MDA的生成和積累, 即標志著細胞膜和細胞器膜的結構和功能遭受到了損害, 會對植物的生長產生不利影響(Groppaetal, 2001; Yangetal, 2010)。丙二醛(MDA)的測定采用硫代巴比妥酸法(宮相忠等, 2001)。MDA含量以μmol/細胞數量表示,計算方法如公式(1)所示。
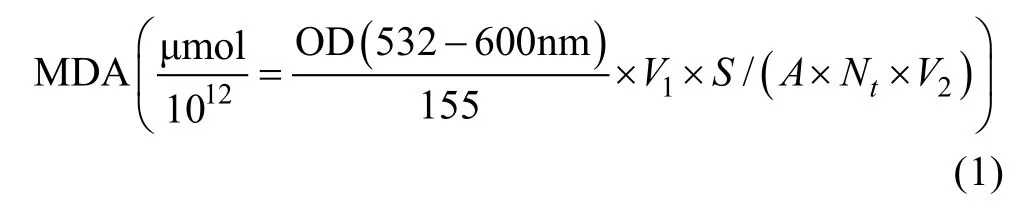
式中, OD(532—600nm)/155表示?μmol/mL(MDA),V1表示反應體系總量(mL),V2表示藻液總量(mL),S表示提取液總量(mL),A表示測定時用提取液總量(mL),Nt表示t時刻單胞藻密度(個/mL)。
1.3.2POD 的測定過氧化物酶(POD)是植物活性氧清除系統的重要組成部分, 它能夠有效地清除細胞內過量的 H2O2和其他氧自由基(Apeletal,2004)。取適量藻液, 3000r/min離心10min收集藻細胞, 加入1—1.5mL 0.02mol/L的KH2PO4溶液, 冰浴下超聲波破碎, 然后4000×g離心20min。過氧化物酶(POD)的測定采用愈創木酚法(Maehly, 1955), 以每分鐘吸光度變化 0.01表示一個酶活性單位: U(0.01?OD 470/min), 如公式(2)所示。
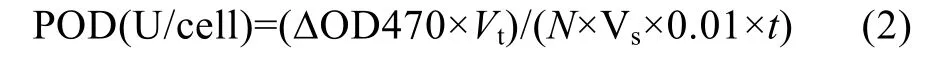
式中, ?OD470表示反應時間內吸光度的變化,N表示細胞數(個)。Vt表示提取酶液總體積(mL)。Vs表示測定時取用酶液體積(mL)。t表示反應時間(min)。
1.3.3PAO和DAO的測定參考汪天等(2004)的測定方法并略有改動。DAO測定中加入 0.1mL Put(20mmol/L)啟動反應, 在 30°C 下反應 30min, 于550nm處測定反應后的光度值; PAO測定中加入0.1mL Spd+Spm(20mmol/L)啟動反應, 在 25°C 下反應 30min, 于 550nm處測定反應后的光度值。以0.001?OD550/min為一個酶活單位(U)表示 DAO 和PAO活性, 如公式(3)所示。
DAO or PAO(U/cell)=(?OD550×Vt)/(N×Vs×0.001×t) (3)式中, ?OD550表示反應時間內吸光度的變化,N表示細胞數(個)。Vt表示提取酶液總體積(mL)。Vs表示測定時取用酶液體積(mL)。t表示反應時間(min)
1.3.4三種形態多胺的測定多胺的測定方法參考于 Aziz等(1995)并略有改動。取適量藻液,3000r/min離心10min, 收集藻細胞, 加入1mL 5%的PCA, 超聲下冰浴20min, 18000×g離心15min, 分離上清液, 剩余細胞碎片用2%的PCA沖洗2次, 合并上清液, 此上清液中包含游離態多胺和結合態多胺。取 1mL上清液進行游離態多胺的測定, 加入 10μL 1,6-己二胺標液(10–5mol/L), 4°C冰箱避光反應30min,加入70μL硼酸緩沖液和200μL 2mol/L的氫氧化鈉溶液調節pH, 渦旋混勻, 再加入2mL的丹磺酰氯的丙酮(5mg/mL)溶液, 渦旋混勻, 40°C 下水浴避光衍生45min, 加入 25%的濃氨水 100μL中止反應, 渦旋混勻30s, 避光靜置30min, 用乙醚分兩次萃取, 合并萃取液, 氮氣吹干, 加入 400μL乙腈溶解殘留物, 最后用 0.22μm有機針頭微孔濾膜過濾, 進樣分析。再取2mL上清液, 用等體積的 12mol/L的 HCl混合, 在110°C 水解 18小時后, 70°C 旋蒸干燥, 再用 1mL 2%PCA萃取, 然后重復游離態多胺的處理方法, 用于測定結合態。用2mL2% PCA溶解剩余的細胞碎片,得細胞懸液。此細胞懸液重復結合態多胺的處理方法, 用于測定束縛態多胺。
1.4 數據處理
實驗采用 Logistic生長模型來描述藻的生長情況。Logistic生長模型如公式(4)所示:

式中,Bt為t時刻生物量(cell/L),B0為起始生物量(cell/L),Bf為終止生物量(cell/L),μmax為最大生長速度[cell/(L·h)]。利用數據分析軟件Origin8.5對兩種藻的生長情況進行非線性擬合可得到Bf和μmax作為判定藻生長狀態的主要指標。
2 結果與分析
2.1 不同鹽度下兩種藻的生長狀況
兩種藻的生長狀況主要參考μmax的結果, 實驗中相對于鹽度最適范圍內的實驗組,μmax減少超過15%的被設為受脅迫組。從表1的結果可知, 對于中肋骨條藻, 鹽度為 17時生長狀況最佳, 其終止生物量和最大生長速率均表現出了最大值, 與文獻略有不同,但是 S-20組的μmax與S-17沒有顯著差異, 故可作為對照組; 鹽度為 14時,μmax降低15.9%, 表明其增殖已經受到了脅迫, 因而將S-14組視為低鹽脅迫組。鹽度為36時,Bf與S-14相當, 但是μmax顯著降低32%,表明該鹽度條件下, 中肋骨條藻生長緩慢, 可視為受到了高鹽度的脅迫作用。對于東海原甲藻, 鹽度為30時,Bf和μmax最高, 鹽度為 21和 36時,μmax降低了36.4% 和37.4%, 生長較緩慢, 分別可作為低鹽脅迫組和高鹽脅迫組。當鹽度為 16時, 東海原甲藻的生長極緩慢, 甚至無法采集藻細胞用于測定多胺, 因而認為該鹽度環境下, 東海原甲藻無法生長。

表1 不同鹽度下中肋骨條藻、東海原甲藻的終止生物量Bf(×107cell/L)和最大生長速率μmax[×107cell/(L·h)]Tab.1 The final biomass Bf(×107cell/L) and maximum growth rate μmax[×107cell/(L·h)] of S. costatum s.l. and P. donghaiense under different salinities
2.2 不同鹽度作用下兩種藻體內MDA和POD的變化
對于中肋骨條藻(圖1a), S-20組, MDA含量和POD活性最低, 隨著鹽度的降低, MDA含量和POD活性呈現逐漸升高的趨勢。相對于 S-20組, S-14組MDA含量上升了52.3%, POD活性升高了43.0%, S-36組MDA含量上升了84.9%, POD活性升高了65.2%。對于東海原甲藻(圖1-b), 相對于最適鹽度范圍內的S-30組, 低鹽脅迫下的 S-21組 MDA含量上升了422.2%, 高鹽脅迫下的 S-36組 MDA含量上升了666.4%, 而三個實驗組的 POD活性均過低而無法檢測。結果表明, 在高鹽和低鹽的逆境脅迫下, 兩種藻體內的MDA含量均會升高, 說明兩種藻遭受活性氧的傷害均會提升。此外, POD活性的變化表現出和MDA含量正相關的趨勢。
2.3 不同鹽度作用下兩種藻體內DAO和PAO的變化
如圖2所示, 兩種藻體內 DAO和 PAO隨鹽度的變化趨勢均表現出同步性。中肋骨條藻體內DAO和PAO隨著環境鹽度的升高表現為先升高后降低的趨勢。相對于S-20組, 高鹽脅迫的S-36組, DAO與PAO的活性分別下降了57.8%和56.7%; 低鹽脅迫的S-14組, DAO與 PAO的活性分別下降了 43.1%和20.9%。東海原甲藻體內DAO隨鹽度的升高表現為先降低后升高, 而PAO則表現為下降的趨勢。低鹽脅迫的S-21組與S-30組相比, DAO、PAO分別上升了393.1%、115.3%; S-36組相對于S-30的變化并不顯著。
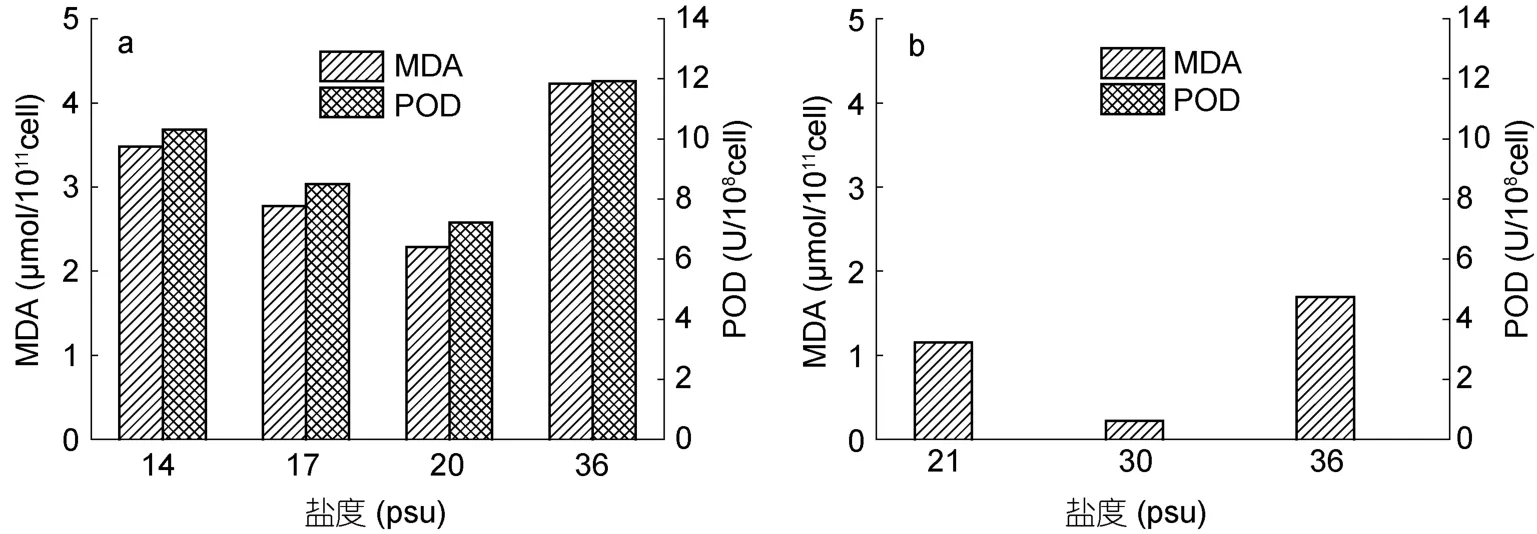
圖1 不同鹽度條件下中肋骨條藻(a)和東海原甲藻(b)的MDA含量和POD活性Fig.1 The MDA content and POD activity of S. costatum s.l.(a) and P. donghaiense(b) under different salinities
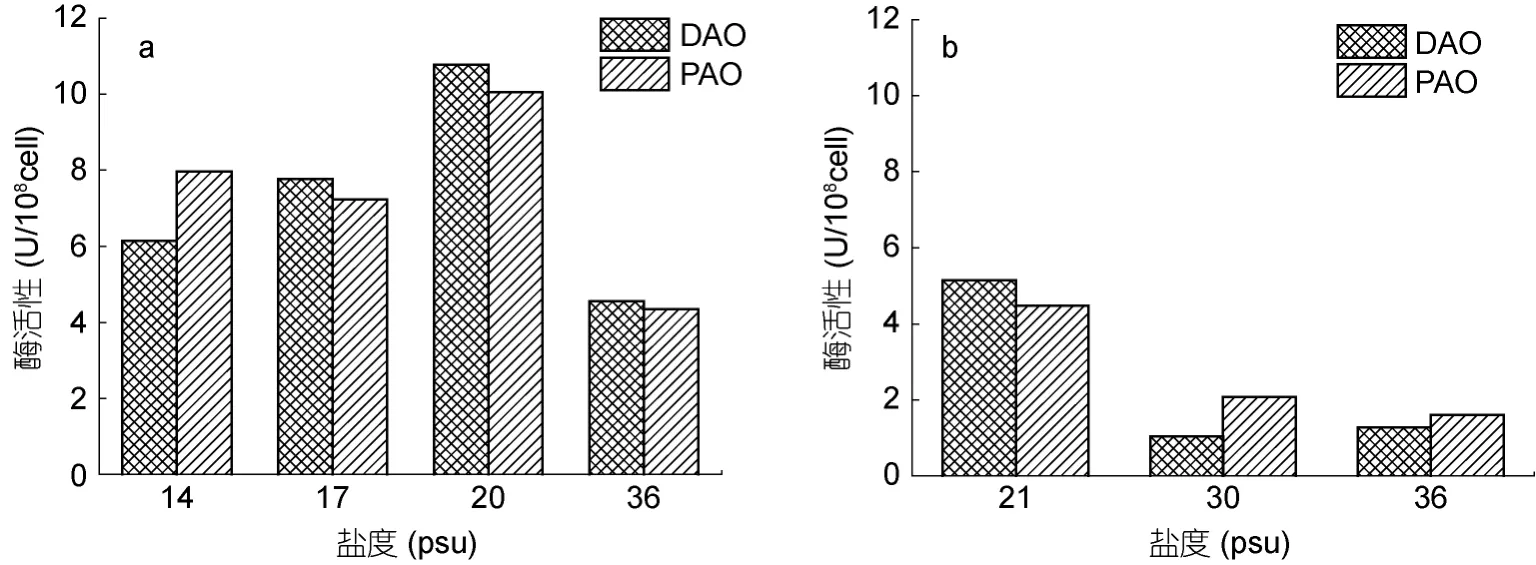
圖2 不同鹽度條件下中肋骨條藻(a)和東海原甲藻(b)的DAO和PAO活性Fig.2 The DAO and PAO activity of S. costatums.l.(a) and P. donghaiense(b) under different salinities
2.4 不同鹽度作用下兩種藻體內多胺的變化
圖3顯示, 隨著鹽度升高, 中肋骨條藻體內總量的Spd和Spm、游離態的Spd和Spm均呈現逐漸升高的趨勢, 結合態的Spd、束縛態的Spd和Spm呈現出先上升后下降的趨勢, 游離態和束縛態的 Put、結合態的 Spm, 則呈現出先降低后升高的趨勢。同時,結合態的Put占總量的百分比呈現先升高后降低的趨勢, 游離態和束縛態 Put的百分比變化趨勢則相反;游離態的 Spd占總量的百分比呈現先降低后升高的趨勢, 結合態和束縛態Spd的百分比變化趨勢則又與之相反。S-36組相對于S-20組, Put、Spd、Spm總量分別升高 130.8%、2.24%、69.4%, 游離態的 Put、Spd、Spm分別升高667.7%、173.5%和462.0%, 結合態的Put、Spm升高17.1%、34.1%, 束縛態的Put則升高166.2%, 而其他形態的多胺含量則出現了下降。同時,游離態多胺的百分數均呈升高之勢, 多胺的存在形態由結合態和束縛態在向游離態轉變。作為低鹽脅迫的S-14組, 與S-20組相比, 各種類和形態的多胺主要呈下降的趨勢, Put、Spd、Spm總量分別降低26.3%、47.9%、37.7%, 游離態的Spd降低45.3%, 結合態的Put、Spd、Spm分別降低81.7%、54.2%、59.7%, 而游離態的 Put則上升 201.4%, 從折線圖可以看出,這一變化表現出腐胺的存在形態由結合態向游離態轉變。
如圖4所示, 隨著培養鹽度升高, 東海原甲藻體內Put、Spd、Spm總量, 游離態的Put、Spd, 結合態的Spm、束縛態的Put、Spd均表現出了逐漸降低的趨勢; 其余的則表現為先降低后升高的趨勢。相對于S-30組, 作為高鹽脅迫的S-36組, Put、Spd、Spm總量分別降低了19.1%、40.0%、19.6%, 游離態的Put、Spd分別下降了58.6%、88.4%, 結合態的 Spm下降了76.7%, 而游離態的Spm、結合態的 Spd、束縛態的Spm則分別上升了107.6%、44.8%、91.6%。同時,腐胺的存在形態會向結合態進行轉變, 亞精胺會由游離態向結合態轉化, 而精胺是由結合態向游離態和束縛態轉化。作為低鹽脅迫的S-21組, 與S-30組相比, Put、Spd、Spm總量分別升高了88.9%、61.1%、57.0%, 游離態的Put、Spd、Spm分別上升了111.4%、62.9%、113.8%, 結合態的Put、Spd、Spm分別上升了158.3%、56.8%、38.2%, 束縛態的Put、Spd、Spm分別上升了14.8%、69.4%、85.2%, 然而存在形態間的相互轉化不明顯。

圖3 不同鹽度下中肋骨條藻體內的多胺總量(a), 腐胺(b)、亞精胺(c)、精胺(d)含量的柱狀圖和所占百分比的折線圖Fig.3 The content of total PAs(a), column for content and line chart for percentage of Put(b), Spd(c), Spm(d) in total content from S.costatum s.l. under different salinities
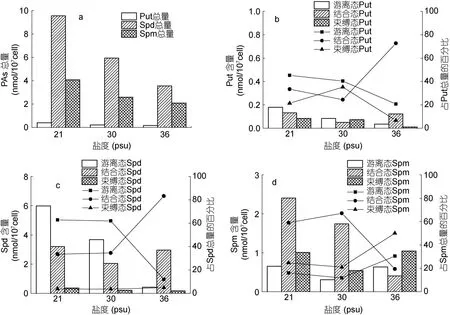
圖4 不同鹽度下東海原甲藻體內的多胺總量(a), 腐胺(b)、亞精胺(c)、精胺(d)含量的柱狀圖和所占百分比的折線圖Fig.4 The content of total PAs(a), column for content and line chart for percentage of Put(b), Spd(c), Spm(d) in total content from P.donghaiense under different salinities
2.5 相關性分析
如圖5所示, 在中肋骨條藻體內, DAO和游離態的 Put具有極顯著的指數反相關(R2=0.990,P=0.0025), 而PAO則與游離態的Spd、Spm具有顯著的指數反相關(R2Spd=0.7998,P=0.04;R2Spm=0.9659,P=0.011)。兩種氧化酶與結合態和束縛態多胺則沒有顯著的相關性。POD同多胺的關系則比較復雜(圖5c), POD與游離態和束縛態的 Put均有顯著的冪正相關(R2free= 0.986,P=0.0037;R2bound=0.801,P=0.020), 而與結合態和束縛態的 Spd均呈極顯著的冪反相關(R2conjugated= 0.928,P=0.007;R2bound=0.891,P=0.005)。

圖5 不同鹽度下中肋骨條藻內二胺氧化酶(a)、多胺氧化酶(b)、POD(c)和多胺的相關性Fig.5 The nonlinear curve fit between DAO and PAs(a), PAO and PAs(b), POD activity and PAs(c) of S. costatums.l. under different salinities
3 討論
當處于鹽度脅迫時, 兩種藻的生長都受到抑制,藻體內的丙二醛含量都有升高, 表明在高鹽和低鹽環境中, 兩種藻細胞內的活性氧已經產生積累, 并對膜系統造成了危害, 導致了丙二醛的逐漸積累, 這可能是脅迫組的兩種藻生長狀況不佳的原因之一。而具有抗逆性的植物體內, 活性氧的含量和抗氧化物酶的活性應該是處于動態均衡的, 測得的過氧化物酶活性的變化趨勢也是與丙二醛的變化相符的, 兩者具有同步性。此外, 過氧化物酶的活性被發現同多胺也具有一定的相關性, 但是其與腐胺和亞精胺的相互作用機理仍有待進一步研究。林定波等(1994)和周玉萍等(2003)在果樹的低溫脅迫中發現, 施加外源亞精胺可增強過氧化物酶的活性; Sarvajeet等(2010)認為腐胺可以提高抗氧化酶的活性和抗氧化劑的含量,同時降低活性氧自由基的生成, 從而加強植物種子對高鹽度的耐受性。本實驗中, POD與游離態和束縛態的Put呈顯著的正相關, 同結合態和束縛態的 Spd卻呈極顯著的反相關。由此推測, 藻體內的腐胺對于過氧化物酶的提高起促進作用, 而結合態和束縛態的亞精胺的作用則有待于進一步的研究。二胺氧化酶作用于腐胺, 而多胺氧化酶作用于亞精胺和精胺, 它們是降解多胺的主要酶。本實驗中, 二胺和多胺氧化酶的活性分別同游離態的Put、Spd和Spm表現為顯著的反相關, 因此在藻體中二胺和多胺氧化酶對游離態多胺的含量產生了直接的調控作用。
中肋骨條藻在高鹽脅迫下, 體內二胺和多胺氧化酶活性下降, 多胺的總量和游離態的多胺含量會顯著上升, 多胺的存在形態會由束縛態和結合態向游離態進行轉變。多胺含量的增長與植物抗逆性的提高是一致的, 多胺既能夠通過歧化反應直接清除活性氧(Azizetal, 1995), 又可以通過提高抗氧化物酶的活性來間接增強植物活性氧清除系統的能力(Droletetal, 1986)。此外, 多胺作為聚陽離子, 可與核酸、蛋白質結合, 穩定其結構和功能, 還可以與生物膜上的帶負電的基團結合, 進而影響膜的流動性和膜結合酶的活性來提升植物體的抗逆境能力(Lomoziket al, 2005)。Liu等(2000)的研究表明, 逆境脅迫時, 多胺含量的上升會作為“化學信使”調節細胞質膜向內的K+通道大小和氣孔的運動, 控制水分的丟失。因此,藻體內多胺含量的增高可以通過上述調節機制來緩解高鹽對中肋骨條藻的傷害, 而游離態多胺的積累可能是用于平衡細胞內外的滲透壓, 以抵御高鹽環境下的滲透壓脅迫。此外, Put總量的增幅(130.8%)遠遠高于Spd(2.24%)和Spm(69.4%), 而POD又同游離態和束縛態的Put呈顯著的正相關, 這表明中肋骨條藻中腐胺對抗高鹽脅迫起著重要作用。東海原甲藻在高鹽脅迫下, 二胺氧化酶活性升高, 多胺氧化酶活性減弱, 游離態 Put、Spd含量下降, 游離態 Spm含量顯著增高, 但是三種多胺總量呈下降趨勢, 而結合態的Spd、束縛態的Spm也有所升高, 藻體內Put和Spd向結合態轉化, Spm的存在形態由結合態向游離態轉化, 這與中肋骨條藻的表現差別很大。Roy等(2002)對轉基因水稻的研究表明亞精胺和精胺含量與水稻的高鹽脅迫密切相關, 耐鹽的水稻在應對脅迫時亞精胺和精胺會增加3—4倍。徐勝利等(2006)發現,多胺可以清除自由基, 而且亞精胺與精胺的作用大于腐胺。因此, 中肋骨條藻體內Spd和Spm的增長對于其在逆境下的生長有重要意義; 而東海原甲藻體內結合態的Spd和游離態的Spm含量的升高可能是其應對高鹽脅迫的響應機制。對比高鹽脅迫下兩種藻的實驗結果可以發現, 鹽度變動 16個單位時, 中肋骨條藻的最大生長速率被抑制了32%, 丙二醛含量上升了84.9%, 而東海原甲藻在鹽度僅升高6個單位時,最大生長速率被抑制了37.4%, 丙二醛的含量升高了666.4%。同時高鹽脅迫下東海原甲藻體內多胺主要呈下降趨勢, 而游離態 Spm的增長幅度顯著低于中肋骨條藻, 這可能是東海原甲藻應對高鹽脅迫的多胺調節能力要弱于廣鹽型的中肋骨條藻所致。現階段對于低鹽傷害的機理仍缺乏研究。本實驗中, 中肋骨條藻在低鹽脅迫下表現為游離態Put顯著增高, 而東海原甲藻體內各種存在形態的多胺均呈現出升高的趨勢, Put的增幅最大, 因此, 兩種藻在應對低鹽脅迫時可能存在著相同的調節機制, 即通過提升游離態的腐胺來增強過氧化物酶的活性, 以應對丙二醛的積累, 從而有利于藻的生長。分析表明, 遭受高、低鹽脅迫時, 兩種藻都會提升多胺含量, 通過多胺的調節作用來緩解脅迫的傷害, 促進生長; 但是在提升的多胺種類和形態上, 兩種藻有很多差異。
向玥如, 史端甫, 馮懷章等, 2014. 多胺參與植物逆境響應過程的作用機理研究進展. 湖南農業科學, 1(1): 19—22
李彩艷, 趙衛紅, 苗輝, 2012. 2010年東海夏季游離態2-苯基乙胺、腐胺、亞精胺和精胺的分布. 海洋科學, 36(4):68—74
汪天, 郭世榮, 劉 俊等, 2004. 多胺氧化酶檢測方法的改進及其在低氧水培黃瓜根系中的應用. 植物生理學通訊,40(3): 358—360
林定波, 劉祖祺, 張石城, 1994. 多胺對柑桔抗寒力的效應.園藝學報, 21(3): 222—226
周玉萍, 王正詢, 田長思, 2003. 多胺與香蕉抗寒性的關系的研究. 廣西植物, 23(4): 252—256
周名江, 朱明遠, 2006. “我國近海有害赤潮發生的生態學、海洋學機制及預測防治”研究進展. 地球科學進展, 21(7):673—679
周名江, 顏天, 鄒景忠, 2003. 長江口鄰近海域赤潮發生區基本特征初探. 應用生態學報, 14(7): 1031—1038
趙衛紅, 王軍, 李彩艷等, 2014. 中肋骨條藻體內及培養液中的游離態多胺. 濟南大學學報(自然科學版), 28(3): 165—169
宮相忠, 唐學璽, 黃健等, 2001. 球等鞭金藻8701的耐低溫機理. 水產學報, 25: 20—25
徐勝利, 陳青云, 陳小青等, 2006. 鹽脅迫下嫁接伽師甜瓜植株生長與多胺以及多胺氧化酶活性的關系. 果樹學報,23(2): 260—265
潘光, 由希華, 谷樹茂等, 2011. 光照、溫度和鹽度對東海原甲藻生長的影響. 中國環境科學學會學術年會論文集(2011): 420—424
霍文毅, 俞志明, 鄒景忠等, 2001. 膠州灣中肋骨條藻赤潮與環境因子的關系. 海洋與湖沼, 32(3): 312—317
Apel K, Hirt H, 2004. Reactive oxygen species: metabolism oxidative stress, and signaling transduction. Annual Review of Plant Biology, 55(1): 373—399
Aziz A, Larher F, 1995. Changes in Polyamine titers associated with the Proline response and osmotic adjustment of rape leaf discs submitted to osmotic stress. Plant Science, 112:175—186
Drolet G, Dumbroff E B, Legge R Letal, 1986. Radical scavenging properties of polyamines. Phytochemistry, 25(2):367—371
Groppa M D, Tomaro M L, Benavides M P, 2001. Polyamines as protectors against cadmium or copper- induced oxidative damage in sunflower leaf discs. Plant Science, 161: 481—488
Liu K, Fu H H, Bei Q Xetal, 2000. Inward potassium channel in guard cells as a target for polyamine regulation of stomatal movements. Plant Physiol, 124(3): 1315—1326
Lomozik L, Gasowska A, Bregier-Jarzebowska Retal, 2005.Coordination chemistry of Polyamines and their interactions in ternary systems including metal ions, nucleosides and nucleotides. Coordination Chemistry Reviews, 249(21—22):2335—2350
Maehly A C, 1955. Plant peroxidase. Methods in Enzymology, 2:801—813
Nayyar H, Chander S, 2004. Protective effects of polyamines against oxidative stress induced by water and cold stress in chickpea. Agronomy & Crop Science, 190(5): 355—365
Nishibori N, Matuyama Y, Uchida Tetal, 2003. Spatial and temporal variations in free polyamine distributions in Uranouchi Inlet, Japan. Marine Chemistry, 82(3—4): 307—314
Nishibori N, Nishijima T, 2004. Changes in polyamine levels during growth of a red-tide causing phytoplankton Chattonella antiqua(Raphidophyceae). European Journal of Phycology, 39(1): 51—55
Sarvajeet S G, Narendra T, 2010. Polyamines and abiotic stress tolerance in plants. Plant Signaling & Behavior, 5(1): 26—33
Roy M, Wu R, 2002. Overexpression of S-adenosylmethionine decarboxylase gene in rice increases polyamine level and enhances sodium chloride-stress tolerance. Plant Science,163(5): 987—992
Yang H Y, Shi G X, Wang H Yetal, 2010. Involvement of Polyamines in adaptation ofPotamogeton crispusL. to cadmium stress. Aquatic Toxicology, 100(3): 282—288

