響應面優化誘導子促進印楝懸浮細胞培養產印楝素的研究
張云竹++方佳++鐘秋平
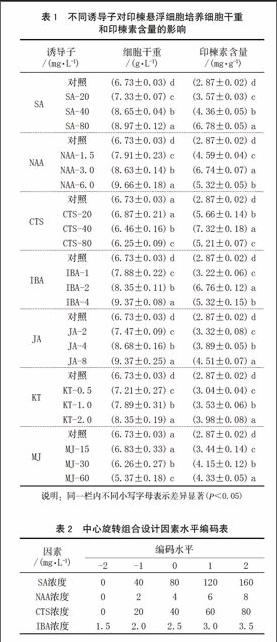
摘 要 通過單因素實驗法研究了水楊酸(SA)、萘乙酸(NAA)、殼聚糖(CTS)、吲哚丁酸(IBA)、茉莉酸(JA)、激動素(KT)和甲基茉莉酸(MJ) 等7種誘導劑對印楝懸浮細胞培養產印楝素的作用,篩選出SA、NAA、CTS、IBA等4種刺激效果明顯的誘導劑,利用響應面法優化了該4種誘導劑的最佳組合為SA 92.00 mg/L、NAA 6.0 mg/L、CTS5 4.0 mg/L和IBA 3.0 mg/L,得到印楝素含量的實際值為8.61 mg/g,與理論預測值8.69的相對誤差為0.92%。回歸方程的預測值和實驗值差異不顯著,所得回歸方程模型擬合情況良好,符合要求。
關鍵詞 印楝 ;細胞懸浮培養 ;印楝素 ;響應面
分類號 S722.7
印楝(Azadirachta indica A. Juss)是一種極其安全的藥用資源植物[1],在農業、醫藥、環保、化妝及食品中應用廣泛[2-4]。起藥用效果的主要是印楝籽通過次級代謝產生的印楝素,不僅具有高效殺蟲、拒食等功效,還能抑制生長發育、胃毒、呼吸和昆蟲激素分泌等,并具有降低昆蟲生育能力和殺滅微生物等作用[5-9]。但印楝籽1 a只產1次,數量有限,不能長久保存,且印楝籽中的印楝素含量受種源、降雨、種子形態、采樣期和組培條件等因素的影響[10-11]。由于從印楝籽中提取印楝素具有局限性,因此采用懸浮細胞培養規模化開發印楝素則是行之有效的方法。梁軍等[12]建立了印楝懸浮細胞培養體系,Balaji等[13]考察了生物及非生物誘導子對印楝懸浮細胞培養產印楝素的影響。考慮到誘導子之間存在協同效應,本試驗研究不同誘導子如SA、NAA、CTS、IBA、JA、KT及MJ對印楝懸浮細胞培養產印楝素的影響,選擇最優誘導劑,并考察它們之間相互作用的效果,以期為提高懸浮培養細胞的印楝素產量提供依據。
1 材料與方法
1.1 材料
印楝愈傷組織來自野生印楝籽源經固體培養基多次繼代誘導培養產生的生長旺盛、色澤嫩黃、疏松易碎的組織。
1.2 懸浮培養系的誘導
將2 g愈傷組織接種到裝有40 mL MS液體培養基的100 mL三角瓶中,內含不同濃度誘導子。接種后置于旋轉搖床振蕩培養,搖床轉速為90 r/min,溫度為25℃。
1.3 懸浮培養系的建立
將生長良好的細胞株培養液30 mL接種到內含蔗糖40 g/L+BA 2.0 mg/L的MS液體培養基中,500 mL的三角瓶裝液量為150 mL,25 ℃培養,每天光照16 h/黑暗8 h。
1.4 誘導子的篩選
分別選用SA、NAA、CTS、IBA、JA、KT及MJ作為誘導子,其濃度如表1所示。將不同濃度的誘導子在懸浮培養誘導時加入,培養約8 d后接入已建立的懸浮培養系中,培養至第15天時收集細胞并分析印楝素的含量。用水和95%乙醇溶解的誘導子,在對照試驗時分別加入同樣量的水和乙醇。
1.5 響應面優化
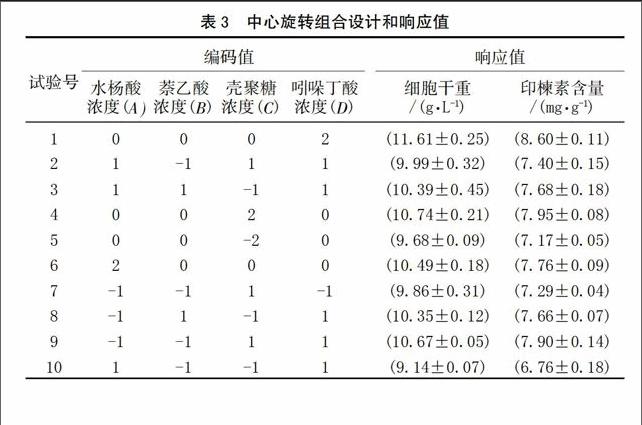
根據單因素實驗結果,分別選用SA、NAA、CTS及IBA作進一步的優化實驗,實驗水平如表2所示。每組實驗培養至第15天時分別收集細胞并測定印楝素的含量。
1.6 細胞干重的測定
將培養好的細胞懸浮液,搖勻后取100 mL,3 000 r/min 離心20 min,沉淀用蒸餾水清洗2次,50℃烘干至恒重,稱量即為細胞干質量。
1.7 印楝素的提取和測定
用甲醇萃取干細胞中的印楝素,萃取參考梁軍等[12]的方法。萃取液用0.45 μm濾膜過濾,清液采用HPLC法檢測樣品中印楝素的含量。色譜條件為C-18柱,乙腈∶水(10∶90)為流動相,流速為0.5 mL/min,檢測波長為214 nm,柱溫30℃。結果以1 g干愈傷組織中印楝素的mg數表示。
1.8 統計分析
數據統計采用采用SPSS與Design Expert 8.0.6統計軟件進行分析。
2 結果與分析
2.1 不同誘導子對印楝懸浮細胞產印楝素的影響
2.1.1 SA對印楝懸浮細胞產印楝素的影響
SA對細胞干重和印楝素含量影響如表1所示。從表1可以看出,細胞干重和印楝素含量隨著SA濃度的提高而提高,當SA濃度為20 mg/L時,印楝素的含量為對照的1.24倍。當SA濃度提高至80 mg/L時,印楝素含量急劇增加為對照的2.36倍。在SA所試的各種濃度之間及各濃度與對照之間,印楝素含量差異顯著(P<0.05),說明SA能有效誘導懸浮細胞合成印楝素。SA對印楝懸浮細胞的生長也有顯著影響,SA各濃度間及各濃度與對照間差異顯著(P<0.05)。由此說明,SA不僅可以刺激印楝懸浮細胞的生長,而且還可以促進印楝素的生物合成。SA是一種已知的系統獲得性抗性(SAR)途徑的誘導劑[14],其中一些抗性途徑可能與印楝素的合成有關。
2.1.2 NAA對印楝懸浮細胞產印楝素的影響
NAA對印楝懸浮細胞生長有促進作用,在所試的濃度范圍內,細胞干重隨著NAA濃度的增加而增加,但印楝素的累積卻呈現先增加后降低的趨勢(表1),在NAA濃度為3.0 mg/L時,印楝素含量最大。考慮到細胞生長和印楝素的累積,NAA的濃度不能太高。
2.1.3 CTS對印楝懸浮細胞產印楝素的影響
CTS在一些懸浮細胞培養中被證明是一有效的次級代謝產物形成的促進劑[15]。對于印楝懸浮系的生長來講,CTS的濃度不能太高,過高的CTS濃度對印楝細胞產生了毒害作用;對于印楝素合成來講,較低的CTS濃度有利于印楝素的累積。當CTS濃度為40 mg/L時,細胞干重雖然比對照低,但印楝素的含量卻顯著高于對照,約為對照的2.55倍。因此,CTS濃度為40 mg/L左右為宜。
2.1.4 IBA對印楝懸浮細胞產印楝素的影響
IBA對懸浮細胞生長及印楝素合成的影響同NAA。細胞干重隨IBA濃度的提高而提高,印楝素含量隨IBA濃度的提高先升后降,在IBA濃度為2.0 mg/L時具有最高含量的印楝素,可見2.0 mg/L的IBA最好。
2.1.5 JA、KT和MJ對印楝懸浮細胞產印楝素的影響
JA和KT對懸浮細胞的生長有促進作用,MJ只有在低濃度即15 mg/L時,對懸浮細胞生長有利,高濃度對細胞生長有毒害作用。對印楝素合成和累積而言,在所試的濃度范圍內,JA、KT和MJ雖能有效促進印楝素的合成和累積,但效果沒有SA、NAA、CTS及IBA顯著,與對照相比,印楝素含量僅有對照的1.06-1.57倍,提高的幅度遠低于上述4種誘導劑。
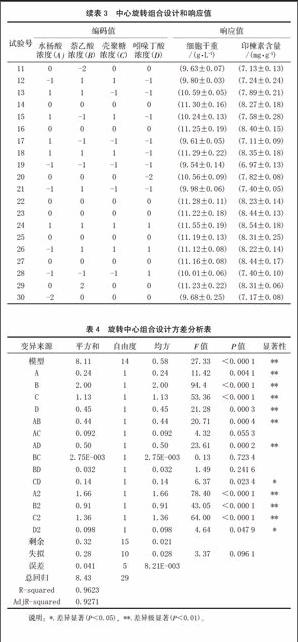
2.2 印楝懸浮細胞產印楝素的響應面分析
以印楝素含量為響應值的響應面試驗設計與結果見表3,得到印楝素含量(Y)對SA(A)、NAA(B)、CTS(C)、IBA(D)經剔除不顯著項后的二次多項回歸模型為:
Y=2.855+0.037A+0.246 B+0.026 C+1.634 D+0.002 AB-0.009 AD+0.009 CD-1.538 E-004 A2-0.0456 B2-5.559 E-004 C2-0.239 D2
為了檢驗方程的有效性,對印楝素含量的數學模型進行方差分析(表4)。從表4可知,印楝素含量為響應值時,該二次方程模型有統計學意義(P<0.010 0)。回歸方程失擬性檢驗無統計學意義(P=0.096 1),表明未知因素對試驗結果干擾很小;回歸方程的相關系數(R2=0.962 3)及變異系數CV(1.87%)均表明模型方程能夠較好地反映真實的試驗值。該方程與實際情況擬合很好,較好地反映了印楝素含量與SA、NAA、CTS和IBA的關系,因此所得的回歸方程能較好地預測印楝素含量隨各參數的變化規律。實驗所選4個因素中A,B,C,D和AB、AD、CD 以及二次項的影響差異有統計學意義,其中A、B、C、D 為極有統計學意義,說明SA、NAA、CTS和IBA均對印楝素含量有極顯著影響,SA影響最弱,但也達到了極顯著水平(P<0.01),并且AB、AD、CD交互作用極明顯。綜合以上各參數,表明該實驗方法可靠,各因素水平間設計合理,因此可用該回歸模型代替實驗真實點對結果進行分析。
響應面圖形是響應值對各試驗因子A、B、C、D 所構成的三維空間的曲面圖,從響應面分析圖上可形象地看出最佳參數及各參數之間的相互作用。根據回歸方程得出不同因子的響應面分析圖及相應等高線圖,分析兩兩因素交互作用對印楝素含量的影響。通過 Design Expert 8.0.6 軟件對各因素之間的交互作用進行響應面分析,根據方差分析結果,SA和IBA、SA和NAA、CTS和IBA之間交互作用呈極顯著或顯著[8]。NAA濃度一定,當SA濃度小于90 mg/L左右時,印楝素含量隨著SA濃度的提高而增大,SA濃度超過90 mg/L時,印楝素含量開始下降,變化明顯(圖1);SA濃度一定,印楝素含量隨著IBA濃度的增加而增加,IBA濃度3.0 mg/L時達到最大值(圖2);IBA濃度一定,印楝素含量隨著CTS濃度的提高而增加,當CTS濃度達54 mg/L左右時,印楝素含量達最大值,此后隨著CTS濃度的進一步增加,印楝素含量則降低(圖3)。其他交互作用方差分析P值均大于0.05,表明對于印楝素含量的影響,交互作用不明顯。
2.3 懸浮細胞發酵產印楝素最優工藝及其驗證
NAA、CTS和IBA是影響印楝素含量的最主要因素,SA次之,選擇合適的發酵條件,可獲得較高的印楝素含量。對響應面結果進行最優分析,以印楝素含量最高為評價指標,確定發酵工藝的最佳條件如下:SA 91.60 mg/L、NAA 6.00 mg/L、CTS 54.28 mg/L、IBA 3.00 mg/L,理論預測印楝素含量為8.69 mg/g。
為實驗方便,4種誘導劑的濃度分別調整為SA 92.00 mg/L、NAA 6.0 mg/L、CTS 54.0 mg/L、IBA 3.0 mg/L,得到印楝素含量的實際值為8.61 mg/g,該值與理論預測值8.69的相對誤差為0.92 %,說明該模型具有好的分析能力,可為實際操作提供良好的指導。
3 結論
通過對誘導劑誘導印楝懸浮細胞產印楝素的研究發現,在一定濃度范圍內,SA、NAA、CTS、IBA、JA、KT及MJ皆能使印楝懸浮細胞生長,并促進懸浮細胞累積印楝素,前4種誘導劑的誘導效果明顯好于后3種誘導劑。經對前4種誘導劑的進一步優化,將差異不顯著的因素剔除后的回歸方程為:
Y=2.855+0.037A+0.246B+0.026C+1.634D+0.002 AB-0.009AD+0.009CD-1.538E-004A2-0.0456 B2-5.559E-004C2-0.239D2
SA、NAA、CTS和IBA的最佳組合為SA 92.00 mg/L、NAA 6.0 mg/L、CTS 54.0 mg/L、IBA 3.0 mg/L,得到印楝素含量的實際值為8.61 mg/g,該值與理論預測值8.69的相對誤差為0.92 %,能為實際操作提供良好的指導。
參考文獻
[1] Shmutyerer H.Properties and potential of natural pesticides from the neem tree[J].Annu Rev Enmmol, 1990, 35(5): 271-297.
[2] 林靖凌,蔡春茂,彭黎旭. 印楝種仁粗提物對植物病原菌的抑制作用研究[J]. 安徽農業科學,2008,36(11):4 566-4 567.
[3] 程少敏,鄧忠賢. 新型生物殺蟲劑印楝素的應用[J]. 農藥,2011,10:46-47.
[4] Bradley M, Katie S, Julia A. in: Mcmillan (Ed.),Neem, A Tree for Solving Global Problems,National Research council, USA[J]. Blackwell Science Inc,1992: 60-70.
[5] 賈建文,黃勁飛,王文祥,等. 不同殺蟲成分對Sf9細胞凋亡的影響[J]. 華南農業大學學報,2009,30(4):29-36.
[6] Mordue A J, Blackwell A. Azadirachtin: an update [J]. Journal of Insect Physiology, 1993, 39: 903-924.
[7] Sayah F, Idaomar M, Soranzo L. Endocrine and neuroendocrine effects of azadirachtin in adult females of the earwig Labidura riparia[J]. Tissue and Cell, 1998, 30(1): 86-94.
[8] 徐漢虹. 殺蟲植物與植物性殺蟲劑[M]. 北京:中國農業出版社,2001.
[9] Trand X, Tsuzuki E, Terao H, et al. Evaluation on phytotoxicity of neem (Azadirachta indica. A. Juss). to crops and weeds[J]. Crop Protection, 2004, 23: 335-345.
[10] 王瑞波. 印楝的生長及其印楝素含量的初步研究[D].碩士學位論文,云南:云南大學,2004.
[11] 彭興民,吳疆翀,程金煥.印楝農藥原料林優樹選擇方法與標準[J]. 福建林學院學報,2010,30(3):265-269.
[12] 梁 軍,魏 剛,呂 全,等. 印楝細胞懸浮培養系的建立及懸浮培養[J]. 林業科學研究,2003,16(5):568-574.
[13] Balaji K, Veeresham C, Srisilam K, et al. Azadirachtin, a novel biopesticide from cell cultures of Azadirachta indica[J]. Plant Biotechnol,2003, 5: 121-129.
[14] Zhang W, Yang X F, Qiu D W, et al. Pea Tl-induced systemic acquired resistance in tobacco follows salicylic acid-dependent pathway[J]. Mol Biol Rep, 2011, 38: 2 549-2 556
[15] Funk C, Brodelius P. Influence of growth regulator and an elicitor on phenyl propanoid metabolism in suspension cultures of Vanilla plantifolia[J]. Phytochemistry, 1990, 29: 818-828.

