百蕊草根系總RNA提取方法比較及優(yōu)化
劉波 張曉明 郭巧生 等
摘要:百蕊草根系富含多糖、多酚和其他次生代謝產(chǎn)物,用傳統(tǒng)方法提取總RNA難以有效將這些雜質(zhì)去除。以百蕊草根系為材料,比較TRIzol法、CTAB-LiCl法、SDS/酚法及改進(jìn)TRIzol法4種方法對(duì)百蕊草根系總RNA的提取效果,并以電泳檢測(cè)、D260 nm/D280 nm比值測(cè)定、RT-PCR試驗(yàn)等對(duì)結(jié)果進(jìn)行分析評(píng)價(jià)。結(jié)果表明,4種方法均能提取百蕊草根中總RNA,提取效果差異顯著;改進(jìn)TRIzol法提取總RNA的28S和18S條帶清晰,無(wú)彌散,28S亮度比18S加倍,完整性好,無(wú)明顯DNA或其他雜質(zhì)污染,D260 nm/D280 nm值為1.8~2.0,D260 nm/D230 nm值大于2.0,總RNA得率僅次于TRIzol法;用改進(jìn)TRIzol法提取總RNA,反轉(zhuǎn)錄cDNA片段大小分布在0.2~2.5 kb,可擴(kuò)增出目的基因片段,提取的總RNA完全適用于后續(xù)的分子生物學(xué)研究。
關(guān)鍵詞:百蕊草;總RNA提取;多糖;多酚;TRIzol法;RT-PCR
中圖分類(lèi)號(hào): Q522文獻(xiàn)標(biāo)志碼: A文章編號(hào):1002-1302(2015)01-0044-03
收稿日期:2014-03-25
基金項(xiàng)目:國(guó)家自然科學(xué)基金(編號(hào):81202867)。
作者簡(jiǎn)介:劉波(1989—),男,浙江衢州人,碩士,主要從事藥用植物栽培生理研究。E-mail:2011104175@njau.edu.cn。
通信作者:郭巧生,博士,教授,主要從事藥用植物資源開(kāi)發(fā)。E-mail:gqs@njau.edu.cn。百蕊草(Thesium chinense Turcz.)為檀香科百蕊草屬半寄生植物,全草入藥,具有清熱解毒、止咳化痰等功效[1],被稱為植物抗生素[2],具有重要的藥用價(jià)值。百蕊草根系可形成寄生根侵入寄主植物[3-4],通過(guò)寄生根從寄主植物獲得水分和養(yǎng)分。目前,對(duì)百蕊草的研究主要集中在藥理成分、提取工藝、組織培養(yǎng)等方面[2,5-9],在分子水平上的研究較少,至今未見(jiàn)有關(guān)百蕊草根系總RNA提取方面的報(bào)道。
植物組織RNA的提取是開(kāi)展后續(xù)植物分子生物學(xué)研究的必要前提。進(jìn)行RT-PCR、cDNA合成、Northern印跡雜交、SSH篩選差異基因等分子生物學(xué)相關(guān)研究,均需要完整性好、純度高的RNA。因此,如何提高RNA純度和經(jīng)濟(jì)快捷獲得足夠量的RNA是當(dāng)前研究人員十分關(guān)注的問(wèn)題。百蕊草根系化學(xué)成分復(fù)雜,富含多糖及酚類(lèi)物質(zhì)[10]。酚類(lèi)化合物容易氧化產(chǎn)生褐化效應(yīng)[11],在RNA提取過(guò)程中與RNA不可逆結(jié)合,導(dǎo)致RNA降解或RNA活性喪失[12];多糖能與RNA共沉淀形成難溶的膠狀物,抑制許多酶的活性[13]。為此,本試驗(yàn)開(kāi)展TRIzol法、CTAB-LiCl法、SDS/酚法[14-16]、優(yōu)化改進(jìn)TRIzol法提取百蕊草根系總RNA研究,以期篩選出一種理想的百蕊草根系RNA提取方法,為今后利用分子生物學(xué)研究百蕊草寄生機(jī)理提供技術(shù)參考。
1材料與方法
1.1試驗(yàn)材料
野生百蕊草采集于南京市附近,選挖長(zhǎng)勢(shì)良好的植株,清洗根系,立即投入液氮中冷凍保存,備用。原植物經(jīng)南京農(nóng)業(yè)大學(xué)郭巧生教授鑒定為檀香科植物百蕊草。
1.2總RNA提取方法
1.2.1TRIzol法取0.1 g植物組織,在液氮中研磨至粉末狀后轉(zhuǎn)移到1.5 mL離心管中;加入1 mL預(yù)冷的TRIzol,渦旋混勻,室溫放置5 min;加入200 μL氯仿,振蕩1 min,室溫放置15 min,4 ℃、12 000 r/min離心15 min;吸取上層水相至新離心管中,加入500 μL預(yù)冷的異丙醇,振蕩混勻,室溫放置 10 min,4 ℃、12 000 r/min離心10 min;棄上清,加入1 mL 75%乙醇,振蕩,使沉淀浮起,懸浮1 min,4 ℃、7 500 r/min離心5 min;棄置上清,空氣中干燥5 min,加入50 μL ddH2O溶解,-70 ℃保存。
1.2.2CTAB-LiCl法將2×CTAB 提取液于65 ℃水浴鍋中預(yù)熱;取0.2 g樣品于液氮中研磨成粉末,轉(zhuǎn)入2 mL離心管中,加700 μL提取液和20 μL β-巰基乙醇,劇烈振蕩混勻;65 ℃水浴10 min,其間振蕩數(shù)次,冷卻到室溫后加等體積比例為25 ∶24 ∶1的苯酚、氯仿、異戊醇混合液,充分振蕩,冰浴10 min,4 ℃、12 000 r/min離心10 min;取上清至2 mL新離心管中,重復(fù)上述步驟,再抽提1次;取上清于1.5 mL離心管中,加入1/4體積的10 mol/L LiCl溶液,4 ℃過(guò)夜,4 ℃、12 000 r/min 離心20 min;棄上清,沉淀用500 μL ddH2O溶解,加等體積比例為24 ∶1的氯仿、異戊醇溶液再抽提1次,4 ℃、12 000 r/min離心10 min;上清液中加入1/10體積、pH值為52、濃度3 mol/L的乙酸鈉和等體積預(yù)冷的異丙醇,-20 ℃ 沉淀3 h,4 ℃、12 000 r/min離心10 min;棄上清,用75%乙醇清洗沉淀,室溫干燥,ddH2O溶解,-70 ℃保存。
1.2.3SDS/酚法取0.2 g樣品于液氮中研磨成粉末,加入80 ℃預(yù)熱的提取緩沖液850 μL;加入PVP和β-巰基乙醇,充分混勻,冰浴15 min,4 ℃、12 000 r/min離心15 min;上清液中加入1/3體積、pH值為4.8、濃度為5 mol/L的乙酸鉀,冰浴15 min,4 ℃、12 000 r/min離心15 min;上清液中加入等體積、比例為24 ∶1的氯仿、異戊醇溶液,充分混勻,冰浴 10 min,4 ℃、12 000 r/min離心15 min;上清液中加入等體積預(yù)冷異丙醇,-20 ℃放置3 h,4 ℃、12 000 r/min離心15 min;棄上清液,用600 μL重懸緩沖液重懸沉淀,4 ℃、12 000 r/min離心15 min;75%乙醇清洗沉淀,室溫干燥,ddH2O溶解,-70 ℃ 保存。
1.2.4改進(jìn)TRIzol法在TRIzol法基礎(chǔ)上,在加入TRIzol試劑的同時(shí),加入20 μL β-巰基乙醇,用異丙醇沉淀后,加入500 μL ddH2O溶解沉淀,加入1/4體積的10 mol/L LiCl溶液,-20 ℃下靜置6 h,4 ℃、12 000 r/min離心20 min;棄上清,沉淀用500 μL ddH2O溶解,加等體積比例為24 ∶1的氯仿、異戊醇溶液再抽提1次,4 ℃、12 000 r/min離心10 min;取上清,加1/10體積pH值為5.2、濃度為3 mol/L的乙酸鈉和等體積預(yù)冷的異丙醇,-20 ℃沉淀3 h,4 ℃、12 000 r/min離心10 min;棄上清,用75%乙醇清洗沉淀,室溫干燥,ddH2O溶解,-70 ℃保存。
1.3總RNA質(zhì)量檢測(cè)
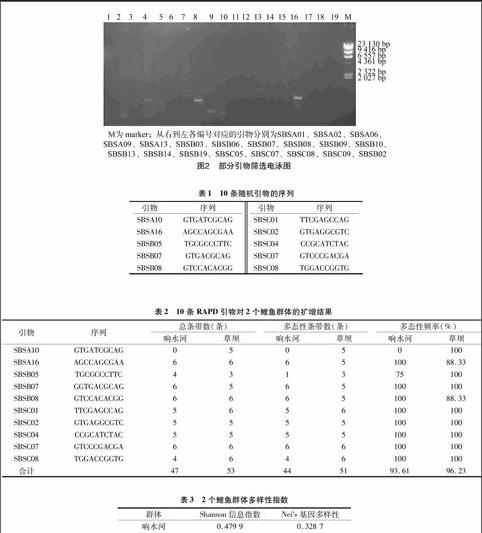
1.3.1總RNA完整性檢測(cè)分別取由4種總RNA提取方法獲得的百蕊草根系總RNA,在1.2%非變性瓊脂糖凝膠上電泳檢測(cè),3次重復(fù)。
1.3.2總RNA純度及得率檢測(cè)用紫外分光光度計(jì)測(cè)定所提取RNA樣品的D230 nm、D260 nm、D280 nm值,計(jì)算D260 nm/D280 nm、D260 nm/D230 nm,評(píng)價(jià)總RNA純度;同時(shí),測(cè)定總RNA濃度并計(jì)算得率。
1.4改進(jìn)TRIzol法提取總RNA完整性的RT-PCR檢驗(yàn)
cDNA第1鏈的合成參照Thermo Scientific公司RevertAid First Strand cDNA Synthesis Kit操作說(shuō)明書(shū)進(jìn)行。采用25 μL PCR反應(yīng)體系:1 μL逆轉(zhuǎn)錄產(chǎn)物, 1 μLTcActin正向引物:5′-ACCACTGCTGAGCGGGAAA-3′, 1 μL反向引物:5′-CTGCAATGCCAGGGAACA-3′,15.3 μL 滅菌ddH2O, 2.5 μL 10×PCR buffer,2 μL 25 mmol/L MgCl2 ,2 μL 2.5 mmol/L dNTP ,0.2 μL Taq DNA聚合酶。PCR反應(yīng)程序?yàn)椋?4 ℃預(yù)變性5 min;94 ℃變性30 s,58 ℃退火30 s,72 ℃延伸1 min,28個(gè)循環(huán);72 ℃延伸5 min。反應(yīng)完畢后取5 μL于1.5%瓊脂糖凝膠上進(jìn)行電泳分析。
2結(jié)果與分析
2.1不同提取方法對(duì)總RNA完整性的影響
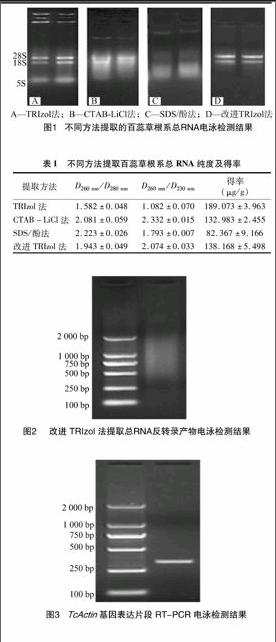
由圖1可見(jiàn),4種方法提取的總RNA完整性和基因組DNA殘留程度有較大差異;TRIzol法提取的RNA電泳條帶清晰,可見(jiàn)28S、18S、5S條帶,且28S的亮度較18S高,RNA完整性較好,但靠近電泳點(diǎn)樣孔附近有亮斑,可能存在蛋白質(zhì)、糖類(lèi)等雜質(zhì)殘留;CTAB-LiCl法提取的RNA電泳呈彌散分布,28S和18S處略微可見(jiàn)且亮度較高,但條帶不夠清晰,這說(shuō)明此方法提取的RNA已經(jīng)有所降解,提取的RNA中可能存在基因組DNA;SDS/酚法提取的RNA電泳彌散最為嚴(yán)重,存在基因組DNA殘留;改進(jìn)的TRIzol法提取的RNA電泳可見(jiàn)清晰的28S和18S條帶,且28S比18S亮度加倍,且完整性好,提取的RNA樣品中無(wú)明顯基因組DNA殘留。
2.2不同提取方法的總RNA純度和得率
D260 nm/D280 nm和D260 nm/D230 nm是對(duì)提取的核酸純度和產(chǎn)率進(jìn)行定量分析的通用方法,高純度的RNA溶液D260 nm/D280 nm應(yīng)介于1.8~2.0之間,D260 nm/D230 nm應(yīng)大于2.0。由表
1可見(jiàn),TRIzol法提取的RNA溶液D260 nm/D280 nm僅為1.582,可能存在蛋白質(zhì)和酚等有機(jī)物殘留,純度過(guò)低;CTAB-LiCl法、SDS/酚法、改進(jìn)TRIzol法D260 nm/D280 nm分別為2.081、2223、1.943,均有效去除了蛋白質(zhì)和酚等物質(zhì);CTAB-LiCl法和改進(jìn)TRIzol法D260 nm/D230 nm均大于2.0,即對(duì)酚類(lèi)和糖類(lèi)等有機(jī)物質(zhì)可以有效去除;4種方法中,RNA提取產(chǎn)率最高的為T(mén)RIzol法,而CTAB-LiCl法、SDS/酚法、改進(jìn)TRIzol法提取RNA的產(chǎn)率與TRIzol法相比,依次約能達(dá)到TRIzol法的70.3%、43.6%、73.1%。
表1不同方法提取百蕊草根系總RNA純度及得率
提取方法D260 nm/D280 nmD260 nm/D230 nm得率
(μg/g)TRIzol法1.582±0.0481.082±0.070189.073±3.963CTAB-LiCl法2.081±0.0592.332±0.015132.983±2.455SDS/酚法2.223±0.0261.793±0.00782.367±9.166改進(jìn)TRIzol法1.943±0.0492.074±0.033138.168±5.498
2.3改進(jìn)TRIzol法提取總RNA的完整性驗(yàn)證
以改進(jìn)TRIzol法提取的總RNA為模板進(jìn)行反轉(zhuǎn)錄,產(chǎn)物經(jīng)1.5%瓊脂糖凝膠電泳檢測(cè),可看出反轉(zhuǎn)錄的cDNA片段呈彌散分布,大小主要集中分布在0.2~2.5 kb(圖2)。該結(jié)果基本吻合植物RNA長(zhǎng)度的一般范圍,反映該cDNA的模板mRNA比較完整,提取的RNA質(zhì)量較高,可以滿足后續(xù)分子生物學(xué)試驗(yàn)要求。
對(duì)百蕊草TcActin基因保守區(qū)序列進(jìn)行RT-PCR擴(kuò)增,以進(jìn)一步驗(yàn)證改進(jìn)方法提取RNA的完整性。由圖3可見(jiàn),百蕊草TcActin基因保守區(qū)序列能得到片段長(zhǎng)度約為330 bp的擴(kuò)增產(chǎn)物,PCR產(chǎn)物經(jīng)測(cè)序長(zhǎng)度為333 bp,擴(kuò)增片段長(zhǎng)度與預(yù)計(jì)的檀香科Actin基因保守區(qū)序列長(zhǎng)度一致,這說(shuō)明改進(jìn)的TRIzol方法提取總RNA保持了表達(dá)基因的完整性。
3討論
純度高、完整性好的RNA是進(jìn)行分子克隆及基因表達(dá)分析的基礎(chǔ)[17]。近年來(lái),關(guān)于植物RNA提取方法的報(bào)道逐漸增多[18-20]。由于多數(shù)植物材料成分復(fù)雜,特別是糖類(lèi)和酚類(lèi)等有機(jī)物質(zhì)對(duì)RNA提取的干擾很大[21-22]。酚類(lèi)物質(zhì)容易氧化形成褐化效應(yīng),與RNA不可逆結(jié)合,嚴(yán)重降低了RNA的質(zhì)量和產(chǎn)率;含有多糖的RNA沉淀難溶于水,即使通過(guò)加熱等方式溶解,溶液也呈黏稠狀。目前,去除多糖的方法主要有高濃度NaCl沉淀法、LiCl沉淀法、乙酸鉀沉淀法等。
TRIzol試劑原本用于提取動(dòng)物組織RNA,因其操作步驟簡(jiǎn)便,全程只需1~2 h,后被開(kāi)發(fā)提取植物組織RNA,且對(duì)多種植物組織RNA的提取十分有效[18]。較高濃度的CTAB不僅對(duì)植物細(xì)胞具有良好的裂解作用,有效形成核蛋白與核酸的復(fù)合物,而且還能與β-巰基乙醇聯(lián)合作用使蛋白變性,抑制RNA酶的活性[23]。CTAB作為陽(yáng)離子表面活性劑成分,從富含多糖、多酚材料中分離出高質(zhì)量RNA已經(jīng)在多種植物材料中得到驗(yàn)證。
傳統(tǒng)TRIzol法提取的百蕊草根系總RNA沉淀呈褐色,且很難溶于水中,稍加熱溶解沉淀后有淡黃色的膜狀物質(zhì),不能有效去除酚類(lèi)和糖類(lèi)物質(zhì),但是通過(guò)凝膠電泳檢測(cè)發(fā)現(xiàn),TRIzol法提取的總RNA完整性良好,對(duì)RNA酶的抑制能力強(qiáng),可有效避免降解;CTAB-LiCl法獲得的RNA沉淀沾水即溶,結(jié)合凝膠電泳及OD值測(cè)定,該方法可有效去除蛋白質(zhì)、酚類(lèi)、糖類(lèi)等有機(jī)物質(zhì),但存在基因組DNA污染,且不能有效抑制RNA酶的活性,出現(xiàn)RNA降解,這意味著提取的失敗。
結(jié)合TRIzol法能夠有效抑制RNA酶活性和CTAB-LiCl法能有效去除蛋白質(zhì)、酚類(lèi)、糖類(lèi)等有機(jī)物質(zhì)的特點(diǎn),優(yōu)化百蕊草根系總RNA提取方法,形成改進(jìn)的TRIzol法,即在提取時(shí)加入β-巰基乙醇,該物質(zhì)不僅能打開(kāi)蛋白酶的二硫鍵使酶失活,從而抑制酚類(lèi)氧化酶和RNA酶的活性,也能與酚類(lèi)產(chǎn)生競(jìng)爭(zhēng)性氧化,可有效避免褐化現(xiàn)象[24]。另外,LiCl沉淀可去除部分多糖,多次的酚/氯仿抽提也基本去除了蛋白質(zhì)、酚類(lèi)、糖類(lèi)等有機(jī)物質(zhì)。改進(jìn)TRIzol法提取總RNA,雖然RNA的得率有所降低,但獲得的RNA質(zhì)量高,可以滿足后續(xù)的分子生物學(xué)試驗(yàn)。
參考文獻(xiàn):
[1]江蘇新醫(yī)院. 中藥大辭典上冊(cè)[M]. 上海:上海科學(xué)技術(shù)出版社,1977:866.
[2]鐘方麗,王曉林,紀(jì)萍萍,等. 百蕊草中總黃酮的提取工藝研究[J]. 吉林化工學(xué)院學(xué)報(bào),2008,25(4):5-7.
[3]羅夫來(lái),郭巧生,王長(zhǎng)林,等. 百蕊草生物學(xué)特性研究[J]. 中國(guó)中藥雜志,2012,37(2):176-180.
[4]Guo Q S,Luo F L. Comparative studies on the growth,chlorophyll,amino acids and minerals of Thesium chinense (Santalaceae) in association with different hosts[J]. Nordic Journal of Botany,2010,28(5):632-640.
[5]袁藝,龍子江,許霞,等. 百蕊草野生苗與組培苗抑菌抗炎實(shí)驗(yàn)比較的研究[J]. 藥物生物技術(shù),2006,13(3):219-222.
[6]楊軍,王靜,高美華,等. 百蕊片藥理作用的實(shí)驗(yàn)研究[J]. 中國(guó)中藥雜志,1999,24(6):47-49.
[7]曹明成. 百蕊草提取工藝研究[J]. 現(xiàn)代中藥研究與實(shí)踐,2004,18(1):57-58.
[8]Jiang Q,Dong L,Ning Z Y,et al. Establishment of somatic cell clones in Thesium chinense Turcz and its in vitro rooting technique[J]. Agricultural Science and Technology,2008,9(5):53-55,68.
[9]Luo F L,Guo Q S. Influences of host species on transpiration,photosynthesis,chlorophyll and mineral contents of medicinal hemiparasite Thesium chinense Turcz[J]. Acta Physiologiae Plantarum,2010,32(6):1093-1102.
[10]羅夫來(lái),郭巧生. 百蕊草藥材內(nèi)在品質(zhì)研究[J]. 中國(guó)中藥雜志,2011,36(15):2042-2046.
[11]Su X,Gibor A. A method for RNA isolation from marine macro-algae[J]. Analytical Biochemistry,1988,174(2):650-657.
[12]Schneiderbauer A,Sandermann H,Ernst D. Isolation of functional RNA from plant tissues rich in phenolic compounds[J]. Analytical Biochemistry,1991,197(1):91-95.
[13]Fang G,Hammar S,Grumet R. A quick and inexpensive method for removing polysaccharides from plant genomic DNA[J]. BioTechniques,1992,13(1):52-54,56.
[14]董占強(qiáng),翟曉巧,范國(guó)強(qiáng),等. 泡桐葉片RNA提取方法的研究[J]. 河南農(nóng)業(yè)大學(xué)學(xué)報(bào),2009,43(1):40-43.
[15]李巖,王鐵梅,盧欣石. 根蘗型苜蓿根部RNA提取方法的比較[J]. 草業(yè)科學(xué),2010,27(5):67-71.
[16]張今今,王躍進(jìn),王西平,等. 葡萄總RNA提取方法的研究[J]. 果樹(shù)學(xué)報(bào),2003,20(3):178-181.
[17]張玉剛,成建紅,韓振海,等. 小金海棠總RNA提取方法比較及cDNA的LD-PCR擴(kuò)增[J]. 生物技術(shù)通報(bào),2005,4(4):50-53.
[18]尹慧,陳莉,李曉艷,等. 百合葉片總RNA提取方法比較及優(yōu)化[J]. 中國(guó)農(nóng)業(yè)大學(xué)學(xué)報(bào),2008,13(4):41-45.
[19]陳高,單雷,周麗俠,等. 花生總RNA提取方法比較研究[J]. 中國(guó)農(nóng)學(xué)通報(bào),2011,27(1):214-218.
[20]馮延芝,袁德義,張琳,等. 棗花蕾總RNA提取方法的比較[J]. 經(jīng)濟(jì)林研究,2012,30(2):88-90.
[21]王暑輝,徐倩,徐筱,等. 富含多糖多酚的側(cè)柏葉片總RNA提取方法[J]. 吉林農(nóng)業(yè)大學(xué)學(xué)報(bào),2012,34(1):76-80,89.
[22]Wang G F,Wang G,Zhang X W,et al. Isolation of high quality RNA from cereal seeds containing high levels of starch[J]. Phytochemical Analysis,2012,23(2):159-163.
[23]覃芳,王軍民,何海旺,等. 山藥組織總RNA提取方法的比較與分析[J]. 基因組學(xué)與應(yīng)用生物學(xué),2009,28(4):755-759.
[24]黃月琴,徐有明,薛建平. 半夏塊莖高質(zhì)量總RNA提取的一種有效方法[J]. 中國(guó)中藥雜志,2008,33(15):1810-1813.杜民,牛寶珍,劉艷紅,等. 2個(gè)鯉魚(yú)群體遺傳多樣性的RAPD分析[J]. 江蘇農(nóng)業(yè)科學(xué),2015,43(1):47-49.