高產褐藻膠裂解酶菌株的篩選及發酵條件優化
嚴 芬,連燕萍,楊 光,王培松,吳晨爍,陳寧辛
(福州大學生物科學與工程學院,福建福州350116)
高產褐藻膠裂解酶菌株的篩選及發酵條件優化
嚴 芬,連燕萍,楊 光,王培松,吳晨爍,陳寧辛
(福州大學生物科學與工程學院,福建福州350116)
采用透明圈初篩方法得到一株產褐藻膠裂解酶菌株B1,通過形態觀察和16S rDNA序列分析鑒定該菌株為假交替單胞菌屬(Pseudoalteromonas sp.)。通過單因素實驗對菌株B1產酶條件進行優化,最佳培養基組成為:褐藻酸鈉1%,氯化銨0.2%,NaCl 3%,KH2PO40.02%,MgSO40.01%,CaCl2·2H2O 0.1%,初始pH5.5。最佳的培養條件:裝液量75 mL,培養溫度30℃,搖床轉速180 r/min,培養22 h。在該條件下,褐藻膠裂解酶最高酶活力提高到71.94 U/mL,提高了72.11%。
褐藻膠裂解酶,假交替單胞菌,篩選,鑒定,培養條件
褐藻膠是來源于褐藻植物細胞壁的水溶性酸性多糖,具有良好的增稠乳化穩定功能,其降解產物褐藻膠低聚糖具有特殊的化學特性和生物活性,在保健食品、新藥開發等方面也具有巨大的應用價值,例如促進雙岐桿菌的生長、預防齲齒、作為藻酸雙脂和海立特等海洋藥物的原料基礎等[1-2]。目前褐藻膠的降解方法主要有酸降解、堿降解、酶法降解等[3],其中酶法降解由于具有催化效率高、專一性強等優勢代替化學降解已經成為一種必然。褐藻膠裂解酶作為一種降解褐藻膠的酶,利用β-消除反應切開褐藻膠分子中C4,C5之間的β-1,4-糖苷鍵,使其產生雙鍵并形成不飽和糖醛酸[4]。根據其對底物聚甘露糖醛酸(PM)和聚古洛糖酸酸(PG)的作用情況不同,褐藻膠裂解酶可分為三類:專一性裂解M片段的裂解酶、專一性裂解G片段的裂解酶和對兩種底物都能裂解的雙功能裂解酶[5]。因此對褐藻膠裂解酶的研究對于推動褐藻低聚糖的進一步開發有著深遠的意義和應用前景。褐藻膠裂解酶自身也具有重要的藥用價值,對綠膿桿菌的生物膜具有降解作用,是治療由綠膿桿菌感染引起的囊性纖維化病的輔療藥物[6-7]。
褐藻膠裂解酶具有廣泛的來源,如海藻類、海洋軟體動物、棘皮動物、海洋細菌、陸生真菌以及土壤細菌等[7],微生物來源主要有假交替單胞菌(Pseudoalteromonas)[8]、弧菌(Vibrio)[9]、黃桿菌(Flavobacterium)[10]、芽胞桿菌(Bacillus)[11]、鏈霉菌(Streptomyces)[12]。但大部分產褐藻膠裂解酶的微生物生長條件較特殊,酶活力低,穩定性差,不易分離[13],本文從鮑魚內臟篩選得到一株高產褐藻膠裂解酶的假交替單胞菌B1,該菌株具有較好的pH穩定性,鑒于發酵條件對微生物產酶能力的影響,對菌株B1產酶條件進行研究,以期提高其酶活力,為褐藻膠裂解酶工業化生產和應用奠定一定的基礎。
1 材料與方法
1.1 材料與儀器
海帶及鮑魚內臟 寧德海域;細菌基因組DNA提取試劑盒 北京百泰克生物技術有限公司;PCR引物 上海生工生物工程技術服務有限公司;褐藻酸鈉等藥品 西隴化工股份有限公司。
HWS24型電熱恒溫水浴鍋 上海一恒科技有限公司;752N型分光光度計 上海精密科學儀器有限公司;CF16RXⅡ型高速冷凍離心機 日本HITACHI公司;ECLIPSE E100型三目顯微鏡 日本尼康株式會社。
1.2 培養基
篩選培養基:褐藻酸鈉10.0 g,蛋白胨2.0 g,人工海水1.0 L。pH7.0,121℃蒸汽滅菌30 min。
種子培養液:蛋白胨5.0 g,酵母膏1.0 g,磷酸鐵0.01 g,人工海水 1.0 L。pH7.2,121℃蒸汽滅菌30 min。
發酵培養液:褐藻酸鈉5.0 g,蛋白胨2.0 g,KH2PO41.0 g,人工海水1.0 L。pH7.5,121℃蒸汽滅菌30 min。
1.3 實驗方法
1.3.1 產酶菌株的篩選 將腐爛海帶、鮑魚內臟取出均質后稀釋涂布到篩選培養基進行分離初篩,28℃、培養3~4 d,篩選出有降解圈或者凹陷明顯的菌落,進一步分離純化,斜面保藏。將斜面培養基活化的菌體接種到種子液中,置于28℃、180 r/min搖瓶培養12 h,以3%(v/v)的接種量接種于50 mL發酵液中,置于28℃、180 r/min條件下搖瓶培養,每12 h取樣,于10000 r/min,離心5 min,取上清液,測定褐藻膠裂解酶的酶活力。
1.3.2 酶活力測定 采用DNS法測定酶活力[14],取發酵液上清與0.75%(w/v)褐藻酸鈉底物反應,以滅活的酶液與褐藻酸鈉底物混合液作為對照組,根據產生還原糖的情況判斷酶活力大小。酶活力單位定義為在40℃條件下,每分鐘催化底物產生1 μg還原糖(以葡萄糖計)所需的酶量為一個酶活力單位(U/mL)。
1.3.3 菌株鑒定
1.3.3.1 菌株形態鑒定 根據《常見細菌系統鑒定手冊》[15]對分離篩選到的菌株B1進行菌落特征和形態特征的鑒定。
1.3.3.2 16S rDNA鑒定 采用試劑盒提取細菌總DNA,利用細菌16S rDNA擴增通用引物27f和1492r進行PCR擴增。PCR反應體系(20 μL):2×Taq PCR mastermix 10 μL、DNA 1 μL、上下游引物各1 μL及ddH2O 7 μL。PCR反應條件為:94℃預變性5 min,94℃變性30 s,57℃退火30 s,72℃延伸90 s,30個循環后72℃延伸10 min。PCR擴增產物經1.0%瓊脂糖凝膠電泳,割膠回收,并用DNA膠回收試劑盒回收DNA片段,獲得的片段委托到上海英濰捷基公司測序。測序結果提交到GenBank并在NCBI數據庫中進行序列同源性分析,使用ClustalX軟件與從GenBank數據庫中獲得的16S rDNA序列進行多序列比較,Mega5.0[16]軟件構建16S rDNA系統發育樹,經過自舉分析Bootstrap檢測置信度,重復1000次,確定該菌的分類地位。
1.3.4 產酶條件研究 通過單因素實驗優化培養基碳源、氮源、培養基初始pH、培養溫度、裝液量、搖床轉速、NaCl濃度以及無機鹽種類。每個實驗做三個平行,重復三次。
1.3.4.1 碳源及其添加量的研究 分別以0.5%(w/v)的蔗糖、淀粉、甘油、褐藻酸鈉、甘露糖作為碳源,并加入0.2%(w/v)蛋白胨,0.1%(w/v)KH2PO4配制發酵培養基,pH7.5,以3%(v/v)的接種量接種于50 mL發酵液中,置于28℃、180 r/min條件下搖瓶培養,研究不同碳源對菌株產酶的影響。在確定最佳碳源后,改變其濃度,在相同條件下研究碳源濃度對產酶的影響。
1.3.4.2 氮源及其添加量的研究 在最佳碳源的基礎上,分別添加0.5%(w/v)酵母膏、蛋白胨、硫酸銨、氯化銨與牛肉膏作為氮源,并加入0.1%(w/v)KH2PO4配制發酵培養基,其他條件與1.3.4.1相同,研究不同氮源對菌株產酶的影響。在確定最佳氮源后,改變其濃度,在相同條件下研究氮源濃度對產酶的影響。
1.3.4.3 NaCl濃度的研究 確定最佳碳源及氮源基礎上,添加1%、2%、3%、4%、5%(w/v)的NaCl,并加入0.1%(w/v)KH2PO4配制培養基,其他條件與1.3.4.1相同,研究NaCl濃度對產酶的影響。
1.3.4.4 無機鹽種類的研究 在最佳碳源、氮源及NaCl基礎上,添加KH2PO4、MgSO4、FeSO4·7H2O、CaCl2·2H2O,其他條件與1.3.4.1相同,考察無機鹽對菌株B1產酶的影響。
1.3.4.5 培養基初始pH的研究 培養基成分及其他培養條件不變,改變培養基初始pH為5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5,研究培養基初始pH對菌株B1產酶的影響。
1.3.4.6 裝液量的研究 培養基成分及其他培養條件不變,在250 mL三角瓶中分別加入25、50、75、100、125 mL的發酵培養基,研究裝液量對菌株B1產酶的影響。
1.3.4.7 搖床轉速的研究 培養基成分及其他培養條件不變,只改變轉速為120、140、160、180、200 r/min對菌株B1進行發酵培養,研究轉速對菌株B1產酶的影響。
1.3.4.8 發酵溫度的研究 培養基成分及其他培養條件不變,分別在25、28、30、33、35℃條件下發酵培養菌株B1,確定其最適發酵溫度。
1.3.5 數據處理 采用SPSS.20統計軟件對實驗數據進行統計分析,并檢驗各因素的差異顯著性。
2 結果與討論
2.1 產酶菌株的篩選
經過篩選培養基初篩獲得9株在初篩培養基上出現凹陷或透明圈現象的菌株,分別命名為B1~B9。經過發酵培養后測定其酶活力如圖1所示,結果表明菌株B1相對其他菌株具有較高的酶活力,培養28 h后酶活力達到41.8 U/mL,最終以B1為實驗菌株做后續實驗。
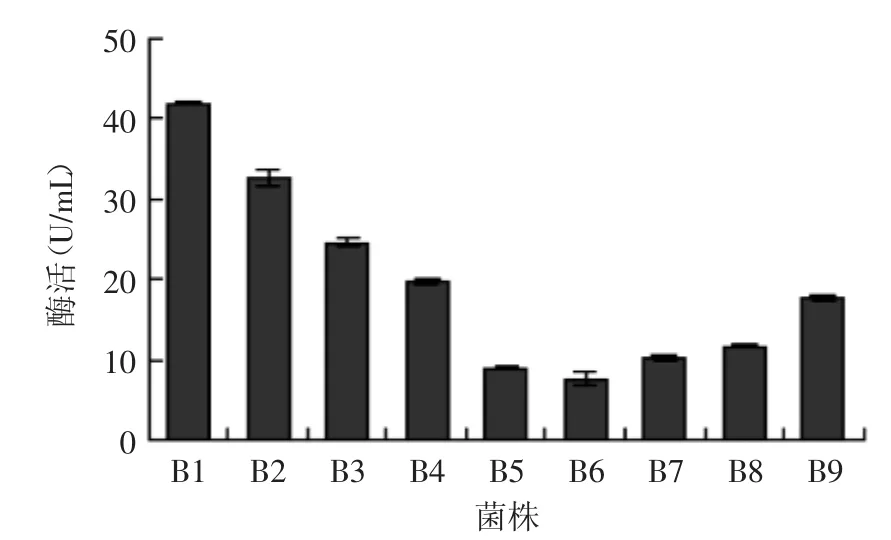
圖1 不同菌株的酶活力Fig.1 Alginate lyase activities of different strains
2.2 菌株B1的鑒定
2.2.1 形態鑒定 菌株B1菌落形態以及細胞形態特征如圖2所示。由圖2(a)可知,菌株B1單菌落較為濕潤,呈圓形,中間凸起,表面光滑,乳白色,不透明,邊緣光滑,易挑取;由圖2(b)可知,菌體細胞呈短棒桿狀,未發現芽孢存在。

圖2 菌株B1的菌落及細胞形態觀察(1000×)Fig.2 Colony and cellular morphology of strain B1(1000×)
2.2.2 16S rDNA序列分析 利用16S rDNA通用引物對菌株B1菌株擴增,得到1499 bp的目的片段。將獲得序列提交至GeneBank(登錄號:KM277582)并在NCBI網站上利用BLAST程序進行序列同源性比對,結果顯示菌株B1與假交替單胞菌(Pseudoalteromonas sp.QY202等)同源性高達99%。構建系統進化樹如圖3所示,菌株B1與假交替單胞菌屬在親緣關系上最接近,結合菌株形態學特征,鑒定菌株B1為假交替單胞菌(Pseudoalteromonas sp.)。

圖3 基于16S rDNA構建菌株B1的系統進化樹Fig.3 Phylogenetic tree of strain B1 based on 16S rDNA
2.3 培養基優化
2.3.1 碳源種類及其添加量對菌株產酶的影響 由圖4可知,以褐藻酸鈉為碳源時,菌株的產酶效果最好,而以甘露聚糖、蔗糖、淀粉為碳源時,菌株產酶量極低,故確定褐藻酸鈉為最佳碳源。改變發酵培養基中褐藻酸鈉的濃度對菌株進行發酵,結果如圖5所示。褐藻酸鈉濃度在0.2%~0.6%時,菌株B1產酶能力緩慢增長;當大于0.6%后呈快速增長趨勢,并在濃度為1.0%時達到最大,而后呈下降趨勢。這主要是由于高濃度的褐藻酸鈉增加了培養基的粘度影響溶氧,不利于菌株產酶。因此選擇濃度1.0%的褐藻酸鈉作為菌株B1的最佳碳源濃度。

圖4 不同碳源對菌株B1產酶的影響Fig.4 Effect of different carbon sources on enzyme production by strains B1
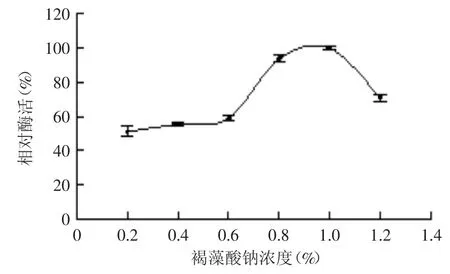
圖5 褐藻酸鈉濃度對菌株B1產酶的影響Fig.5 Effect of the concemtration of alginate on enzyme production by strain B1
2.3.2 氮源種類及其添加量對菌株產酶的影響 由圖6可知,菌株B1可以利用多種氮源進行自身的生長及產酶,但利用程度不同。其中以氯化銨為氮源時,菌株的產酶效果最佳。文獻報道,大西洋假交替單胞菌(Pseudoalteromonas atlantica)AR06產酶的最適氮源為硝酸氨[17],而中華黃海桿菌(Gilvimarinus chinensis)QM42產酶的最適氮源為蛋白胨[18],這說明不同菌屬產酶所利用的最佳氮源種類差別較大。進一步考察不同濃度的氯化銨對菌株產酶的影響,結果如圖7所示。氯化銨濃度為0.2%時,菌株B1產酶效果最佳,因此確定氯化銨的最適濃度為0.2%。
2.3.3 NaCl濃度對菌株產酶的影響 海洋來源的褐藻膠裂解酶產生菌株,需要一定的鹽度才能生長代謝和產酶。NaCl濃度對菌株產酶能力的影響結果如圖8所示。NaCl濃度小于3%時,菌株產酶能力隨著濃度增加而增加;當NaCl濃度為3%時,菌株產酶能力最大;當大于3%時,菌株產酶逐漸趨于平穩,故選取濃度為3%的NaCl作為最佳的鹽濃度。HU等報道的Vibrio sp.510-64產酶的最適鹽度也是3%[19]。
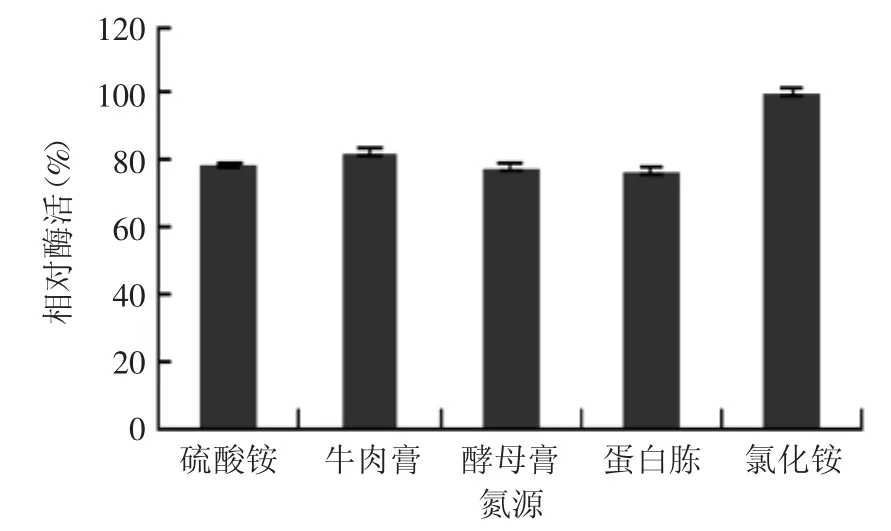
圖6 不同氮源對菌株B1產酶的影響Fig.6 Effect of different nitrogen sources on enzyme production by strain B1
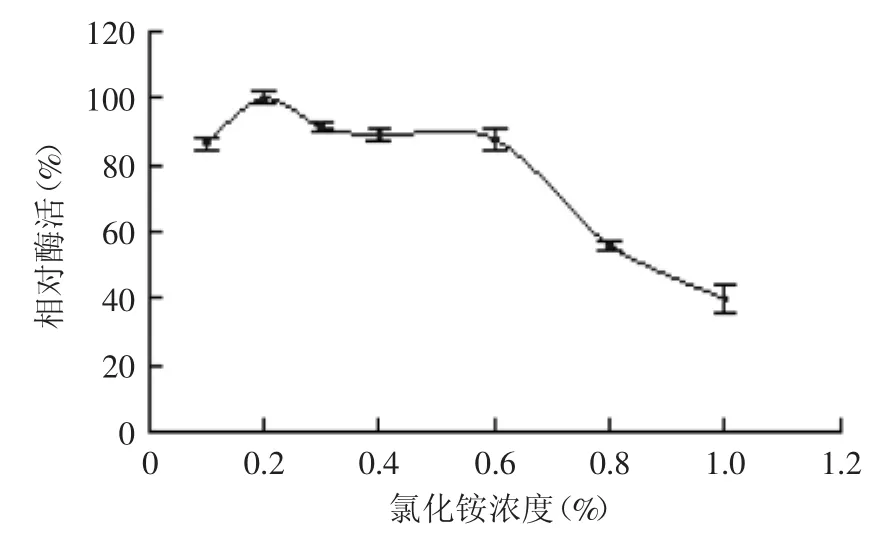
圖7 氯化銨濃度對菌株B1產酶的影響Fig.7 Effect of ammonium concentration on enzyme production by strain B1
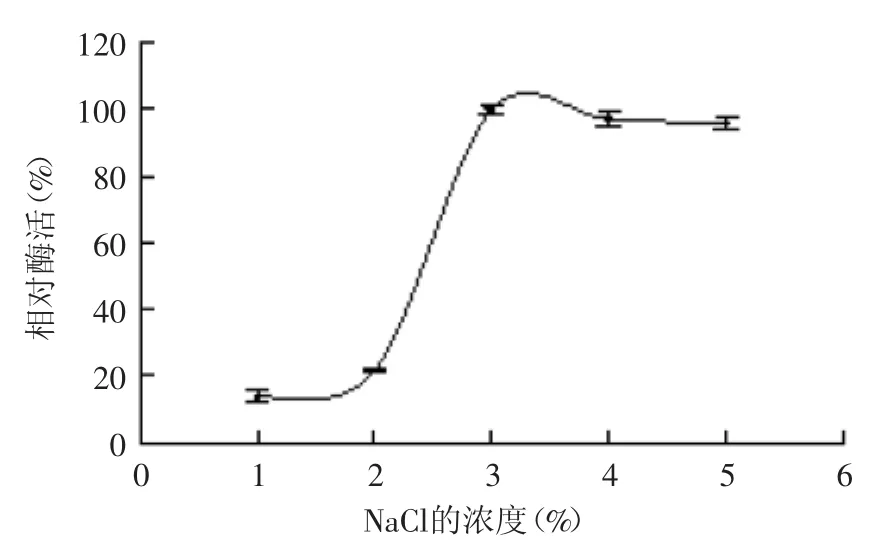
圖8 NaCl濃度對菌株B1產酶的影響Fig.8 Effect of NaCl concentration on enzyme production by strain B1
2.3.4 無機鹽對菌株產酶的影響 無機鹽對菌株B1產酶的影響結果見表1。單一無機鹽KH2PO4對菌株產酶的促進作用最為明顯,MgSO4和CaCl2·2H2O(0.1%)對菌株產酶也起到了促進作用。進一步對有促進作用的無機鹽進行組合,結果顯示添加KH2PO4(0.02%)+MgSO4(0.01%)+CaCl2·2H2O(0.1%)的無機鹽組合時,菌株產酶能力最大。Ca2+對Pseudoalteromonas LJ1菌株產酶起著一定的促進作用[9],而對Acinetobacter X8產酶則起著抑制作用[8],表明無機鹽對不同菌屬的產酶能力影響不同。
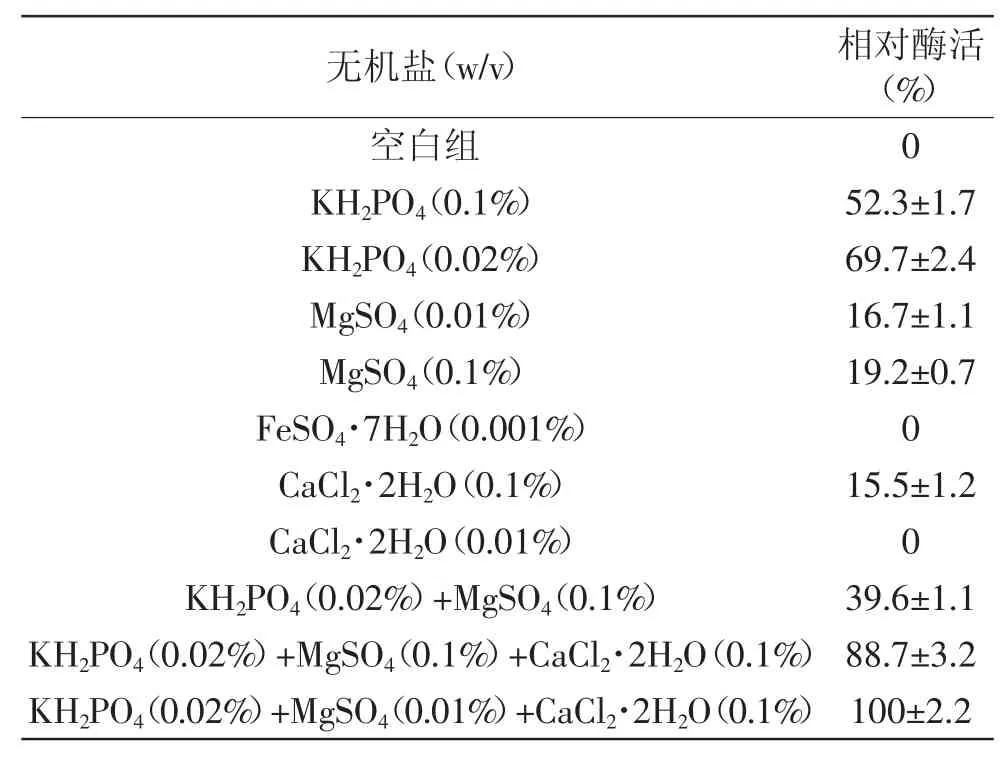
表1 無機鹽對菌株B1產褐藻膠裂解酶的影響Table 1 Effect of inorganic salts on alginate lyase activity by strain B1
2.4 發酵條件的優化
2.4.1 培養基初始pH對菌株產酶的影響 培養基的初始pH會影響菌株細胞膜的通透性從而影響其對營養物質的吸收,因此初始pH對菌株的生長及產酶有一定的影響。本文研究培養基初始pH對菌株B1產酶的影響,結果如圖9所示。在pH5~5.5范圍內,褐藻膠裂解酶酶活力隨著pH的上升而增大;當pH達到5.5時,酶活力達到最大;在pH5.5~7.5范圍內,酶活力呈緩慢下降趨勢;當pH超過7.5后,酶活力迅速下降。由此表明,微酸環境有利菌株B1產酶,這與Vibrio sp. QY103[20]產酶的最適初始pH相同,但大多數菌株產酶最適初始pH都在中性偏堿性環境即pH6~8[13,21-22]之間。

圖9 培養基初始pH對菌株B1產酶的影響Fig.9 Effect of initial pH of the medium on enzyme production by strain B1
2.4.2 裝液量對菌株產酶的影響 裝液量對菌株B1產酶的影響結果如圖10所示。裝液量從25~75 mL時,褐藻膠裂解酶酶活力隨之緩慢上升;裝液量為75 mL時,酶活力最高;當裝液量繼續增加后,酶活力快速下降。這主要是由于過低的裝液量在搖瓶過程中水分蒸發過快不利于菌株產酶,而裝液量過大易導致溶氧降低也不利于菌株的生長及產酶,因此裝液量選取75 mL為最適裝液量。

圖10 裝液量對菌株B1產酶的影響Fig.10 Effect of medium volume on enzyme production by strain B1
2.4.3 搖床轉速對菌株產酶的影響 轉速對菌株B1產酶影響結果如圖11所示。當轉速在120~180 r/min之間,B1菌株產酶能力隨著轉速增大而上升,并在180 r/min時達到最大;當轉速超過180 r/min后,菌株產酶能力迅速下降。這主要是由于轉速過低會影響菌株的呼吸從而造成代謝異常,而轉速過高則會加大搖瓶內的剪切力,造成細胞損傷而使菌體提前自溶,因此選取180 r/min為最適轉速。
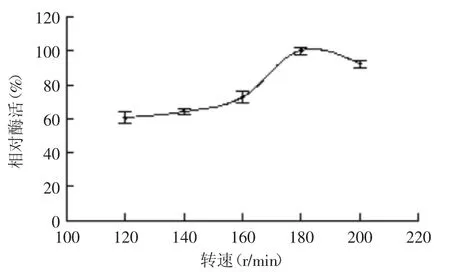
圖11 轉速對菌株B1產酶的影響Fig.11 Effect of rotating rate on enzyme production by strain B1
2.4.4 發酵溫度對菌株產酶的影響 菌株的生長代謝與溫度密切相關,實驗結果(圖12)表明,當溫度在25~30℃時,酶活力呈迅速增長趨勢;當溫度為30℃時,酶活力到達最高值;當溫度超過30℃時,酶活力迅速下降。因此選取30℃為最適發酵溫度,這與已報道的海洋細菌的生長溫度范圍(25~30℃)相符合。

圖12 溫度對菌株B1產酶的影響Fig.12 Effect of temperature on enzyme production by strain B1
2.5 優化前后產酶曲線
對菌株B1發酵培養基及發酵條件優化前后的產酶曲線進行比較,結果如圖13所示。優化后,褐藻膠裂解酶的合成周期大大提前,在發酵22 h時,酶活力達到最大值(71.94 U/mL),24 h后呈緩慢下降趨勢。與優化前相比,產酶高峰的時間由28 h縮短到22 h,最高酶活力由41.8 U/mL上升到71.94 U/mL,提高了72.11%。
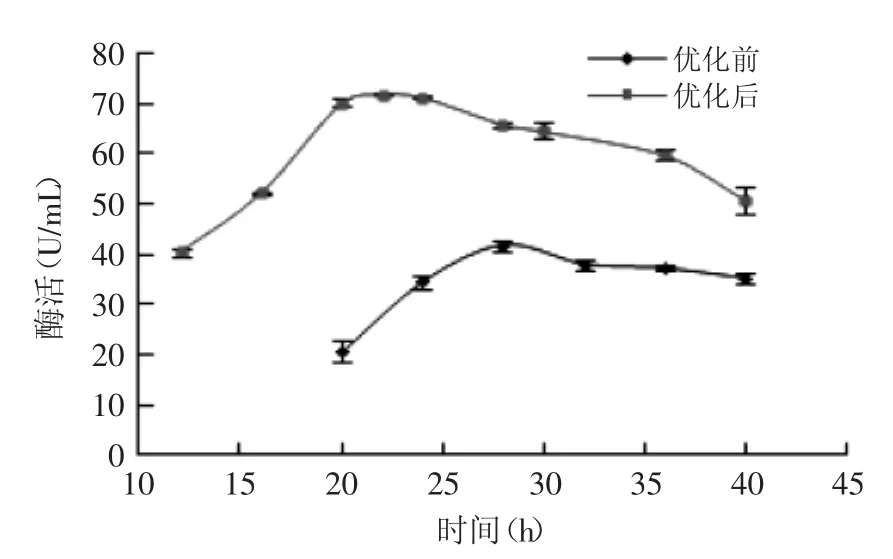
圖13 菌株B1的產酶曲線Fig.13 Time course of enzyme formation of strain B1
3 結論
以褐藻酸鈉為唯一碳源的選擇培養基,從海帶、鮑魚內臟中篩選到9株產褐藻膠裂解酶菌株,發酵復篩得到產酶活力最高的菌株B1。通過形態學觀察和16S rDNA序列分析鑒定菌株B1為假交替單胞菌(Pseudoalteromonas)。菌株B1最佳的發酵培養基:1%褐藻酸鈉,0.2%氯化銨,3%NaCl,0.02%KH2PO4,0.01%MgSO4,0.1%CaCl2·2H2O,初始pH5.5。最佳的發酵條件:裝液量75 mL,培養溫度30℃,轉速180 r/min。在上述優化條件下發酵,褐藻膠裂解酶活力可達71.94 U/mL,提高了72.11%,發酵周期由28 h縮短至22 h。本文對產褐藻膠裂解酶菌株進行篩選鑒定,并對其發酵條件進行優化,為該酶的工業化生產及應用打下基礎。
[1]李麗妍,管華詩,江曉路,等.海藻工具酶——褐藻膠裂解酶研究進展[J].生物工程學報,2011,27(6):838-845.
[2]劉翼翔,吳永沛.褐藻膠裂解酶在制備海洋寡糖中的應用[J].食品工業科技,2007,28(6):220-222.
[3]劉玉佩,汪立平,趙勇,等.解淀粉芽孢桿菌產褐藻膠裂解酶的發酵條件優化[J].湖南農業科學,2010(3):17-20.
[4]傅曉妍,李京寶,韓峰,等.褐藻膠裂解酶產生菌Vibro sp. QY102的發酵條件優化[J].中國海洋大學學報:自然科學版,2007,37(3):432-436.
[5]Gacesa P,Wusteman F S.Plate assay for simultaneous detection of alginate lyases and determination of substrate specificity[J]. Applied and Environmental Microbiology,1990,56(7):2265-2267.
[6]Huang L,Zhou J,Li X,et al.Characterization of a newalginate lyase from newly isolated Flavobacterium sp.S20[J]. Journal of Industrial Microbiology& Biotechnology,2013,40(1):113-122.
[7]Wong T Y,Preston L A,Schiller N L.Alginate lyase:review of major sources and enzyme characteristics,structure-function analysis,biological roles,and applications[J].Annual Reviews in Microbiology,2000,54(1):289-340.
[8]侯保兵,劉書來,張建友,等.褐藻膠裂解酶產生菌的發酵優化研究[J].水產科學,2009(11):667-670.
[9]馬悅欣,紀濤,李慧瓊,等.假交替單胞菌LJ1菌株產褐藻膠裂解酶的培養條件優化及酶學性質[J].微生物學報,2009,49(8):1086-1094.
[10]Wang Y,Guo E W,Yu W G,et al.Purification and characterization of a new alginate lyase from a marine bacterium Vibrio sp[J].Biotechnology Letters,2013,35(5):703-708.
[11]An Q D,Zhang G L,Wu H T,et al.Alginate‐deriving oligosaccharide production by alginase from newly isolated Flavobacterium sp.LXA and its potentialapplication in protection against pathogens[J].Journal of Applied Microbiology,2009,106(1):161-170.
[12]李悅明,韓建友,徐建春,等.利用芽孢桿菌發酵生產褐藻膠裂解酶的研究[J].中國釀造,2010,29(4):79-81.
[13]Jun-fan C,Ying N I E,Bo S H I,et al.紫紅鏈霉菌Streptomyces violaceoruber IFO 15732產褐藻膠裂解酶的培養條件優化[J].中國食物與營養,2013,19(4):48-51.
[14]張書利,管斌,邱向鋒,等.褐藻膠裂解酶產生菌的篩選,鑒定及其產酶條件研究[J].現代食品科技,2006,22(3):24-27.
[15]東秀珠,蔡妙英.常見細菌系統鑒定手冊[M].北京:科學出版社,2001:155-161.
[16]Tamura K,Peterson D,Peterson N,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionarydistance,and maximum parsimonymethods[J]. Molecular Biology and Evolution,2011,28(10):2731-2739.
[17]Matsushima R,Watanabe R,Tsuda M,et al.Analysis of Extracellular Alginate Lyase(alyA)Expression and its Regulatory Region in a Marine Bacterial Strain,Pseudoalteromonas atlantica AR06,Using a gfp Gene Reporter System[J].Marine Biotechnology,2013,15(3):349-356.
[18]王霽寧,嚴孝強,杜宗軍.一株高效褐藻膠降解菌的篩選及其發酵條件的優化[J].中國釀造,2012,31(5):7-10.
[19]Hu X,Jiang X,Hwang H.Purification and characterization of an alginate lyase from marine bacterium Vibrio sp.mutant strain 510-64[J].Current microbiology,2006,53(2):135-140.
[20]韓峰.海洋弧菌QY103褐藻膠裂解酶的研究[D].青島:中國海洋大學,2008.
[21]付曉婷.海洋細菌(AgarivoransalbusYKW-34)產生的褐藻膠裂解酶及瓊膠酶的研究[D].青島:中國海洋大學,2008.
[22]Singh R P,Gupta V,Kumari P,et al.Purification and partial characterization of an extracellular alginate lyase from Aspergillus oryzae isolated from brown seaweed[J].Journal of Applied Phycology,2011,23(4):755-762.
Screening of alginate lyase-producing strains and optimization of fermentation conditions
YAN Fen,LIAN Yan-ping,YANG Guang,WANG Pei-song,WU Chen-shuo,CHEN Ning-xin
(College of Biological Science and Engineering,Fuzhou University,Fuzhou 350116,China)
A bacterial alginate lyase-producing strain B1 was screened with transparent circle method,It was identified as Pseudoalteromonas sp.according to its morphological observation and 16S rDNA sequence analysis to identified strain B1.And by single-factor method to optimize its enzyme production conditions,the optimal medium component were,sodium alginate 1%,NH4Cl 0.2%,NaCl 3%,KH2PO40.02%,MgSO40.01%,CaCl2·2H2O 0.1%,initial pH5.5,the optimal culture conditions were as follows:75 mL medium in 250 mL Erlenmeyer flask,Cultured at 30℃,shaking speed of 180 r/min,for 22 h.Under the optimal culture conditions,the highest enzyme activity of alginate lyase was up to 71.94 U/mL,improving 72.11%.
alginate lyase;Pseudoalteromonas;screen;identify;culture conditions
TS201.3
A
1002-0306(2015)22-0287-06
10.13386/j.issn1002-0306.2015.22.051
2015-03-04
嚴芬(1980-),女,博士,講師,研究方向:食品微生物,E-mail:yanfen@fzu.edu.cn。
海洋公益性行業科研專項資助項目(201305015)。

