南方根結線蟲被穿刺巴斯德芽菌侵染后壽命和生殖相關基因的表達變化
魯琰 鄒瀟瀟 黃惠琴 劉敏 鮑時翔


摘 ?要 ?為了探討南方根結線蟲在植物體外被穿刺巴斯德芽菌感染后存活率的變化及感染初期線蟲壽命和生殖相關基因的表達情況。首先利用單卵塊孵化法對從野外采集的根結線蟲進行純化和分子鑒定。以穿刺巴斯德芽菌孢子體外吸附的南方根結線蟲為材料,在顯微鏡下觀察供試線蟲的存活情況,每24 h計數一次死亡線蟲的條數,總共觀察12 d。在被穿刺巴斯德芽菌吸附的第3天收集根結線蟲,提取線蟲總RNA,采用實時熒光定量PCR檢測線蟲壽命相關基因cyp-33和生殖相關基因lin-45/mek-2的表達情況。結果表明:通過分子鑒定確認純化的根結線蟲為南方根結線蟲;感染了穿刺巴斯德芽菌的南方根結線蟲死亡率顯著升高;同時在穿刺巴斯德芽菌吸附南方根結線蟲的初期,線蟲壽命相關基因cyp-33和生殖相關基因lin-45/mek-2的表達水平與對照組相比均下調(p<0.05)。這說明穿刺巴斯德芽菌在吸附南方根結線蟲的初期能夠促使線蟲的存活率降低,并抑制其生殖能力,這可能與基因cyp-33、lin-45和mek-2的調控有關。
關鍵詞 ?南方根結線蟲;穿刺巴斯德芽菌;熒光定量PCR;存活率
中圖分類號 ?R383.1 ? ? ? ? ?文獻標識碼 ?A
Expression Changes of Life-related and Reproduction-related
Genes of Meloidogyne Incognita Infected by Pasteuria Penetrans
LU Yan1,2,3, ZOU Xiaoxiao2, HUANG Huiqin2, LIU Min2, BAO Shixiang2*
1 College of Agriculture, Hainan University, Haikou, Hainan 570228, China
2 Institute of Tropical Bioscience and Biotechnology, CATAS, Haikou, Hainan 571101, China
3 Hainan Medical College, Haikou, Hainan 571199, China
Abstract In order to investigate the influence of Pasteuria penetrans on the survival rate of Meloidogyne incognita and the expression of life-related gene and reproduction-related gene at the beginning of adsorption,the authors purified M. incognita collected from wild and identified it with molecular biology methods firstly. Then M. incognita was adsorpted by P penetrans in vitro. Within twelve days the researchers observed M. incognita with microscope and counted the number of dead M. incognita every 24 hours. The total RNA of M. incognita was extracted at the third day after M. incognita was adsorpted. Real time quantitative PCR was used to detect the expression of cyp-33、lin-45 and mek-2 gene. The authors confirmed that the purified nematode was M. incognita and the death rate of M. incognita significantly increased when infected by P. penetrans. At the same time the expression of life-related gene cyp-33 and reproduction-related genes lin-45 and mek-2 reduced at the beginning of adsorption comparing with the control group(p<0.05). P. penetrans could reduce the lifespan and reproduction of M. incognita. The mechanism may be related to the regulation of cyp-33、lin-45 and mek-2 gene.
Key words ?Meloidogyne incognita; Pasteuria penetrans; Real time quantitative PCR; Survival rate
doi ?10.3969/j.issn.1000-2561.2015.10.020
根結線蟲(Meloidogyne spp.)是一類分布廣泛的植物寄生線蟲,對農作物的危害非常嚴重。每年由于根結線蟲病導致的經濟損失在全球范圍內高達數百億美元[1]。近年來,根結線蟲病的危害在國內也愈演愈烈,其中分布最廣、危害最大的是南方根結線蟲[2-3]。穿刺巴斯德芽菌(Pasteuria penetrans)是根結線蟲的專性寄生菌,也是最具潛力的根結線蟲生防因子[4-5]。穿刺巴斯德芽菌的孢子能特異性吸附在根結線蟲體表,然后進入線蟲體內萌發,奪取線蟲體內營養并在宿主體內生長發育[6]。而根結線蟲由于穿刺巴斯德芽菌的侵入,生殖腺發育不完全,生殖系統遭到嚴重破壞,不能產卵或只能形成少量的卵,最終導致根結線蟲嚴重不育,線蟲的蟲口密度由此降低[7]。
目前對于穿刺巴斯德芽菌與根結線蟲互作的詳細機制尚不清楚,南方根結線蟲被穿刺巴斯德芽菌感染后線蟲基因表達水平的研究也未見報道。鑒于此,本研究在實驗室內用穿刺巴斯德芽菌吸附南方根結線蟲,探討線蟲被穿刺巴斯德芽菌吸附后存活率的變化,并在吸附初期收集線蟲總RNA,用熒光定量PCR技術檢測線蟲壽命相關基因cyp-33和生殖相關基因lin-45/mek-2的表達情況,為下一步研究穿刺巴斯德芽菌吸附南方根結線蟲初期的轉錄組分析奠定基礎,也為將來探索根結線蟲的生物防治提供新思路。
1 ?材料與方法
1.1 ?材料
Taq DNA polymerase、Marker Trans 2K Plus等購自北京全式金生物技術有限公司;DNA Marker DM2000購自北京康為世紀生物科技有限公司;M-MuLV第一鏈cDNA合成試劑盒、2×SG Fast qPCR Master Mix試劑盒、DEPC購自上海生工生物技術公司;RNeasy Plus Mini Kit 購自Qiagen公司。
1.2 ?方法
1.2.1 ?穿刺巴斯德芽菌的收集 ? 采集已人工接種穿刺巴斯德芽菌和根結線蟲的番茄病根,用清水洗去附著的土壤后挑取病根根結中的雌蟲,置于1.5 mL離心管中,用1%的次氯酸鈉消毒5 min后,用無菌水漂洗3次,再用無菌鑷子壓破雌蟲,加入1 mL無菌水制成懸浮液,置于光學顯微鏡(400×)下觀察有無穿刺巴斯德芽菌的特征性孢子[7-9]。收集孢子樣品,用血球計數板計數孢子濃度,保存于4 ℃冰箱中待用[9]。
1.2.2 ?南方根結線蟲的采集和純化培養 ? 從海南定安的胡椒園里采集帶有根結的胡椒根,在解剖鏡下用解剖針挑取單個卵塊,用1%的次氯酸鈉消毒后將卵塊置于清水中孵化,2 d后將孵化出的2齡幼蟲接種于預先培植于消毒土的番茄根部。接種50 d后拔出番茄苗,觀察番茄根部是否有根結、根結數目及是否有卵塊。當根結上出現卵塊時,挑取成熟的根結線蟲卵塊,消毒后再次孵化轉接到番茄根部,以此擴繁根結線蟲[10]。
1.2.3 ?根結線蟲分子鑒定 ? 收集由卵塊孵化出的2齡幼蟲,提取線蟲基因組DNA[11-12]。根結線蟲分子鑒定方法參照Meng等[13]的方法,選取MI-F/R、MJ-F/R、MT-R/MI-F 3對引物做PCR。引物由上海生工生物技術有限公司合成,序列見表1。PCR反應采用50 μL體系:10×EasyTaq Buffer 5 μL,上下游引物(10 μmol/L)各1 μL,2.5 mmol/L dNTPs 4 μL,EasyTaq DNA polymerase 1 μL,DNA模板5 μL,ddH2O 33 μL。PCR反應程序為:94 ℃ 4 min;94 ℃ 30 s,62 ℃ 30 s,72 ℃ 30 s,共35個循環;72 ℃ 10 min。PCR擴增結束后,取PCR產物2 μL 用1.5%的瓊脂糖凝膠電泳檢測擴增條帶。
1.2.4 ?穿刺巴斯德芽菌體外吸附根結線蟲 ? 挑取40個根結線蟲卵塊放入1.5 mL離心管中,加入500 μL的無菌水吹打沖洗3次。加入1%的次氯酸鈉消毒5 min后,再用無菌水吹打沖洗3次。卵塊分裝至96孔板中,放置于25 ℃恒溫培養箱孵化。卵塊孵化48 h后,取孵化出的2齡幼蟲置于96孔板中,每孔60條左右,實驗組每孔加10 μL(5.48×104個)穿刺孢子液,放置于25 ℃恒溫培養箱。12 d內每隔24 h在顯微鏡下觀察根結線蟲并計數死亡和存活的線蟲條數,實驗重復3次[15-16]。根據統計結果計算各組線蟲的死亡率。
線蟲死亡率=■×100%
1.2.5 ?南方根結線蟲總RNA的提取 ? 在穿刺巴斯德芽菌吸附南方根結線蟲的第3天收集2齡幼蟲,同時收集未被穿刺巴斯德芽菌吸附的南方根結線蟲作對照,14 000 r/min 4 ℃離心10 min。用線蟲M9緩沖液(每升含15.12 g Na2HPO4·12H2O,3 g KH2PO4,5 g NaCl,0.25 g MgSO4·7H2O,0.12 g MgSO4)洗線蟲1次,14 000 r/min 4 ℃離心10 min,棄去上清。將蟲體轉移到無RNA酶的離心管中。按照試劑盒說明書,用Qiagen的RNeasy Plus Mini Kit提取線蟲總RNA。總RNA樣品放置于-80 ℃冰箱保存備用。
1.2.6 ?線蟲相關基因的實時熒光定量PCR檢測 ? 將根結線蟲的總RNA用M-MuLV第一鏈cDNA合成試劑盒,反轉錄得到線蟲的cDNA。Real time PCR采用SYBR GreenⅠ染料法,使用2×SG Fast qPCR Master Mix試劑盒,在美國安捷倫Mx3005P實時熒光定量PCR儀上擴增目的基因。反應體系(20 μL):2×SG Fast qPCR Master Mix 10 μL,上下游引物(10 μmol/L)各0.5 μL,cDNA模板2 μL,DNF buffer 2 μL,PCR-grade water 5 μL。實時熒光定量PCR反應參數:95 ℃預變性5 min;95 ℃變性15 s,60 ℃退火50 s,共40個循環。每個樣品設3個重復。采用2△△CT法對PCR結果進行定量分析。
1.3 ?數據分析
實驗數據經Microsoft Excel 2003處理后,采用SPSS Statistics 17.0統計軟件進行差異顯著性分析,組間比較采用t檢驗進行分析。
2 ?結果與分析
2.1 ?根結線蟲鑒定結果
提取根結線蟲2齡幼蟲的基因組后,用3對引物(MI-F/R、MJ-F/R、MT-R/MI-F)對根結線蟲進行分子鑒定。結果發現,引物MI-F/R、MT-R/MI-F分別擴出1 000、780 bp的條帶,而引物MJ-F/R未擴增出條帶(圖1),據此可確定純化的根結線蟲為單一的南方根結線蟲[13]。
2.2 ?穿刺巴斯德芽菌對南方根結線蟲存活率的影響
實驗結果表明,在清水中南方根結線蟲的死亡率隨時間的延長呈遞增趨勢,在吸附的第3天實驗組的南方根結線蟲死亡率達31.8%,對照組根結線蟲的死亡率為14.6%;到第4天實驗組線蟲的死亡率是40%,對照組線蟲死亡率仍然是14.6%;到吸附的第12天實驗組線蟲的死亡率是93.9%,對照組線蟲死亡率為53.2%。雖然2組線蟲的死亡率隨時間的延長均呈遞增趨勢,但實驗組根結線蟲的死亡率一直高于對照組(圖2)。此外,在穿刺巴斯德芽菌吸附南方根結線蟲的過程中,南方根結線蟲體表吸附的穿刺孢子個數在吸附初期與吸附時間呈正相關(圖3)。
2.3 ?南方根結線蟲總RNA的提取
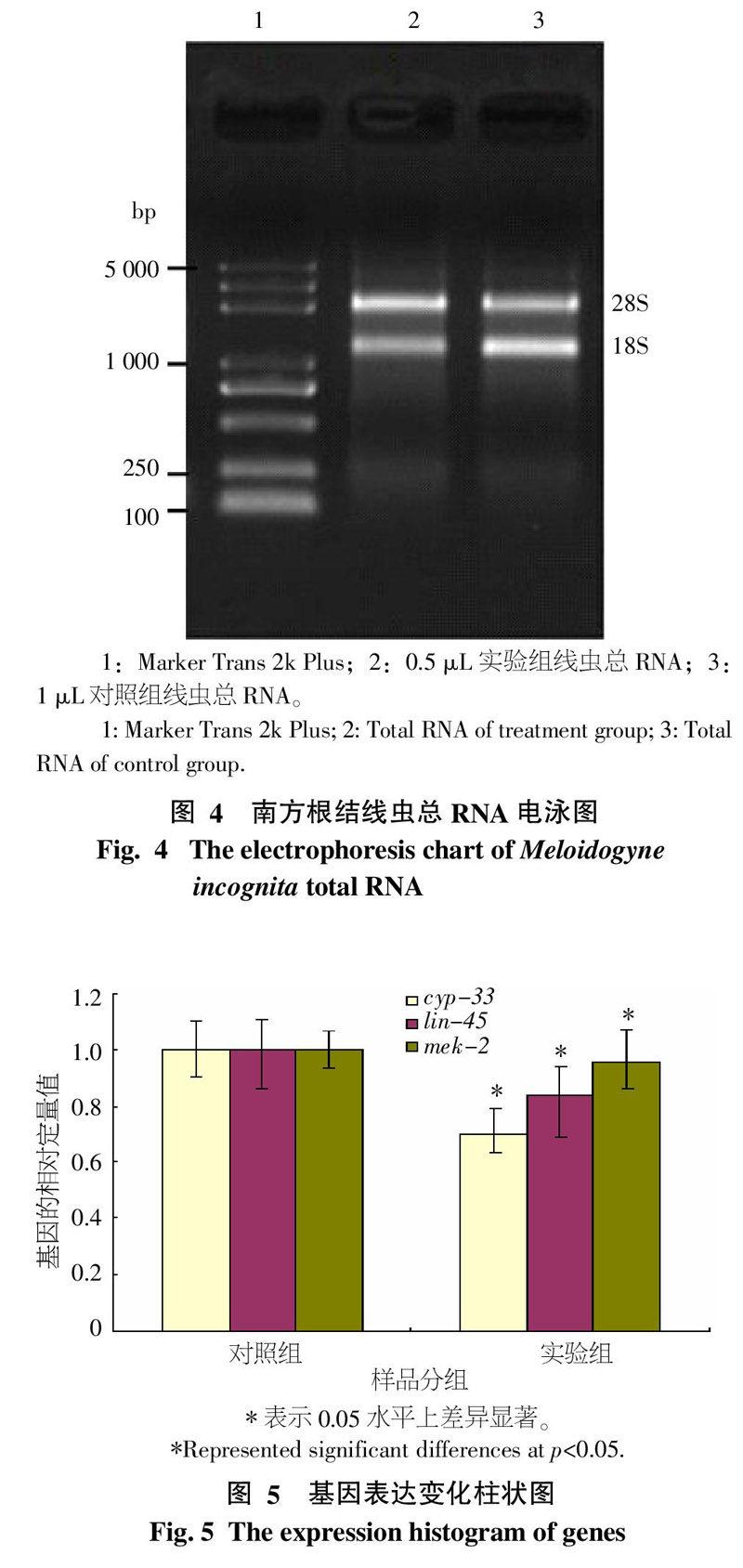
提取的南方根結線蟲總RNA用1%的瓊脂糖凝膠, 在1×TAE電泳緩沖液中120 V電泳30 min,在紫外燈下檢測RNA條帶并拍照(圖4)。再取1 μL總RNA 用Nanodrop2000分光光度計測定RNA的濃度和純度(表2)。從圖4中可看出,提取的RNA完整性良好,濃度和質量均達到了實驗要求。
2.4 ?熒光定量PCR檢測基因cyp-33、lin-45和mek-2的表達情況
熒光定量PCR的溶解曲線峰形窄而尖,無雜峰,擴增產物特異性良好。在熒光定量擴增曲線上,基因指數擴增期和平臺期均十分明顯,線性范圍廣,表現為理想的擴增曲線。熒光定量PCR結果的相對定量分析結果發現,感染了穿刺巴斯德芽菌后南方根結線蟲的壽命相關基因cyp-33和生殖相關基因lin-45/mek-2表達下調(圖5)。采用SPSS軟件進行差異顯著性分析,結果表明:P(cyp-33)=0.001、P(mek-2)=0.005均小于0.01,差異極顯著;P(lin-45)=0.038小于0.05,差異顯著。綜上所述,被穿刺巴斯德芽菌感染初期的南方根結線蟲與對照組相比,cyp-33、lin-45和mek-2基因的表達水平顯著下調。
3 ?討論與結論
穿刺巴斯德芽菌是目前公認的防治根結線蟲最有效的生物防治劑[17]。它不具有運動能力,當根結線蟲的2齡幼蟲在土壤中運動時,觸碰到穿刺巴斯德芽菌的孢子,穿刺孢子表面的一些特殊蛋白能特異粘附在根結線蟲2齡幼蟲的表面,在某種酶的作用下,孢子的芽管會突破芽孢底部的粘著層并穿透線蟲表皮,伸入線蟲體內[18],奪取線蟲體內營養,降低線蟲的蟲口密度。蟲體死亡、裂解之后,成熟的孢子又重新釋放到土壤中,開始新的侵染循環[17,19]。由于穿刺巴斯德芽菌防治根結線蟲高效無污染,因此,目前該方面研究備受關注[20-21]。
本研究在植物體外用穿刺巴斯德芽菌吸附南方根結線蟲,觀察線蟲存活率及吸附初期壽命和生殖相關基因表達水平的變化。結果發現,穿刺巴斯德芽菌吸附南方根結線蟲后能降低線蟲的存活率,壽命和生殖基因在吸附早期已經下調表達。線蟲壽命相關基因cyp-33的上調能夠延長線蟲壽命[22],而穿刺吸附南方線蟲后線蟲存活率降低,cyp-33基因表達下調。這說明穿刺巴斯德芽菌在感染南方根結線蟲后能夠降低線蟲的存活率,這可能與cyp-33的表達下調有關,但具體機制仍不明確。線蟲生殖相關基因lin-45/mek-2是Ras信號傳導通路中的2個重要成員,它能夠促進排泄管、陰門細胞的發育,在線蟲的生長發育中扮演著重要角色[14,23],而實驗結果顯示穿刺菌吸附南方根結線蟲后線蟲的lin-45/mek-2基因表達均下調。何元等[6]研究發現,穿刺巴斯德芽菌吸附根結線蟲后的第7天,根結線蟲的生殖腺長度只有對照線蟲的90%左右,且隨著吸附時間的延長,線蟲的生殖器官發育更遲緩。這提示了被穿刺巴斯德芽菌吸附后根結線蟲生殖系統發育受到抑制可能與Ras信號傳導途徑上的基因表達下調有關。但具體機制目前仍不明確,實驗結果仍需進一步驗證。
在本研究的基礎上,筆者們將運用轉錄組測序技術分析南方根結線蟲被穿刺巴斯德芽菌感染初期的轉錄組變化,從分子水平闡述二者的互作機制,為將來研究穿刺巴斯德芽菌與根結線蟲的互作和根結線蟲的防治提供新策略。
參考文獻
[1] Barker K R, Townshend J L, Bird G W, et al. Methods for evaluating pesticides for control of plant pathogens[M]. St Paul MN: APS Press, 1986: 283-296.
[2] 徐建華. 江蘇省大棚蔬菜寄生線蟲的種類和發生[J]. 南京農業大學學報, 1994, 17(1): 47-51.
[3] 劉鳴韜. 北方蔬菜根結線蟲病加重的原因及控制對策[J]. 河南農業科學, 2001, 21(1): 23-24.
[4] 卜祥霞, 何 ?強,簡 ?恒. 穿刺巴斯德芽菌活體大量繁殖體系的優化[J]. 中國生物防治學報, 2012, 28(3): 408-414.
[5] Bishop A H, Gowen S R, Pembroke B, et al. Morphological and molecular characteristics of a new species of Pasteuria parasitic on Meloidogyne ardenensis[J]. Journal of Invertebrate Pathology, 2007, 96(1): 28-33.
[6] 何 ?元,潘滄桑. 根結線蟲的發育受穿刺巴斯德氏柄菌抑制的觀察[J]. 寄生蟲與醫學昆蟲學報, 2000, 7(3): 145-153.
[7] 黃惠琴, 朱 ?軍, 商 ?桑. 海南省穿刺巴斯德芽菌資源調查及其系統發育分析[J]. 中國生物防治學報, 2013, 29(4): 607-612.
[8] 張曉黎, 商 ?桑, 朱 ?軍. 穿刺巴斯德芽菌PPh01菌株鑒定及其對根結線蟲的寄生性測定[J]. 熱帶作物學報, 2012, 33(4):695-698.
[9] 肖 ?珺, 鄒瀟瀟, 黃惠琴,等. 海南島胡椒地穿刺巴斯德芽菌鑒定與多樣性分析[J]. 廣東農業科學, 2014, 41(17): 134-139. [10] 何勝洋,葛起新. 浙江金華棉區根結線蟲種及小種的再鑒定及單卵塊接種法的應用[J]. 浙江農業大學學報, 1987, 13(2):44-51.
[11] Cenis J L. Identification of four major Mdoidogyne spp. by random amplified polymorphic DNA(RAPD-PCR)[J]. Phytopathology, 1993, 83(10): 76-80.
[12] Xu J H, Narabu T, Mizukubo T, et al. Amolecular marker correlated with selected virulence against the tomato resistance gene Mi in M. incognita, M. javanica and M. arenaria[J]. Phytopathoiogy, 2001, 91(5): 377-382.
[13] Meng Q P, Long H, Xu J H. PCR assays for rapid and sensitive identification of three major root-knot nematodes, M. incognita, M. javanica and M. arenaria[J]. Acta Phytopathologica Sinica, 2004, 34(3): 204-210.
[14] 徐國凱. 南方根結線蟲MiMEK2、 MiLIN45基因的分離及其表達分析[D]. 北京: 中國農業科學院, 2010.
[15] 王 ?波. 淡紫擬青霉與放線菌代謝物復配對南方根結線蟲的防治[J]. 南京農業大學學報, 2009, 32(1): 55-60.
[16] 王志偉, 翁忠賀, 肖日新,等. 海南省根結線蟲的危害及其對侵入巴斯德氏芽菌的親和性[J]. 熱帶作物學報, 2007, 28(4):102-107.
[17] Chen Z X, Dickson D W. Review of Pasteuria penetrans:biology、 ecology and potential[J]. Journal of Nematology, 1998, 7(30): 313-340.
[18] Mankau R. Biocontrol: fungi as nematode control agents[J]. J Nematol, 1980, 12(4): 244-252.
[19] Hatz B, Dickson D W. Effect of temperature on attachment,development, and interaction of Pasteuria penetrans on Meloidogyne arenaria[J]. Journal of Nematology, 1992, 24(4):512-521.
[20] 孔祥義, 陳綿才. 根結線蟲病防治研究進展[J]. 熱帶農業科學, 2006, 26(2): 83-88.
[21] 王全華, 葛晨輝,尹國香. 番茄根結線蟲病抗病育種研究進展[J]. 萊陽農學院學報, 2001, 18(3): 216-220.
[22] 譚翔倩. 線蟲壽命相關基因網絡的構建及營養素對網絡狀態的影響[D]. 哈爾濱: 哈爾濱工業大學, 2011.
[23] 張 ?玉, 茆振川, 謝丙炎. Ras蛋白信號途徑及其對線蟲生長發育的調控作用[J]. 生物技術通報, 2009, 25(8): 32-37.

