多西他賽節拍化療用于鉑類耐藥晚期復發卵巢癌的觀察
袁 理
(綿陽市中心醫院腫瘤科,四川 綿陽 621000)
多西他賽節拍化療用于鉑類耐藥晚期復發卵巢癌的觀察
袁 理
(綿陽市中心醫院腫瘤科,四川 綿陽 621000)
目的:觀察鉑類耐藥的晚期復發卵巢癌患者使用多西他賽節拍化療法的近期療效及毒副反應。方法:將我院腫瘤科2008—2013年收治的34例晚期(FIGO分期 Ⅱ~Ⅳ)復發并鉑類耐藥(鉑類化療后PFS<6個月)卵巢癌患者隨機分為2組。觀察組17例采用多西他賽節拍化療,對照組17例采用傳統3周模式的二線方案化療(多西他賽單藥方案)。比較2組有效率及毒副反應發生率。結果:觀察組、對照組有效率(RR)分別為64.71%和71.43%,2組總有效率無顯著性差異(P>0.05);Ⅲ~Ⅳ級毒性反應觀察組為11.76%,對照組為47.06%,觀察組毒性反應明顯輕于對照組(P<0.05)。結論:多西他賽節拍化療對鉑類耐藥的晚期復發卵巢癌患者具有良好療效,并有較好的耐受性。
卵巢癌;鉑類耐藥;多西他賽;節拍化療
卵巢癌在我國女性生殖系統惡性腫瘤中發病率約為15%,僅次于宮頸癌和子宮內膜癌的發生率,其中上皮源性惡性腫瘤占卵巢癌總數的50%~70%。雖然早期腫瘤手術和化療療效均較為理想,但因卵巢位置活動度大、腫瘤位于盆腔深部、腫瘤早期無癥狀等眾多因素導致多數卵巢癌患者初診時即屬中晚期,錯失根治性手術機會,而以鉑類和紫杉類為基礎的化療則是中晚期卵巢癌治療的主要方式[1]。雖然卵巢癌化療敏感性較高,但迄今為止的研究結果表明,大多數中晚期卵巢癌患者在行減瘤術或鉑類和紫杉類為基礎的化療后1~2年即出現復發轉移[1]。復發卵巢癌患者再行化療將有部分患者出現繼發性多藥耐藥(multiple drug resistance,MDR),從而影響化療效果,使患者生存期明顯縮短[2]。因此在尋找有效率高且耐受性良好的化療藥物基礎上,盡可能延長化療藥物耐藥時間是近年研究的熱點。本文對晚期復發卵巢癌患者使用多西他賽節拍化療法(metronomic chemotherapy)和3周傳統療法的近期療效及毒副反應進行了臨床觀察和對比,報告如下。
1 資料與方法
1.1 一般資料 我院腫瘤科2008年6月至2013年6月收治晚期(FIGO分期Ⅱ~Ⅳ)復發并鉑類耐藥(鉑類化療后PFS<6個月)卵巢癌患者34例,隨機分為觀察組和對照組。觀察組17例,年齡32~68歲,平均54.7歲。觀察組患者中:漿液性囊腺癌9例,黏液性囊腺癌6例,透明細胞癌2例;前期治療全部患者均完成鉑類為主的聯合化療2~8周期,其中6例先期行腫瘤細胞減滅術;復發腫瘤再分期,Ⅱ~Ⅲ期15例,Ⅳ期2例;KPS評分70~80分,平均77.65分。對照組17例,年齡35~71歲,平均55.3歲。觀察組患者中:漿液性囊腺癌13例,黏液性囊腺癌3例,透明細胞癌1例;前期治療全部患者均完成鉑類為主的聯合化療2~8周期,其中8例先期行腫瘤細胞減滅術;復發腫瘤再分期,Ⅱ~Ⅲ期16例,Ⅳ期1例;KPS評分70~80分,平均78.24分。34例病例均通過術后病理、腹水脫落細胞檢查、穿刺活檢等證實為卵巢上皮細胞癌,KPS評分≥70分,排除嚴重基礎疾患,預計能持續完成4~6周期化療。2組患者的年齡、病種分布、疾病分期等基線特征數據無顯著差異(P>0.05),具有可比性。
1.2 治療方法 觀察組采用多西他賽節拍化療,對照組采用傳統3周模式的二線方案化療(多西他賽單藥方案)。觀察組在第1天、第8天、第15天分別給予單藥多西他賽25 mg/ m2靜脈滴注1 h,每28天為1個周期。對照組常規給予多西他賽75 mg/m2靜脈滴注1 h,每21天重復給藥為1個周期。化療預處理:給予多西他賽前1天開始口服地塞米松片,7.5 mg/次,每天2次,連續口服3 d。化療前30 min給予止吐藥物。每個治療周期開始前檢查患者血常規、肝腎功能,以排除化療禁忌;每2個治療周期后行腹、盆腔CT或MRI以評價療效,決定患者是否繼續該方案化療。最終觀察組16例患者完成2~6周期化療,對照組13例患者完成2~6周期化療。
1.3 評價指標 按WHO實體瘤療效評價標準對2組患者進行療效評價,包括完全緩解(complete remission,CR)、部分緩解(partial remission,PR)、疾病穩定(stability disease,SD)、疾病進展(progression disease,PD),總有效率(response rate,RR)為CR率+PR率。采用美國國立癌癥研究院通用毒性標準(National Cancer Institute-Common Toxicity Criteria, NCI-CTC)將化療藥物毒副反應分為0~Ⅳ級。比較2組Ⅲ~Ⅳ級毒性反應率。
1.4 統計學分析 采用SPSS17.0統計分析軟件,計數資料比較采用χ2檢驗。
2 結 果
2.1 2組療效比較 結果詳見表1。
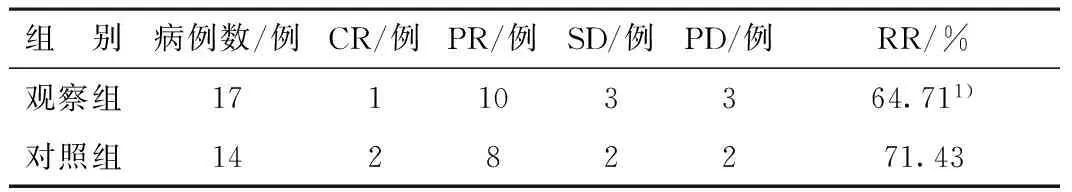
表1 2組治療結束后的近期療效比較
1)與對照組比較χ2=0.16,P>0.05
觀察組17例患者均完成2~6周期不等的化療,總共完成88周期化療,可評價療效。對照組17例患者共完成66周期化療。其中14例完成2~6周期化療,可評價療效。其余3例患者因出現變態反應立即停藥1例,因骨髓抑制停藥1例,嚴重腹瀉停止化療1例。治療結束后統計有效率比較無顯著性差異。
2.2 2組不良反應比較 觀察組與對照組分別有10例(58.82%)和14例(87.50%)患者出現骨髓抑制,包括白細胞減少、貧血及血小板減少;2組出現消化道副反應的比例為觀察組35.29%(6/17),對照組70.59%(12/17);變態反應僅對照組出現1例。Ⅲ~Ⅳ級毒性反應比例為觀察組11.76%(2/17),對照組47.06%(8/17)。2組Ⅲ~Ⅳ級毒性反應比較有顯著性差異(χ2=5.10,P<0.05)。
3 討 論
化療依然是晚期卵巢癌治療的主要模式。卵巢癌靜脈化療使用含鉑類方案已近40年,目前卡鉑聯合紫杉醇化療仍以一類證據作為美國國家綜合癌癥網絡(national comprehensive cancer network,NCCN)推薦方案[3]。大多鉑類聯合紫杉類的化療方案對卵巢癌治療都有可觀的有效率。晚期卵巢癌患者平均無進展生存期(progression free survival,PFS)約為18個月[4],NCCN卵巢癌治療指南中將一線使用鉑類化療后PFS≥6個月的復發患者定義為鉑類敏感性復發,而PFS<6個月的復發患者定義為鉑類耐藥性復發,但鑒于化療藥物之間的交叉耐藥性,部分晚期復發卵巢癌患者可能出現多藥耐藥(multi drug resistance,MDR),導致再次化療無效或治療中失敗。
現有研究表明,腫瘤細胞中化療藥物有效質量分數降低、DNA損傷修復系統改變、藥物作用靶點異常化、細胞凋亡調控異常等均是引起卵巢癌化療耐藥的重要因素[5,2]。關于增加腫瘤細胞中化療藥物有效質量分數最簡而可行的方法即增加給藥頻率。反觀腫瘤發生、發展、轉移,其基礎則是腫瘤血管生成。近年來興起的節拍化療,其實質是采用小劑量化療藥物頻繁給藥,以達到抗腫瘤血管生成的目的,因此也叫抗腫瘤血管生成化療(anti-angiogenesis chemotherapy)[6]。將該化療形式應用于晚期卵巢癌的治療,理論上不僅可以抑制腫瘤血管生成,而且可以使腫瘤細胞中化療藥物長時間維持在一個較高水平,避免因有效質量分數反復降低而誘發的化療耐藥。
本實驗研究結果表明,鉑類耐藥的晚期復發卵巢癌患者使用多西他賽節拍化療方式能達到與傳統3周方案相似的短期療效,且血液系統、消化系統等的毒副反應較3周方案輕,大多可耐受且不需中斷化療,有效保證了較為漫長的治療期間藥物有效質量分數的維持。但本實驗搜集病例數較少,隨訪時間較短,有待后期大樣本的臨床研究及更長隨訪時間的統計分析來進一步予以證實。
[1]KRIVAK T, SECORD A A, RICHARD S, et al. A chemoresponse assay for prediction of Platinum resistance in primary ovarian cancer[J]. Gynecol Oncol, 2013, 131(1): 276.
[2]MARKMAN M, WEBSTER K, ZANOTTI K, et al. Survival following the documentation of Platinum and taxane resistance in ovarian cancer: a single institution experience involving multiple phase 2 clinical trials[J]. Gynecol Oncol, 2004, 93(3): 699-701.
[3]胡洪林.從國際指南變更看大腸癌輔助化療的爭議與共識[J].現代臨床醫學,2013,39(6):471-475.
[4]SUNDAR S, WU Jian-hua, HILLABY K, et al. A systematic review evaluating the relationship between progression free survival and post progression survival in advanced ovarian cancer[J]. Gynecol Oncol, 2012, 125(2): 493-499.
[5]CHEN Hongmin, WANG Li, BERETOV J, et al. Co-expression of CD147/EMMPRIN with monocarboxylate transporters and multiple drug resistance proteins is associated with epithelial ovarian cancer progression[J]. Clin Exp Metastasis, 2010, 27(8): 557-569.
[6]LAQUENTE B, VINALS F, GERMA J R. Metronomic chemotherapy: an antiangiogenic scheduling[J]. Clinical & Translational Oncology, 2007, 9(2): 93-98.
Clinical Observation of Docetaxel Metronomic Chemotherapy in Platinum-Resistant Advanced Ovarian Cancer
YUAN Li
(Department of Oncology,Mianyang Central Hospital,Sichuan Mianyang 621000,China)
Objective:To observe the efficacy and the toxicity of docetaxel metronomic chemotherapy in treatment of the patients with platinum-resistant advanced ovarian cancer.Methods:34 patients with platinum-resistant advanced ovarian cancer (FIGO stage Ⅱ~Ⅳ) were randomly divided into two groups during 2008—2013 in our department:Metronomic chemotherapy group(n=17) was treated with docetaxel weekly,and control group(n=17) was treated with traditional three weeks docetaxel chemoterapy.Compared the Safety and effectiveness of the two groups after the end of all treatments.Results:The RR of metronomic chemotherapy group was 64.71% and control group was 71.43%,the difference was not statistically significant(P>0.05).The Ⅲ~Ⅳ toxic reaction in observation group was 11.76%,in control group was 47.06%; the metronomic chemotherapy group was better than the control group in toxicity tolerated.Conclusion:They are same as effective in two chemotherapeutic methods.Metronomic chemotherapy have higher security and more suitable in clinical application.
advanced ovarian cancer;platinum resistance;Docetaxel;metronomic chemotherapy
R737.31 <[文獻標志碼]A class="emphasis_bold">[文獻標志碼]A DOI:10.11851/j.issn.1673-1557.2015.05.004[文獻標志碼]A
10.11851/j.issn.1673-1557.2015.05.004
A DOI:10.11851/j.issn.1673-1557.2015.05.004
http://www.cnki.net/kcms/detail/51.1688.R.20150918.1750.024.html
2014-10-27)
E-mail:yuanli661@163.com

