紫山藥粗多糖提取工藝的優化及其抗氧化性的研究
劉杭達,馬千蘇,王 傑,周 韻,孫 璐,程永強
(植物源功能食品北京市重點實驗室,中國農業大學食品科學與營養工程學院,北京 100083)
紫山藥粗多糖提取工藝的優化及其抗氧化性的研究
劉杭達,馬千蘇,王 傑,周 韻,孫 璐,程永強*
(植物源功能食品北京市重點實驗室,中國農業大學食品科學與營養工程學院,北京 100083)
本文紫山藥粗多糖提取工藝的優化及抗氧化性的研究,以紫山藥為研究材料,在單因素實驗基礎上,利用正交實驗優化了紫山藥粗多糖提取工藝,確定在料液比1∶15(mg/mL)、提取溫度55 ℃、提取時間為2 h的條件下紫山藥粗多糖得率最高達到2.58%±0.03%。分別利用DPPH,超氧自由基,EDTA,ABTS四種方法對提取的紫山藥粗多糖進行了抗氧化實驗。結果表明,在DPPH和ABTS實驗中紫山藥粗多糖對自由基有明顯的清除效果,在DPPH實驗中紫山藥多糖濃度為2 mg/mL時清除率到達66.24%,在ABTS實驗中紫山藥濃度為24 mg/mL時清除率到達 69.50%,優于普通山藥多糖。
紫山藥,粗多糖,提取,抗氧化性能
山藥是一種多年生纏繞草質藤本植物,含有多種保健功能及成分,現代研究表明山藥具有降低血糖[1]、提高胃腸功能[2]、調節免疫系統[3]以及抗衰老[4]的作用。紫山藥是近年來發現的一種藥食同源的薯蕷科植物,屬于紫紅肉山藥品種,研究表明紫山藥中主要的活性成分多糖含量高于其他品種[5-6],具有較好的開發應用前景。經研究表明,因為多糖具有較高的抗氧化能力,使其具備卓越的醫療和保健功能,得到了廣大科研人員關注及研究。目前大量的多糖產品已經逐步應用到醫療和保健領域,在保障人們健康上發揮著重要的作用。目前,關于山藥多糖的研究較多,主要集中在提取分離技術[7],組成結構及其生物活性,部分研究發現粗多糖比純多糖更具活性[8-9]。但是關于紫山藥多糖的提取和抗氧化特性研究的報道還較少。因此,本文考察了在生產上常用的多糖的提取方法對紫山藥粗多糖的提取得率的影響,利用正交實驗對影響因素進行優化,并利用ABTS自由基清除活性、DPPH自由基清除、超氧自由基清除能力等實驗對提取的粗多糖的抗氧化性進行評價,為紫山藥多糖提取的工業化生產提供理論依據。
1 材料與方法
1.1 材料與儀器
新鮮紫山藥(紫玉淮山) 購于廣州市方緣貿易有限公司,紫山藥洗凈后去皮、切片、真空冷凍干燥并粉碎[10],制備成粉在干燥箱內常溫儲存備用。
氯仿,正丁醇,活性炭,無水乙醇,3,5-二硝基水楊酸,三羥甲基氨基甲烷(Tris),焦性沒食子酸,蕃紅,十二水合磷酸氫二鈉,二水合磷酸二氫鈉,乙二胺四乙酸(EDTA),七水合硫酸亞鐵,還原性鐵粉,30%雙氧水,鹽酸,乙腈等(分析純) 均購于中國國藥集團;ABTS,Trolox等 購于Sigma 2 Aldrich公司。
電熱恒溫水浴鍋(DZKW-D-2) 常州國華電器有限公司;CPA26P電子天平 賽多利斯;AdVantagePro臺式凍干機 美國VirTis;TDL-5000B型離心機 上海安亭科學儀器廠;DHG-9030電熱鼓風干燥箱 上海一恒科技有限公司;7200型可見分光光度計 尤尼柯(上海)有限公司。
1.2 實驗方法
1.2.1 多糖提取工藝實驗

1.2.1.2 多糖含量的測定 使用苯酚-硫酸法[10],用葡萄糖為標準物,在恒溫25 ℃,在490 nm處測定標準物濃度與吸光度的對應關系,制備標準曲線。
1.2.1.3 換算因素及多糖質量分數測定 實驗室精制紫山藥多糖在60 ℃下干燥至恒重,精確稱取多糖50 mg,用水溶解后定容到100 mL,搖勻做為多糖儲備液。精確量取多糖儲備液0.2 mL,加水至1 mL,按測定標準曲線同樣的方法測其吸光度值。
查標準曲線得葡萄糖質量濃度,多糖質量分數(%)=W/m
其中:W為多糖質量(g),m為樣品質量(g)。
1.2.2 單因素實驗設計
1.2.2.1 提取溫度對紫山藥粗多糖提取率的影響 精確稱取15 g紫山藥粉,置于250 mL燒杯中,料液比為1∶10(mg/mL),分別在40、45、50、55、60 ℃五種情況下,提取3 h,每組實驗3個平行,提取步驟同1.2.1.1。吸取1 mL提取的多糖溶液,將其裝入10 mL的刻度試管中,用水定容至10 mL。再吸取1 mL進行苯酚-硫酸法比色測定。
1.2.2.2 提取時間對紫山藥粗多糖提取率的影響 精確稱取15 g紫山藥粉,置于250 mL燒杯中,料液比為1∶10(mg/mL),在提取溫度50 ℃下分別浸提1、2、3、4、5 h,每組實驗3個平行,提取步驟同1.2.1.1。吸取1 mL提取的多糖溶液,將其裝入10 mL的刻度試管中,用水定容至10 mL。再吸取1 mL進行苯酚-硫酸法比色測定。
1.2.2.3 料液比對紫山藥粗多糖提取率的影響 精確稱取15 g紫山藥粉,置于不同大小中,在提取溫度50 ℃、提取時間2 h條件下,分別采用料液比1∶5、1∶10、1∶15、1∶20、1∶25(mg/mL)五種不同濃度進行提取。每組實驗3個平行,提取步驟同1.2.1.1。吸取1 mL提取的多糖溶液,將其裝入10 mL的刻度試管中,用水定容至10 mL。再吸取1 mL進行苯酚-硫酸法比色測定。
1.2.2.4 提取次數對紫山藥粗多糖得率的影響 精確稱取15 g紫山藥粉,置于250 mL 燒杯中,在提取溫度50 ℃、提取時間2 h、料液比為1∶10(mg/mL)條件下,分別提取1次、2次、3次,每組實驗3個平行,提取步驟同1.2.1.1。吸取1 mL提取的多糖溶液,將其裝入10 mL的刻度試管中,用水定容至10 mL。再吸取1 mL進行苯酚-硫酸法比色測定。
1.2.2.5 紫山藥粗多糖提取工藝優化 在單因素實驗的基礎上,進行L9(33)正交實驗,優化提取工藝。L9(33)因素水平表如表1。
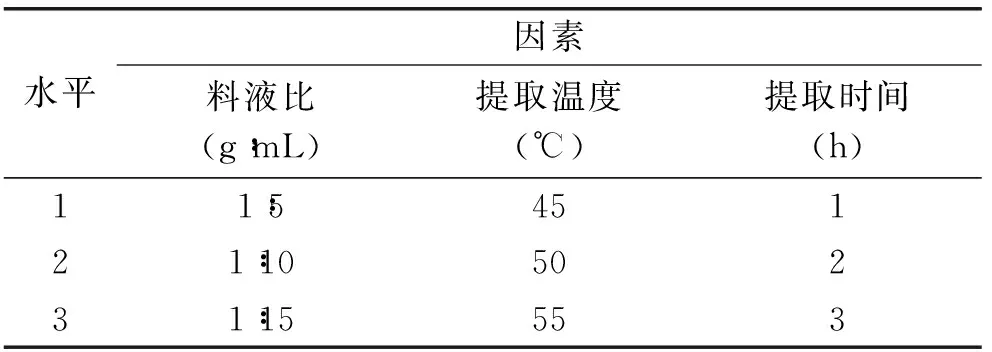
表1 因素水平表
1.3 紫山藥粗多糖的抗氧化性實驗
1.3.1 紫山藥粗多糖對DPPH自由基的清除作用測定 用連續加液器快速在不同樣品濃度1、2、3、4(mg/mL)中加入2.5 mL DPPH溶液,避光反應30 min后,用在517 nm下測定吸光值,并計算不同樣品濃度下相應的抑制率大小。每種樣品做3個平行,空白用5 mL蒸餾水代替樣品溶液[8,11]。

式中:A空白為空白組的吸光值;A樣品為樣品組的吸光值;A對照為樣品組的吸光值。
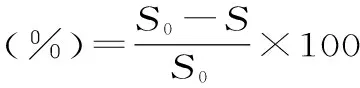
式中:S0-空白組的線性曲線斜率;S-樣品組的線性曲線斜率。
1.3.3 測定紫山藥粗多糖對羥自由基(·OH)的清除作用 按照表2數據制作反應體系,充分混勻,在37 ℃水浴鍋中水浴30 min,在波長520 nm下測定吸光值,計算樣品清除率。
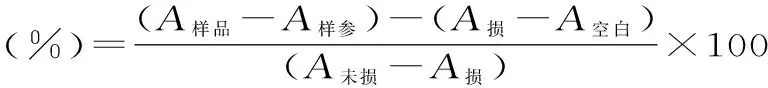
式中:A樣品-樣品管的吸光值;A樣參-樣品參照管的吸光值;A損-損傷管的吸光值;A未損-未損傷管的吸光值;A空白-空白管的吸光值[8,11]。
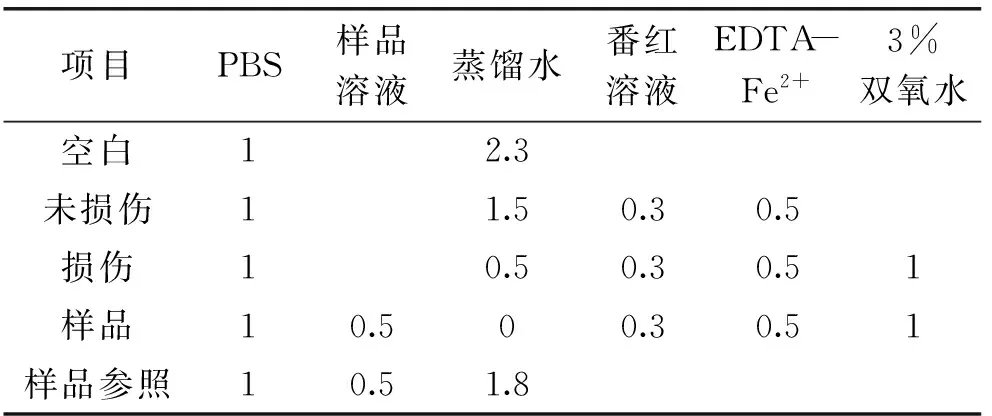
表2 反應體系
注:表中加樣量均為mL。
1.3.4 用ABTS法測定紫山藥粗多糖抗氧化性 取ABTS+自由基工作液4 mL置于10 mL具塞比色管中,分別加入80 μL的Trolox或樣品溶液。均勻振蕩10 s,30℃水浴反應6 min,測定其各自吸光度值,平行3組,取平均值計算清除能力[11-13]。
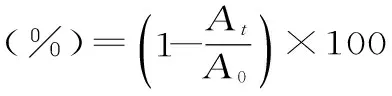
式中:At是水浴反應6 min后,測定反應混合液的吸光度;A0是ABTS+自由基工作液的吸光度值。
1.4 數據處理
實驗數據利用Excel2003、Origin 8.0軟件進行處理,所有實驗都重復3次以上,結果以平均值表示。
2 結果與討論
2.1 葡萄糖標準曲線與換算因素
實驗制備葡萄糖標準曲線,得到回歸曲線和直線方程,詳見圖1,A=0.164+5.270C(C:葡萄糖溶液濃度)相關系數r=0.9961。
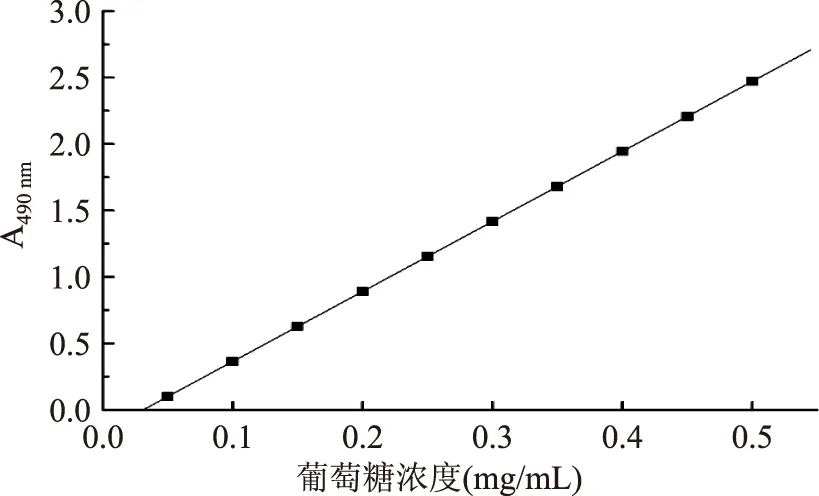
圖1 葡萄糖標準曲線Fig.1 The standard curve of glucose determination
回歸分析表明,在0.05~0.5 mg/L范圍內葡萄糖的含量與吸收度值呈良好線性關系。
2.2 單因素實驗分析
2.2.1 提取溫度對紫山藥粗多糖得率的影響 由圖2可見,隨著提取溫度的升高,多糖得率逐漸增大。在50 ℃后,多糖得率變化不大。在55 ℃下,多糖得率略有下降。可能是隨著提取溫度的升高,紫山藥多糖開始降解以及蛋白質逐漸溶出。考慮到經濟成本和防止多糖在高溫下遭受破壞喪失活性,提取溫度不宜過高。
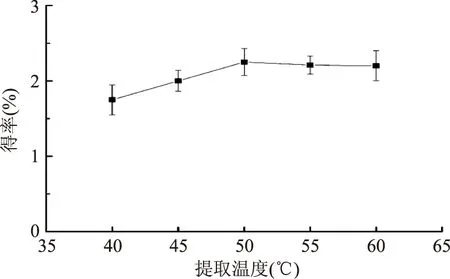
圖2 提取溫度對粗多糖得率的影響Fig.2 Effect of temperature on polysaccharide yield
2.2.2 提取時間對紫山藥粗多糖提取量的影響 由圖3可知,隨著提取時間的延長,多糖得率不斷上升,但在2 h后逐漸趨于平穩,上升趨勢不明顯。這可能是紫山藥中大多數多糖已溶出達到平衡。考慮到經濟成本和提取效果,選擇提取時間為2 h較為合適。
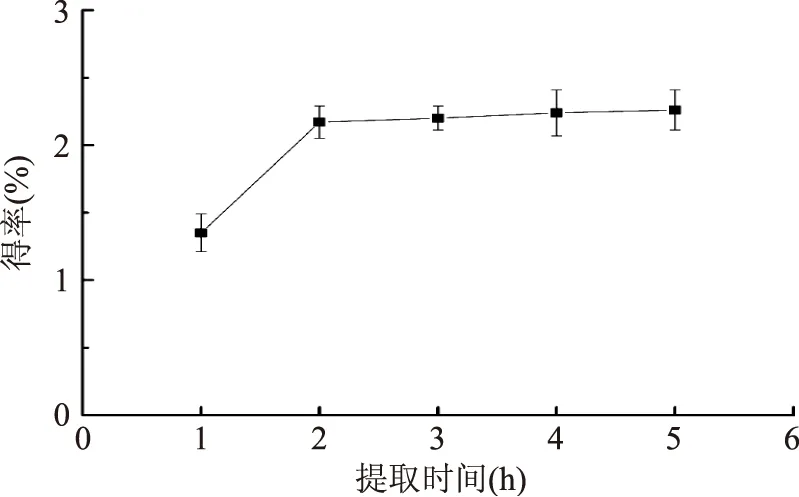
圖3 提取時間對粗多糖得率的影響Fig.3 Effect of time on polysaccharide yield
2.2.3 料液比對紫山藥粗多糖得率的影響 從圖4可以看出,料液比的提高會增加多糖的得率,在料液比為1∶10以后上升趨于平穩;考慮到提高料液比會對后續的工藝增加能耗,所以選擇料液比1∶10(g∶mL)較為合適。
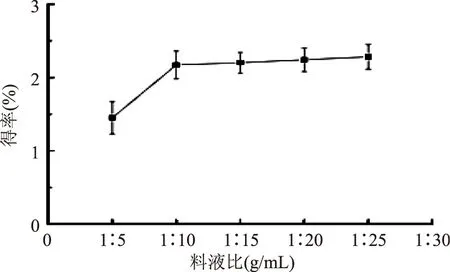
圖4 料液比對粗多糖得率的影響Fig.4 Effect of water-material ratio on polysaccharide yield
2.2.4 提取次數對紫山藥粗多糖得率的影響 由圖5可以看出,隨提取次數的增加,多糖的得率也有所增加,但增加效果并不顯著。故后續實驗不再以提取次數作為正交實驗的研究因素。
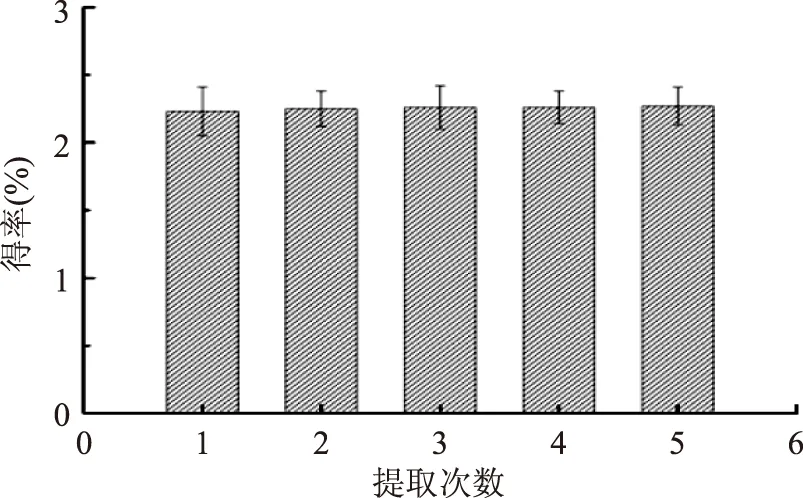
圖5 提取次數對粗多糖得率的影響Fig.5 Effect of times on polysaccharide yield
2.3 紫山藥粗多糖提取工藝條件的優化
在單因素實驗的基礎上,通過L9(33)正交實驗對紫山藥粗多糖提取工藝條件進行優化。實驗結果和極差分析見表3。根據表3的極差R的大小,影響多糖得率的因素主次順序為提取溫度>料液比>提取時間。
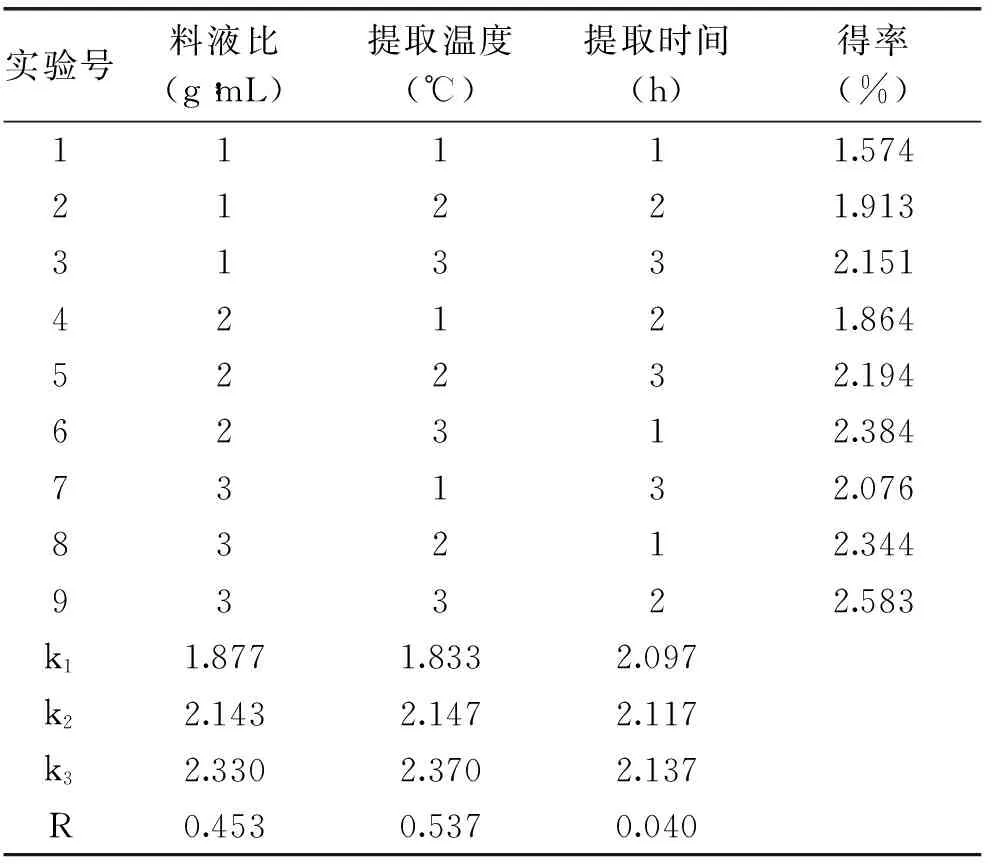
表3 L9(33)正交實驗表
通過正交實驗數據方差分析(表4)表明:提取溫度與料液比的差異較顯著,通過F比數值表明提取溫度、料液比對多糖提取得率影響顯著,說明提取溫度和料液比對紫山藥粗多糖提取起主要作用,提取溫度的影響要高于料液比。提取時間和提取次數對結果影響不顯著。通過實驗優化的最優提取工藝為為A3B3C3,即料液比1∶15、提取溫度55 ℃、提取時間3 h。通過實驗驗證在此條件下紫山藥多糖的得率為2.58%±0.03%。
2.4 紫山藥粗多糖抗氧化性的研究
2.4.1 紫山藥粗多糖濃度與清除DPPH自由基能力之間的關系 由圖6可知,隨著各個樣品的濃度不斷增加,各樣品清除DPPH自由基的能力逐漸增強。在1 mg/mL的濃度時,去除花青素組清除率為34.48%,未去花青素組為41.46%。在濃度達到2 mg/mL后,所有樣品的清除能力都趨于平穩且清除率達到峰值66.24%。從圖上可以明顯看出,去花青素組與未去花青素組的清除自由基的能力都低于Trolox,但由于花青素也是一種天然抗氧化劑[14],使得未去花青素組的自由基清除率要高于去除花青素組,進而提高了未去花青素組的抗氧化效果。
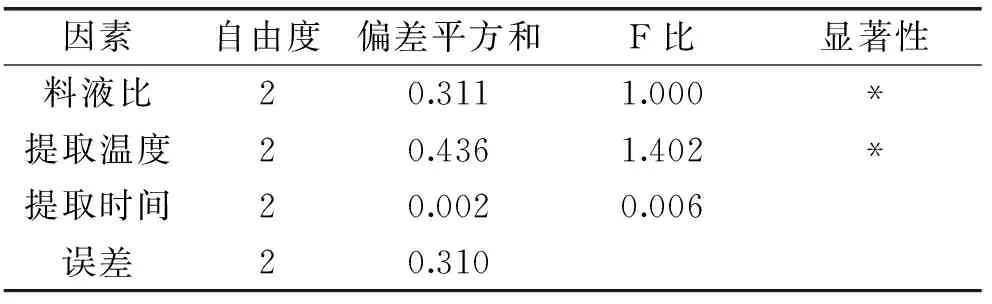
表4 正交實驗方差分析表
注:*表示差異顯著。
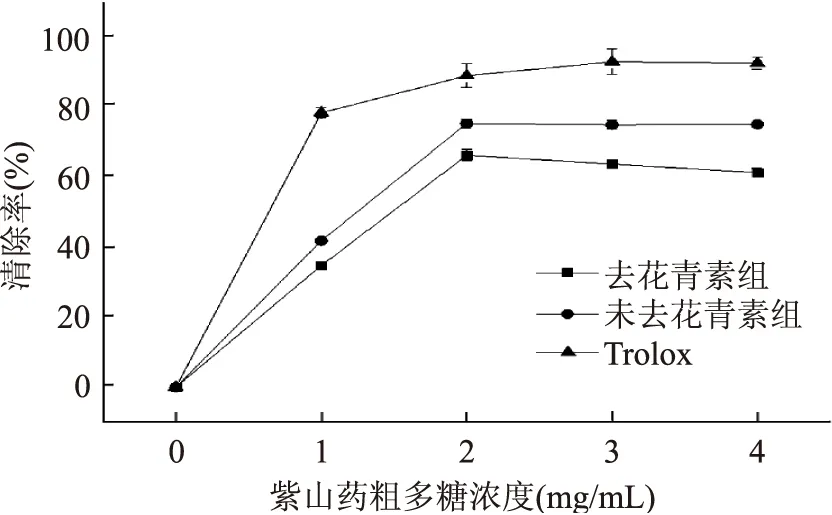
圖6 紫山藥粗多糖濃度對DPPH自由基清除能力的影響Fig.6 Effect of polysaccharide concentration on DPPH free radical scavenging
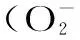
2.4.3 紫山藥粗多糖與清除羥自由基能力之間的關系 由表6可以看出,在羥自由基清除實驗中,紫山藥粗多糖的濃度對羥自由基清除效果無顯著影響,說明在實驗條件下,紫山藥粗多糖中的多糖成分無法與實驗中的(·OH)有良好的反應,對其實驗中所存的反應體系影響不大,在520 nm波長處吸光值無明顯的變化,沒有明顯的清除作用。
2.4.4 ABTS法測定紫山藥粗多糖的抗氧化性 由圖7可知,相比于Trolox,在濃度達到6 mg/mL后,抗氧化能力趨于平穩。未去花青素組與去花青素組隨著樣品的濃度不斷增加,樣品的抗氧化能力逐漸增強,并在濃度達到24 mg/mL時清除率達到峰值69.50%。從圖上也可以明顯看出,在ABTS實驗中,去花青素組與未去花青素組的清除自由基的能力都低于Trolox,但由于未去花青素組含有花青素成分,使其抗氧化效果要高于去除花青素組。

表5 紫山藥粗多糖濃度對超氧自由基清除能力的影響
表6 紫山藥粗多糖濃度對羥自由基清除能力的影響
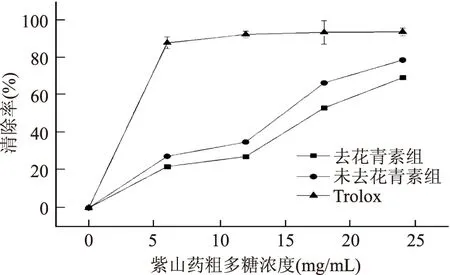
圖7 ABTS法測定紫山藥粗多糖抗氧化性Fig.7 The antioxidations of purple yam polysaccharide by ABTS method
3 結論與討論
本實驗通過對紫山藥粗多糖提取方法進行改進,提高了紫山藥粗多糖的得率,綜合考慮實驗及未來工業化生產情況,最終確定提取紫山藥粗多糖優化后的工藝為:料液比1∶15、提取溫度55 ℃、提取時間為3 h,在此條件下粗多糖得率達到2.58%±0.03%。未來可以考慮用酶法、超聲波的輔助手段進一步提高紫山藥多糖的得率。
分別利用DPPH,超氧自由基,EDTA,ABTS四種方法對提取的紫山藥粗多糖進行了抗氧化實驗。經過實驗結果的對比分析,紫山藥粗多糖對DPPH和ABTS有明顯的清除效果,并且在DPPH實驗中多糖濃度在4 mg/mL、在ABTS實驗中多糖濃度在25 mg/mL條件下對自由基的清除率在75.76%左右。未去花青素組由于含有花青素成分,使其抗氧化效果要高于去除花青素組。由于在多糖提取過程中大部分花青素被除去,所以未去花青素組中殘留的花青素成分對紫山藥粗多糖自由基清除能力的貢獻有限,與去花青素組相比沒有明顯提高粗多糖的抗氧化能力,說明在粗多糖中起主要抗氧化作用的成分是紫山藥多糖。在紫山藥多糖對超氧自由基和羥自由基清除實驗中并沒有體現出多糖對自由基的良好清除效果。這可能說明DPPH和ABTS法能更好的檢驗紫山藥多糖的抗氧化效果,同時應進一步從多糖的結構角度進行研究,探討多糖結構對自由基清除作用的影響。在DPPH自由基清除實驗中反應時間、光照強度、pH等因素會對實驗結果有一些影響,造成粗多糖在不同實驗條件下有不同的抗氧化活性[15]。若條件允許,未來可用高效液相色譜法、化學發光法等效率高且準確的實驗方法研究紫山藥多糖對抗氧化劑DPPH自由基清除的效果[16]。ABTS法操作簡便、快捷,且結果重復性好,適合本實驗紫山藥多糖體外抗氧化性測定[13]。但是該方法TEAC值在反應條件不同時會產生不同的變動,只有待測物濃度達到一定范圍值時才可以保持TEAC值相對穩定[17]。所以需要對實驗進行預處理,找到相對穩定的樣品實驗濃度。
[1]朱明磊,唐微,官守濤.山藥多糖對糖尿病小鼠降血糖作用的實驗研究[J].現代預防醫學,2010,37(8):1524-1527.
[2]傅紫琴,蔡寶昌,卞長霞,等.山藥及其麩炒品的多糖成分對脾虛小鼠胃腸功能的影響[J].藥學與臨床研究,2008,16(3):181-183.
[3]趙國華,李志孝,陳宗道,等.山藥多糖的免疫調節作用[J].營養學報,2002,24(4):187-188.
[4]詹彤,陶靖,王淑如.水溶性山藥多糖對小鼠的抗衰老作用[J].藥學進展,1999,23(6):356-360.
[5]于東,林躍偉,陳桂星,等.紫山藥營養成分分析研究[J].營養學報,2010(2):190-192.
[6]王洪新,王遠輝.山藥多糖研究進展[J].食品與生物技術學報,2011,30(3):321-327.
[7]梁亦龍,閻光凡,舒坤賢,等.山藥水溶性多糖的提取及抗氧化性研究[J].食品研究與開發,2007,28(11):1-3.
[8]何書英,詹彤,王淑如.山藥水溶性多糖的化學及體外抗氧化活性[J].中國藥科大學學報,1994,25(6):369-372.
[9]聶瑩.酸降解法制備褐藻寡糖的功能性研究[D].北京:中國農業大學,2012.
[10]徐世忱,李廣全,孫瑩.北五味子粗多糖的提取與成分分析[J].吉林醫藥工業,1992(4):15-18.
[11]劉小兵,樸建華.幾種生物活性物質體外抗氧化能力評價技術的研究[J].衛生研究,2009,38(3):280-283.
[12]檀子貞,王紅育,吳雅靜.山藥噴霧干燥粉的加工工藝研究[J].食品工程,2010,1(3):31-33.
[13]Williamsong,Plumb G W,Garcia-Conesamt. Glycosylation,esteri cation and polymerization of avonoids and hydroxycinnamates:effects on antioxidant properties[J]. Basic Life Sci,1999,66:483-494.
[14]李穎暢,孟憲軍,孫靖靖,等.藍莓花色苷的降血脂和抗氧化作用[J].食品與發酵工業,2008,34(10):44-47.
[15]Chandrasekar D,Madhusudhana K,Ramakrishna S,et al. Determination of DPPH free radical scavenging activity by reversed-phase HPLC:A sensitive screening method for polyherbal formulations[J]. Journal of Pharmaceutical and Biomedical Analysis,2006,40(2):460-464.
[16]Scalzozo R L. Organic acids influence on DPPH scavenging by ascorbic acid[J]. Food chemistry,2008,107(1):40-43.
[17]Mariken J T J Arts,J Sebastiaan Dallinga,Hans-Peter Voss,et al. A new approach to assess the total antioxidant cap a city using the TEAC assays[J]. Food Chem,2004,88:567-570.
Optimization of extraction conditions and investigation of antioxidant activity of polysaccharides from purple yam
LIU Hang-da,MA Qian-su,WANG Jie,ZHOU Yun,SUN Lu,CHENG Yong-qiang*
(College of Food Science & Nutritional Engineering,Beijing Key Laboratory of Functional Food from Plant Resources,China Agricultural University,Beijing 100083,China)
The polysaccharide extraction from purple yam was optimized based on single factor experiment combined with orthogonal design. The optimum extraction conditions were achieved when the ratio of solid to liquid was 1∶15(mg/mL)at 55 ℃ for 2 h. Under such conditions,the yield ratio of purple yam polysaccharide reached as high as 2.58%±0.03%. The antioxidant activity of crude polysaccharide from purple yam was extensively investigated by antioxidant experiments tests based on DPPH,superoxide radical,ABTS and EDTA. The experimental results showed that the polysaccharides from purple yam exhibited significant antioxidant activity in the DPPH and ABTS tests with free radical scavenging rates being 66.24% at 2 mg/mL and 69.50% at 24 mg/mL,respectively,which was better than the polysaccharides from Yam.
purple yam;crude polysaccharide;extraction;antioxidant activity
2015-03-23
劉杭達(1993-),男,本科,研究方向:紫山藥多糖,E-mail:liuhangda93@163.com。
*通訊作者:程永強(1972-),男,博士,教授,研究方向:食品物性評價;天然產物提取,功能食品的評價與開發;糧食加工;酶在農產品綜合加工利用中的應用,E-mail:chengyq@cau.edu.cn。
國家大學生創新計劃支持項目(201310019054);國家自然科學基金支持項目(31171739)。
TS255.1
B
1002-0306(2015)23-0208-06
10.13386/j.issn1002-0306.2015.23.035

