小麥高蛋白質含量基因GPC—B1的分子標記研究
胡云 徐如宏
摘 要:應用SSR分子標記技術對4份來自美國的小麥研究材料的高蛋白含量基因GPC-B1進行分子標記分析。通過引物篩選和標記研究,其SSR分子標記為Xuhw89122 。為鑒定其分子標記分析結果,對所有的小麥研究材料進行蛋白質含量的測定,來自美國的4份研究材料之一的PI638740的蛋白質含量高達20.41%,明顯高于其他研究材料。田間觀察結果顯示,PI638740的成熟期比別的研究材料提前衰老一周左右。本研究將為轉移控制小麥高蛋白質含量的基因到其他優良小麥品種(品系)中、推進小麥育種進程及改進小麥育種技術提供理論依據。
關鍵詞:小麥;高蛋白基因;分子標記;蛋白質含量
中圖分類號: S511 文獻標識碼:A DOI 編碼:10.3969/j.issn.1006-6500.2014.09.002
Abstract:The high protein content gene GPC-B1 was marked by SSR markers in four high protein wheat from America. The GPC gene was on the short arm of chromosome 6B from Triticum turgidum ssp.dicoccoides. Its SSR markers was Xuhw89122 .The protein of PI638740 content was tested for 20.41%. Obviously, the protein content of one of the four materials was highest. The results in field showed that it matured more previously round a week compared with the only other wheat. The markers acquired would offer an effective elected means to transfer the high protein gene to other wheat materials.
Key words:wheat; high protein gene; molecularm markers; protein content
大量的信息顯示,在小麥育種和生產上世界各國都經歷了從重視產量到產量和質量并重的過程。在中國,小麥品質育種起步較晚,而在國外很早就開始了。自20世紀80年代以來,中國許多育種單位把小麥的主要育種目標定為質量改進及小麥品質性狀的遺傳[1-3]。自“七五”以來,國家科技攻關計劃已經包括了小麥品質育種。
當今小麥育種工作的重點是小麥品質改良,小麥改良的基礎是遺傳多樣性,分子標記為遺傳多樣性研究的最理想的標記。很多學者采用形態學性狀、蛋白電泳、RFLP和RAPD等來評價小麥遺傳多樣性,其中分子標記被認為是研究遺傳多樣性的最理想標記[4-5]。很多學者利用形態性狀、蛋白質電泳、RFLP和RAPD等對普通小麥的遺傳多樣性作過評價。
在野生二粒小麥中找到一個基因GPC(Grain protein content),可以提高營養價值的潛在資源,并成功地克隆、轉入多個現有小麥品種中。GPC基因來源于以色列野生二粒小麥基因型FA15-3,被定位于染色體6BS。后來,又從同一野生二粒小麥即FA15-3中發現了抗條銹病基因Yr36,該基因位于6BS染色體上,研究表明該抗條銹病基因與高蛋白基因GPC-B1緊密連鎖。Olmos等將此基因位點(QTL的數量,數量性狀位點)作為一個單基因孟德爾位點,命名為GPC-B1,限定于2.7 cM的遺傳距離之間[6-11]。Distelfelt等進一步將GPC-B1區域限制在0.3 cM之內[12]。Uauy等利用兩個Marker Xuhw89和Xuhw71標記出250 kb的DNA片段,其中包含GPC-B1[13-14]。2007年,高效遺傳圖譜將基因GPC-B1限制在一個7.4 kb的區域,并且還發現這個區域包含著一個可以用來編碼轉錄因子的單基因[15]。通過對GPC-B1轉基因和非轉基因小麥的大量觀察,7.4 kb區域的存在與其表現型的差異關系密切,這表明GPC-B1基因是一個具有多重效應的基因。
另外,還發現了含有高蛋白質含量基因GPC-B1的小麥比一般小麥的衰老期平均提前4~5 d,而且小麥籽粒中的蛋白質含量及Fe、Zn微量元素含量增加了10%~15%[16-18]。以上研究表明:轉基因小麥成熟期有所縮短,養分逐漸向成熟種子轉移,使養分得到了再利用。
關于小麥蛋白質含量研究的文章大多集中在HWM-GS方面,而從控制高蛋白含量基因方面研究的文章卻很少見報道。本研究目的就是利用微衛星分子標記研究小麥高蛋白基因GPC-B1,以期促進該基因在小麥育種中的應用,對輔助小麥高蛋白含量的育種,提高選擇效率都有所裨益。
1 材料和方法
1.1 材 料
4份小麥高蛋白材料分別為A-GPC,R-GPC,PF638741,PI638740。另外,還有龍96-6239×貴農105/775F2 (后稱X—2003),貴農775,貴農5號,貴農21和萊州137等10個貴州當地小麥。pm21為抗白粉病基因,其中貴農775就含有此基因[19-20]。以4份高蛋白含量材料作為父本,分別與貴農775配置雜交組合,其雜種F1自交得到F2植株,從F1和F2中分別選取100個單株進行SSR分子標記分析,其余材料作為對照。4份高蛋白材料引自以色列,其余材料來自貴州大學麥作研究中心。
1.2 小麥籽粒蛋白質含量的測定
按照ICC標準,NO,116,NO,118(NIR),然后用Foss kjeltecTM2200型全自動凱氏定氮儀測定,測量6次并取平均值。
1.3 小麥總DNA的提取
親本材料、雜種F1代及F2100個單株葉片總DNA的提取。參照Devos的酚-氯仿提取法提取葉片DNA,略有修改[21]。適于1.5 mL離心管提取。取0.2 g的新鮮幼嫩葉片放入研缽中,加入750 μL的提取緩沖液(100 mmol·L-1 Tris-HCl,50 mmol·L-1 EDTA-Na2,2.0%CTAB,100 mmol·L-1 NaCl)磨碎后轉至1.5 mL的離心管內,65 ℃下水浴1 h。在此期間上下顛倒2次,然后加入相同體積的24∶1的氯仿-異戊醇,顛倒混勻10 min,置于18 ℃的冰凍離心機內,13 000 r·min-1,離心10 min。然后取上清液,放入1.5 mL離心管中,加入750 μL異丙醇,上下緩慢顛倒混勻,13 000 r·min-1離心10 min。去上清液,用1 mL 70%乙醇清洗DNA沉淀,室溫下放置5~10 min,7 500 r·min-1離心5 min,去上清液,干燥。加入0.1TE100 μL 混勻,37 ℃下水浴1 h;取總DNA提取液2 μL,用1.0%瓊脂糖電泳檢測,了解總DNA的純度和濃度。
1.4 PCR 擴增
在Perkin-Thermocycle 480上進行特征PCR反應,其反應總體積為20 μL。SSR標記反應體系中含有50 mmol·L-1 KCl,10 mmol·L-1 Tris-HCl(PH8.8),2.0 mmol·L-1 MgCl2,50~100 ngDNA模板,特異引物0.5 μmol·L-1,100 μmol·L-1 Dntp,1 U Taq DNA聚合酶,定容至20 μL。加少量礦物油覆蓋后進行擴增。反應條件為94 ℃預變性5 min,94 ℃ 30 s,59 ℃ 30 s,72 ℃ 45 s,再循環37次, 72 ℃延伸5 min。采用1.5%的瓊脂糖凝膠電泳檢測反應產物,加溴化乙錠0.5 μg·mL-1,電壓為7 V·cm-1,1×TAE電泳緩沖液,紫外光觀察并照相。與高蛋白基因GPC-B1連鎖的特異引物為Xuhw89,其序列為:UHW89-BF 5'- TCT CCA AGA GGG GAG AGA CA -3',UHW89-R 5'- TTC CTC TAC CCA TGA ATC TAG CA -3'。特異引物UHW89-BF及UHW89-R擴增多態性標記為SSR122。
2 結果與分析
2.1 引物篩選
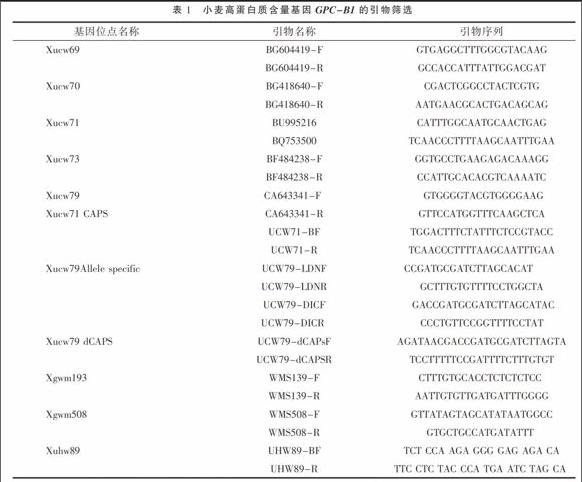
根據C Uauy等[5]野生二粒小麥(Triticum turgidum ssp.disossoides)6BS染色體上抗條銹病基因Yr36、小麥高蛋白含量基因GPC的遺傳圖譜,初步篩選兩個基因連鎖的引物,見表1。
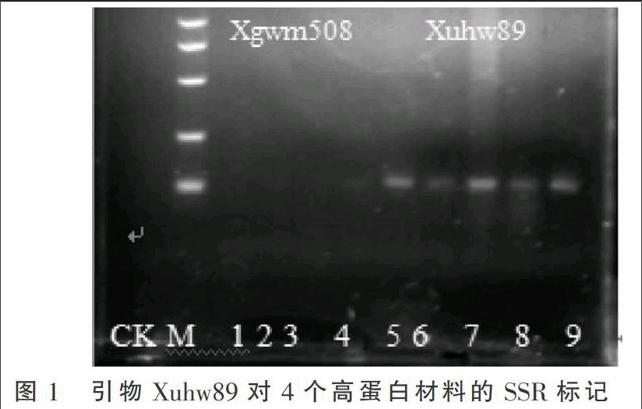
應用SSR分子標記技術篩選與GPC-B1基因連鎖的引物(表1),設置多個重復,引物為Xuhw89122標記的結果重復性較好,擴增結果見圖1。上述12對引物中,在122 bp的位置能擴增出特征DNA片段的只有引物Xuhw89。另外Xgwm508引物在170 bp位置也能擴增出特征帶,但是該引物性狀很不穩定,有時不能顯示特征帶,如圖1所示。圖1中6~10為4份高蛋白材料,其中5、6為研究材料A-GPC。
2.2 小麥蛋白質含量的測定
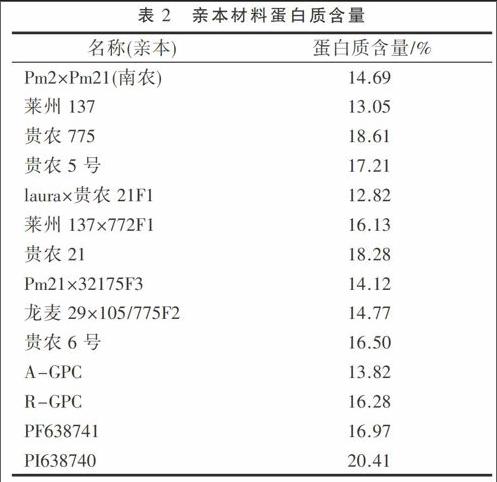
對4份小麥高蛋白質含量的材料、11個貴州當地小麥材料用微量凱氏定氮法測定其蛋白質含量(表2)。4份小麥高蛋白材料中,有1份材料的蛋白質含量明顯比其他材料高,其余3個小麥高蛋白材料的蛋白質含量卻比部分貴州當地材料低,貴州當地的小麥材料中蛋白質含量都不高。綜合來看可能是由于地理、氣候、土壤、水分等多方面因素所致,使其目標性狀得不到表達。但分子標記的結果顯示,4份小麥高蛋白材料都含有高蛋白質含量基因GPC,這說明分子標記鑒定結果仍然存在著局限性,分子標記技術分析對基因是否表達提供不了任何可靠的依據,還需采用其他方法測定其蛋白質含量,以進一步驗證分子標記的結果。
2.3 小麥高蛋白含量基因GPC-B1的SSR標記
對4份高蛋白材料A-GPC,R-GPC,PF638741,PI638740,以及龍96-6239×貴農105/775F2,對照材料萊州137、貴農5號進行SSR標記(圖2)。從圖2中可以看出,引物Xuhw89 在122 bp位置附近標記出了4個小麥高蛋白材料,都出現了一條特征帶。而蛋白含量不高的兩個對照材料萊州137和貴農5號在同一位置都不具有此特征帶。對PI638740×貴農775的F1、F2 的100個單株進行高蛋白質含量基因GPC-B1的篩選,結果表明,4份小麥高蛋白材料中都含有控制蛋白質含量較高的目標基因GPC-B1,而對照材料中均沒有。雜交F1也能擴增出122 bp的特征帶(圖3),F2單株群體的高蛋白基因呈現3∶1的比例,說明高蛋白材料中高蛋白基因是受顯性單基因控制的。
為檢測引物Xuhw89的穩定性和與高蛋白基因連鎖的關系,對PI638740與貴農775雜交F2單株群體共100個植株進行SSR擴增分析(圖4)。結果表明,引物Xuhw89122 擴增帶是與上述4份高蛋白含量材料中的高蛋白基因GPC-B1連鎖的。在100株單株中,顯示有73株具有特征帶,27株無特征帶,接近3∶1。
3 結論與討論
在本研究中,為篩選出能標記高蛋白基因GPC-B1的引物,根據大量資料挑選了12對引物,經篩選最后確定了引物Xuhw89的穩定性是最好的。通過對4份小麥高蛋白材料及另10份貴州當地小麥進行目標性狀分子標記檢測,證明了4份高蛋白材料含有目標基因GPC-B1,其余研究材料中并不存在此基因。同時利用微量凱氏定氮法進一步驗證其蛋白質含量,其中研究材料PI638740的蛋白質含量高達20.41%。其余研究材料即10份貴州當地小麥的蛋白質含量在14%~16%之間的較多,能達到18%以上有一兩個。4個小麥高蛋白材料中除PI638740外,經凱氏定氮法測定,其余3個材料的蛋白質含量并不高,結果顯示與研究材料中貴州當地小麥的蛋白質含量相當,在13.82%~16.97%之間,其原因可能是由于地域、環境和氣候等多方面的因素所致,使其高蛋白基因不表達。另外,田間試驗表明,材料PI638740的成熟期比其他小麥研究材料提前1周左右。這跟Avivi等[18]學者的研究結果是一致的。這說明該研究材料在地理環境等都發生很大變化之后其目標基因的表達仍然沒有受到太大的影響,其余3份高蛋白研究材料截然相反,目標基因不但沒有表達,成熟時間也改變了。因此,對高蛋白材料PI638740來說是比較穩定的,有望將其控制高蛋白基因GPC-B1聚合到優質的、含有其他優良基因比如抗病基因,優質亞基等的小麥品種(品系)中,以提高小麥的品質和營養價值,滿足當今人們對小麥的食用要求。
貴州當地小麥長期存在且仍有待解決的問題是品質差,蛋白質含量普遍較低是最受關注并試圖解決的問題之一。提高小麥蛋白質含量、改良其品質的最高效、最可行的方法是通過傳統育種和分子標記相結合的途徑,轉育選育蛋白質含量較高、品質較好的品種(或品系),再根據現有育種基礎和育種目標,通過品種間雜交、遠緣雜交等途徑來實現。
通過研究表明,與傳統的鑒定方法相比,分子標記多用于目的基因的鑒定,具有方便快捷的特點。分子標記主要是用于田間性狀的輔助篩選,這樣既可以減輕田間的勞動強度,又可以加快推進目標品種的選育進程。因此,在今后小麥高蛋白基因的鑒定及高蛋白含量品種的選育中,分子標記技術與傳統育種相結合的方法的應用將會具有更廣泛的用途和更寬闊的前景。
參考文獻:
[1] 張本民. 小麥誘發突變品質育種的探討[J].華北農學報,1992(2):23-29.
[2] 林作楫,雷振生,楊攀,等.中國小麥品質育種進展與問題[J]. 河南農業科學,2007(2):5-8.
[3] 張俊靈,孫美榮,張東旭,等. 山西省農科院谷子研究所小麥品種改良及系譜分析[J]. 山西農業科學,2011(3):217-220,224.
[4] 孫輝,劉志勇,李保云,等.利用PCR技術鑒定普通小麥Glu-1位點的某些等位基因[J].作物學報,2002,6(28):734-737.
[5] Uauy C, Brevis J C, Khan I, et al. High-temperature adult-plant(HTAP) strip rust resistance gene Yr36 from Triticum turgidum ssp.dicoccoides is closely linked to the grain protein content locus GPC-B1[J].Theor Appl Genet,2005,112:97-105.
[6] Joppa L R, Cantrell R G. Chromosomal location of genes for grain protein content in wild tetraploid wheat[J].Crop Science, 1990,30:1 059-1 064.
[7] Joppa L R, Du C, Hart G E, et al. Mapping gene(s) for grain protein in tetraploid wheat (Triticum turgidum L.) using a population of recombinant inbred chromosome lines[J]. Crop Science, 1997,37(5):1 586-1 589.
[8] Mesfin A, Frohberg R C, Anderson J A. RFLP markers associated with high grain protein from Triticum turgidum L. var. dicoccoides introgressed into hard red spring wheat[J]. Crop Science, 1999,39(2):508-513.
[9] Khan I A, Procunier J D, Humphreys D G, et al. Development of PCR-based markers for a high grain protein content gene from Triticum turgidum ssp. dicoccoides transferred to bread wheat[J]. Crop Science, 2000,40(2):518-524.
[10] Jorge D, Tzion F. Positional cloning of a gene responsible for high grain protein content in tetraploid wheat[R]. BARD Final Scientific Report,2004.
[11] Distelfeld A,Cakmak I,Peleg Z,et al. Multiple QTL-effects of wheat Gpc-B1 locus on grain protein and micronutrient concentrations[J]. Physiologia Plantarum, 2007,129(3): 635-643.
[12] Distelfeld A,Uauy C,Olmos S, et al. Microcolinearity between a 2-cM region encompassing the grain protein content locus GPC-B1 on wheat chromosome 6 and a 350kb region on rice chromosome 2[J].Functional and Integrative Genomics,2004(4):59-66.
[13] Cristobal U, Juan C B, Jorge D. The high grain protein content gene Gpc-B1 accelerates senescence and has pleiotropic effects on protein content in wheat[J]. Journal of Experimental Botany, 2006, 57(11):2 758-2 794.
[14] Uauy C, Distelfeld A, Fahima T, et al.A NAC gene regulating senescensce improves grain protein, zinc, and iron contents in wheat[J].Science,2006,314:1 298-1 301.
[15] Cristobal U, Assaf D, Tzion F, et al. The wheat Gpc-B1 QTL for grain protein, Zn, and Fe content is a transcription factor regulating senescence[M]. San Diego: January Town & Country Convention Center San Diego,2007: 13-17.
[16] Sun Qixin, Ni Zhongfu, Liu Zhiyong, et al. Genetic relation-ships and diversity among Tibetan wheat,common wheat and European spelt wheat revealed by RAPD markers[J].Euphytica,1998,99:205-211.
[17] Jia J Z, Zhang Z B, Deos K, et al. RFLP map-based genetic diversity in wheat(Yriticum aestivum L.) [J].Science in China,2001,31(1):13-21.
[18] Avivi L. High protein content in wild tetraploid Triticum dicoccoides Korn[C]//Ramanujam S. Proceedings of the 5th international wheat genetics symposium. New Delhj: Indian Society of Genetics and Plant Breeding(ISGPB), 1978:372-380.
[19] 徐如宏,任明見,黃世全,等.小麥抗病種質貴農775中抗白粉病基因的RAPD標記[J].作物學報,2005,31(2):243-247.
[20] 徐如宏,張慶勤.貴農系列高產、多抗小麥新材料中HMW-GS的組成研究[C]//沈天民.超級小麥遺傳育種研究.北京:中國農業科學技術出版社,2003:193-197.
[21] Jia J, Devos K M, Chao S,et al. RFLP-based maps of the homoeologous group-6 chromosomes of wheat and their application in the taggingof Pm12, a powdery mildew resistance gene transferred from Aegilops speltoides to wheat[J]. Theor Appl Genet, 1996, 92:559-565.

