馬爾尼菲青霉酸性磷酸酶在宿主氧化殺傷中的作用
黃 曉,張軍民,蔣 麗,王 麗, 魯 莎,蔡文瑩
馬爾尼菲青霉酸性磷酸酶在宿主氧化殺傷中的作用
黃 曉,張軍民,蔣 麗,王 麗, 魯 莎,蔡文瑩
目的 探討馬爾尼菲青霉(Penicilliummarneffei, PM)酸性磷酸酶(Acidphosphatase,ACP)在宿主氧化殺傷中的作用。方法 在培養基中加入不同濃度H2O2模擬氧化應激環境,于25 ℃和37 ℃震蕩培養后檢測上清液中ACP的活性。通過用特定培養基誘導酶分泌、滅活、抑制劑處理的方法獲得不同酶活性的PM分生孢子,建立分生孢子與巨噬細胞共培養模型;利用H2DCFDA標記聯合流式細胞術檢測巨噬細胞ROS的釋放量,CFU及透射電鏡觀察巨噬細胞對PM的殺傷情況。結果PM菌絲相及酵母相均能分泌ACP,加入H2O2后兩相ACP活性均提高;誘導PM分泌酸性磷酸酶,巨噬細胞ROS釋放量及對菌體殺傷能力被抑制;將酶抑制后,巨噬細胞ROS釋放量增加,對菌體殺傷能力增強。結論PM在氧化應激條件下能通過分泌ACP抑制巨噬細胞ROS產生,從而抵御宿主的氧化殺傷作用。
酸性磷酸酶;馬爾尼菲青霉;巨噬細胞;氧化殺傷;ROS
馬爾尼菲青霉病是由馬爾尼菲青霉(Penicilliummarneffei,PM)感染引起的深部真菌病,主要累及網狀內皮-巨噬細胞系統[1],常引起全身廣泛播散,病死率高。馬爾尼菲青霉是一種溫度依賴性雙相真菌, 25 ℃條件下呈菌絲相生長,可產生大量分生孢子;37 ℃時呈酵母相,感染人及動物時以酵母形態存在于宿主體內。PM分生孢子可經呼吸道進入宿主體內隨即被支氣管、肺部的巨噬細胞所吞噬,以酵母相在巨噬細胞內分裂增殖。巨噬細胞吞噬病原體后可通過呼吸爆發產生大量氧活性簇(ROS)對菌體進行氧化殺傷,作為一種細胞內病原菌,PM如何抵御巨噬細胞的氧化殺傷作用在細胞內存活目前尚未明確。
酸性磷酸酶(acidphosphatase,ACP)是一類廣泛存在于微生物及動植物的水解酶,被認為是許多病原菌的重要毒力因子[2-5],主要通過抑制宿主ROS產生發揮其毒力作用。既往有文獻報道PM可分泌ACP[6],然而ACP與PM致病性方面的研究尚未見報道。本實驗通過研究PM在氧化應激條件下ACP的分泌情況及其酶學性質,抑制ACP活性后對巨噬細胞ROS產生及殺傷能力的影響,初步探討酸性磷酸酶在馬爾尼菲青霉抵御巨噬細胞氧化殺傷中的作用,以明確馬爾尼菲青霉在巨噬細胞氧化應激條件下存活的機制。
1 材料和方法
1.1 材料
1.1.1 主要試劑 DMEM培養基及胎牛血清購自美國Gibco公司,馬鈴薯葡萄糖瓊脂培養基(PDA)購自日本和光純藥工業株式會社, Acid Phosphatase檢測試劑盒、Acid Phosphatase 抑制劑(正釩酸鈉、酒石酸鈉、鉬酸鈉、氟化鈉、β-甘油磷酸鈉)均購自Sigma公司,DCFH-DA熒光測定試劑盒購自上海杰美基因醫藥科技有限公司。酸性磷酸酶誘導培養基配制試劑購自廣州威佳生物公司(葡糖糖; NaNO3; MgSO4.7H2O; KCl; FeSO4.7H2O;檸檬酸;檸檬酸鈉)。
1.1.2 菌株來源 馬爾尼菲青霉SUMS0152 株(已經形態學及DNA測序鑒定) ,由中山大學孫逸仙紀念醫院醫學真菌研究中心提供,分離自一名血液病患兒的血液標本。細胞系:BALB/c小鼠來源的巨噬細胞株RAW264.7購自中國典型培養物保藏中心(CCTCC)(武漢,湖北)。
1.2 方法
1.2.1PM培養上清及分生孢子制備 將PM分別接種于含有2mmol/L H2O2的酸性磷酸酶誘導液體培養基中(配制方法參照文獻[7]),對照管加入等量生理鹽水代替H2O2,25 ℃及37 ℃ , 150 r/ min 振蕩培養96 h,從各培養管中取2 mL菌懸液離心過濾得到上清液,-20 ℃保存備用。PM接種于馬鈴薯斜面培養(PDA),25 ℃室溫下培養7~9 d,PBS反復沖洗培養基表面,離心去色素,生理鹽水重懸,鏡下觀察為單細胞性分生孢子,計數4 ℃保存備用。
1.2.2 巨噬細胞培養 無菌操作復蘇RAW264.7細胞株,用含10%小牛血清的DMEM培養基培養2~3 d,EDTA-胰酶消化傳代2~3次后轉至六孔板,調整細胞密度為1×106/mL,每孔1 mL。根據實驗要求分組。
1.2.3ACP活性檢測 以 p-NPP為底物,將菌懸液50 μL加入96孔板中再加入等量ACP底物,混勻,37 ℃孵育1 h后用0.5N NaOH溶液終止反應,將反應板放入酶標儀于405波長處測各孔吸光值。根據說明書公式計算其對應的ACP活性(單位為Units/mL)。
1.2.4 PAS染色觀察巨噬細胞對PM的吞噬 巨噬細胞與PM共培養1 h制備細胞爬片,滴加PAS固定液5 min,水洗待干,滴加PASI液10 min,水洗待干,滴加PASII液室溫避光孵育30 min,流水沖洗數分鐘,蘇木素復染1~2 min,水洗待干,光學顯微鏡下觀察分生孢子被吞噬情況。
1.2.5 H2DCFDA標記檢測巨噬細胞的ROS水平 分為3組,第1組:未加入分生孢子;第2組:加入未處理的分生孢子;第3組:加入預處理的分生孢子。PM分生孢子與RAW264.7細胞共培養2 h(菌與細胞比例5∶1),棄培養液, PBS洗3次, 每孔加入H2DCFDA 工作液(終濃度為5 μmol/L),37 ℃,5%CO2培養箱中避光孵育30 min,PBS洗2次,上機檢測熒光強度。
1.2.6 CFU檢測ACP對RAW264.7細胞殺傷P.marneffei分生孢子的影響 分組:①空白對照組;②酶抑制組;酶抑制組:將分生孢子置于含1 mmol/L正釩酸鈉的生理鹽水中37 ℃孵育4 h,空白對照組:未加入抑制劑在同等條件下孵育。PM分生孢子與RAW264.7細胞共培養2 h(菌與細胞比例5∶1), PBS洗去未被吞噬的PM,每孔以4 ℃預冷的無菌雙蒸水1 mL裂解細胞,倍比稀釋至1 000倍,取100 μL涂SDA平皿培養基,37℃溫箱培養2~3 d,菌落計數。每孔涂3個復培養皿,重復實驗3次
1.3 數據分析 所有數據采用SPSS13.0軟件進行統計處理,數據描述以平均值±標準差表示,組間比較采用t檢驗分析,P<0.05為差異有統計學意義。
2 結 果
2.1 H2O2對酶活性的影響PM菌絲相與酵母相均可以分泌ACP,在H2O2培養基中菌絲相與酵母相ACP活性均明顯提高,差異有統計學意義。說明氧化壓力可以促進PM分泌ACP(表1)。
2.2 共培養體系的建立 將巨噬細胞RAW264.7與PM共培養1 h后,用PAS染色在光學顯微鏡下觀察巨噬細胞的吞噬情況。在巨噬細胞的胞漿內可看到被PAS染成桃紅色的PM分生孢子。說明成功建立了共培養體系(圖1)。
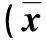
表1 H202對PM酸性磷酸酶活性的影響±s)
注:*與0 mmol/L比較,P<0.05
*P<0.05 compared with control group (0 mmol/L).
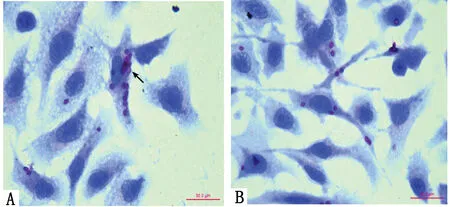
圖1PM與RAW264.7共培養,箭頭指示被吞噬的PM分生孢子(光鏡,1 000×)
Fig.1 PM conidia are phagocyticed by RAW264.7 after co-culture (original magnification×1 000), Bar=50 μm
2.3 流式細胞術檢測巨噬細胞內ROS水平 流式細胞術檢測巨噬細胞內ROS水平,結果顯示LPS、LPS+酶抑制分生孢子、 LPS+滅活分生孢子、LPS+酶誘導分生孢子組平均熒光強度分別為:167.5±20.43;434.0±14.72;509.0±22.30;41.14±12.36各組間差異有統計學意義(P<0.01)。LPS可以刺激巨噬細胞呼吸爆發釋放ROS(圖2B),加入經酸性磷酸酶誘導后的分生孢子ROS降低(圖2E),而將酶誘導的分生孢子用抑制劑處理或滅活后ROS升高(分別為圖2C、D),說明酸性磷酸酶可以抑制巨噬細胞ROS產生(圖2A為不加熒光的對照組),(圖2)。
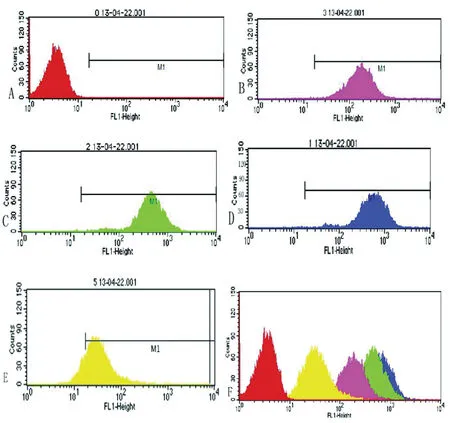
2.4 CFU檢測PM被巨噬細胞殺傷情況 不同酶活性PM與巨噬細胞共培養兩小時,CFU檢測分生孢子被殺傷情況。結果顯示,酶誘導分生孢子、酶抑制分生孢子組CFU分別為:1.68×104±0.15與0.61×104±0.15,兩者有統計學差異(P<0.001)。誘導酸性磷酸酶分泌可以使PM存活率提高,而該酶被抑制后PM存活率降低,說明酸性磷酸酶可以抵御巨噬細胞的殺傷作用(圖3)。
A:對照組;B:LPS;C:LPS+酶抑制分生孢子;D:LPS+滅活分生孢子; E:LPS+酶誘導分生孢子
Intracellular ROS generation was assayed by flow cytometry with the H2DCFA fluorescent prob.
A: control group; B: LPS; C: LPS+Enzyme inhibited conidia;D: LPS+Enzyme inactivated conidia; E: LPS+Enzyme activated conidia.
圖2 RAW264.7細胞與不同酶活性的PM共培養2 h后,細胞內ROS的釋放量
Fig.2 RAW 264.7 was co-cultured with PM conidia of different enzyme activity for 2 h
The survival of PM conidia were assayed by CFU.
圖3 RAW264.7細胞與不同酶活性的PM共培養2h后,PM的存活率
Fig.3 RAW 264.7 was co-cultured with PM conidia of different enzyme activity for 2 h
2.5 電鏡下觀察PM被巨噬細胞殺傷情況 不同酶活性PM與巨噬細胞共培養2 h,可見巨噬細胞表面有細長的突起將PM分生孢子捕獲及包繞。數量不等的分生孢子被內吞入細胞,存在于膜包裹的吞噬體內或游離于胞漿。共培養后酶誘導分生孢子形態結構未見明顯改變,可見到完整的細胞壁,胞內可見脂肪滴(圖4-1);而酸性磷酸酶被抑制的分生孢子可見形態改變,細胞壁與細胞膜分離、細胞皺縮,細胞壁與細胞內結構模糊,呈降解狀態(圖4-2)。提示酶抑制分生孢子抵御巨噬細胞殺傷能力較酶誘導分生孢子弱,進一步說明酸性磷酸酶可以抵御巨噬細胞的殺傷作用。
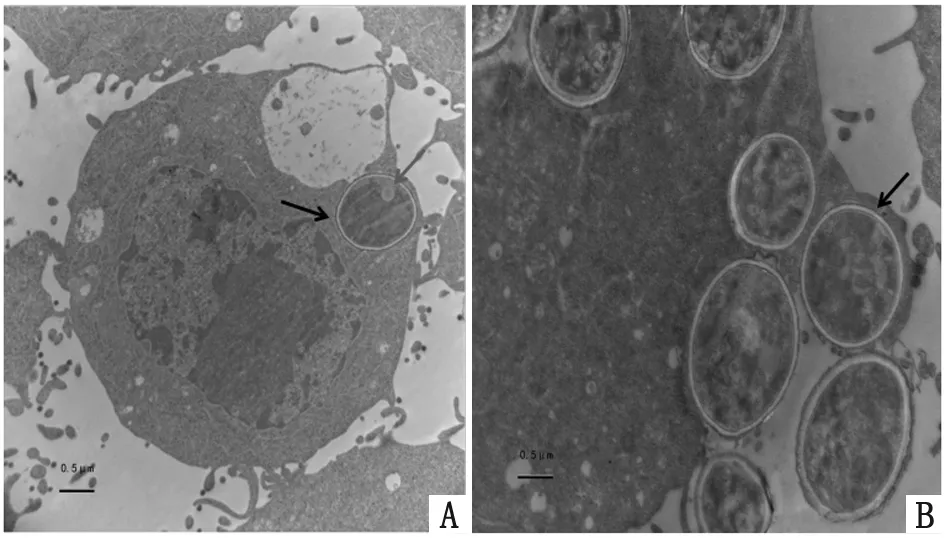
透射電鏡(20 000×)下觀察,可見完整的PM分生孢子(黑色箭頭所示),細胞內可見脂肪滴(紅色箭頭所示)
The morphology of intact conidia (black arrow) and intracellular lipid droplets were observed by TEM(20 000×)(red arrow)
透射電鏡(20 000×)下觀察,可見結構被破壞的PM分生孢子(黑色箭頭所示),細胞壁與細胞膜分離,細胞結構模糊,呈降解狀態
As shown by TEM (20 000×), the structure of conidia were damaged (black arrow), cell membranes were separated from cell walls, conidia appeared degraded with unclear cell shape.
圖4-1PM酶誘導分生孢子在巨噬細胞內生存情況
圖4-2PM酶抑制分生孢子在巨噬細胞內生存情況
Fig. 4-1 Survival of enzyme activated PM conidia in macrophage were observed by TEM
Fig. 4-2 Survival of enzyme inhibited PM conidia
3 討 論
馬爾尼菲青霉 (Penicilliummarneffei,PM)是青霉屬中唯一的溫度依賴性雙相真菌,屬于機會致病菌。近幾年隨著腫瘤化療、器官移植、艾滋病的流行免疫缺陷患者日益增多,馬爾尼菲青霉病發病率逐漸增加。該菌在室溫25℃培養時呈菌絲相,產生分生孢子;37 ℃培養或感染人體后呈酵母相,為致病相。PM分生孢子經呼吸道進入宿主體內后被巨噬細胞吞噬,當宿主免疫系統缺陷時PM不能被完全清除,可在巨噬細胞內以酵母細胞分裂增殖,并致全身播散。作為一種細胞內病原體,PM在巨噬細胞內存活并繁殖是其感染宿主的首要條件,被認為是其致病的關鍵[8-9]。既往研究表明,PM在宿主巨噬細胞內能夠通過調控異檸檬酸裂解酶(acuD)、銅鋅超氧化物歧化酶(sodA)、過氧化氫酶-過氧化物酶(cpeA)、熱休克蛋白70(hsp70)等的表達而抵御吞噬細胞的抗真菌活性,以利于其在宿主細胞內生存[9-12]。
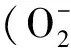
酸性磷酸酶(acidphosphatase,ACP)[16]是一類廣泛存在于微生物及動植物的水解酶,被認為是許多病原菌重要的毒力因子[2-3,5,7]。如結核分枝桿菌可分泌一種結構、性質與真菌相似的酸性磷酸酶[4],該酶可通過降低胞內pH值而減弱免疫細胞的氧化應激,敲除ACP調控基因結核分枝桿菌毒力下降[5,17]。弗朗西斯氏菌屬[2]、貝氏柯克斯體[3]等分泌的ACP可通過抑制ROS抵御宿主的氧化殺傷。Youngchim等[6]采用定性的方法發現PM也能分泌酸性磷酸酶,但其與PM致病性的關系尚未見文獻報道。
本研究在培養基中加入H2O2模擬體內氧化應激環境,通過定量的方法檢測培養上清液中ACP的活性,結果顯示H2O2能提高ACP的活性,提示氧化應激條件下可以刺激PM分泌ACP。將PM用ACP抑制劑預處理后與巨噬細胞共培養兩小時后檢測巨噬細胞內ROS的水平及其對PM的吞噬殺傷作用,研究結果發現ACP未被抑制時巨噬細胞內ROS水平較低,對菌體吞噬殺傷作用較弱;而ACP被抑制后,巨噬細胞ROS水平上升,對PM吞噬殺傷能力增強,提示巨噬細胞可以通過產生ROS殺傷菌體,而PM在巨噬細胞內可以通過分泌ACP抑制ROS的產生抵御巨噬細胞的殺傷作用。我們推測巨噬細胞吞噬PM后通過呼吸爆發產生大量活性氧族(ROS)等殺傷菌體,PM在宿主氧化應激環境下可分泌ACP等物質抑制ROS從而抵抗宿主的氧化殺傷;當宿主免疫力正常時,巨噬細胞的氧化系統和PM的抗氧化系統處于平衡狀態,病原體被殺死;相反,當人免疫缺陷時,PM抗殺傷機制占優勢則可引起馬爾尼菲青霉病。
我們的研究結果顯示,馬爾尼菲青霉在氧化應激條件下可分泌酸性磷酸酶,抑制該酶后巨噬細胞內ROS水平升高,對PM的吞噬作用增強,提示ACP可能通過抑制巨噬細胞活性氧族(ROS)產生抵御宿主的氧化殺傷從而參與PM的致病過程,具體的機制有待進一步研究闡明。
[1] Segretain G.Penicilliummarneffein.sp., agent of a mycosis of the reticuloendothelial system[J]. Mycopathologia, 1959, 11: 327-353.
[2]Dai S, Mohapatra NP, Schlesinger LS, et al. The acid phosphatase AcpA is secreted in vitro and in macrophages byFrancisellaspp[J]. Infect Immun, 2012, 80(3): 1088-1097.
[3]Baca OG, Roman MJ, Glew RH, et al. Acid phosphatase activity inCoxiellaburnetii: a possible virulence factor[J]. Infect Immun, 1993, 61(10): 4232-4239.
[4]Saleh MT, Belisle JT. Secretion of an acid phosphatase (SapM) byMycobacteriumtuberculosisthat is similar to eukaryotic acid phosphatases[J]. J Bacteriol, 2000, 182(23): 6850-6853.
[5]Saikolappan S, Estrella J, Sasindran SJ, et al. The fbpA/sapM double knock out strain ofMycobacteriumtuberculosisis highly attenuated and immunogenic in macrophages[J]. PLoS One, 2012, 7(5): e36198.
[6]Youngchim S, Vanittanakom N, Hamilton AJ. Analysis of the enzymatic activity of mycelial and yeast phases ofPenicilliummarneffei[J]. Med Mycol, 1999, 37(6): 445-450.
[7]Kneipp LF, Magalhaes AS, Abi-Chacra EA, et al. Surface phosphatase inRhinocladiellaaquaspersa: biochemical properties and its involvement with adhesion[J]. Med Mycol, 2012, 50(6): 570-578.
[8]Liu H, Xi L, Zhang J, et al. Identifying differentially expressed genes in the dimorphic fungusPenicilliummarneffeiby suppression subtractive hybridization[J]. FEMS Microbiol Lett, 2007, 270(1): 97-103.
[9]Cooper CR, Vanittanakom N. Insights into the pathogenicity ofPenicilliummarneffei[J]. Future Microbiol, 2008, 3(1): 43-55.
[10]Kummasook A, Pongpom P, Vanittanakom N. Cloning, characterization and differential expression of an hsp70 gene from the pathogenic dimorphic fungus,Penicilliummarneffei[J]. DNA Seq, 2007, 18(5): 385-394.
[11]Pongpom P, Cooper CJ, Vanittanakom N. Isolation and characterization of a catalase-peroxidase gene from the pathogenic fungus,Penicilliummarneffei[J]. Med Mycol, 2005, 43(5): 403-411.
[12]Thirach S, Cooper CJ, Vanittanakom P, et al. The copper, zinc superoxide dismutase gene ofPenicilliummarneffei: cloning, characterization, and differential expression during phase transition and macrophage infection[J]. Med Mycol, 2007, 45(5): 409-417.
[13]Ray PD, Huang BW, Tsuji Y. Reactive oxygen species (ROS) homeostasis and redox regulation in cellular signaling[J]. Cell Signal, 2012, 24(5): 981-990.
[14]Zou J, Feng D, Ling WH, et al. Lycopene suppresses proinflammatory response in lipopolysaccharide-stimulated macrophages by inhibiting ROS-induced trafficking of TLR4 to lipid raft-like domains[J]. J Nutr Biochem, 2013, 24(6): 1117-1122.
[15]Ichikawa S, Miyake M, Fujii R, et al. MyD88 associated ROS generation is crucial for Lactobacillus induced IL-12 production in macrophage[J]. PLoS One, 2012, 7(4): e35880.
[16]Anand A, Srivastava PK. A molecular description of acid phosphatase[J]. Appl Biochem Biotechnol, 2012, 167(8): 2174-2197.
[17]Festjens N, Bogaert P, Batni A, et al. Disruption of the SapM locus in Mycobacterium bovis BCG improves its protective efficacy as a vaccine against M. tuberculosis[J]. EMBO Mol Med, 2011, 3(4): 222-234.
Zhang Jun-min, Email: junminmx@163.com
Role of acid phosphatase ofPenicilliummarneffeiin the host oxidative damage
HUANG Xiao,ZHANG Jun-min,JIANG Li,WANG Li,LU Sha,CAI Wen-ying
(DepartmentofDermatology,SunYat-senMemorialHospital,SunYat-senUniversity,Guangzhou510120,China)
We investigated the role of acid phosphatase ofPenicilliummarneffeiin the host oxidative damage.Penicilliummarneffeiwere inoculated in liquid medium containing H2O2at 37 ℃ or 25 ℃. Cell-free supernatants were tested for acid phosphatase activity and enzymatic properties. After pretreated with acid phosphatase inhibitor,Penicilliummarneffeiconidia were cultivated with macrophages. The levels of ROS generated by macrophages were determined by flow cytometry with the H2DCFA fluorescent prob. The activities of livingPenicilliummarneffeiin the cells were observed by electron microscopy. CFU was used to evaluate the influence of acid phosphatase on the sterilization ability of macrophages. Results showed that both mycelial and yeast phases ofPenicilliummarneffeiexpressed acid phosphatase activity. Enzyme activity was improved after exposed to H2O2. After acid phosphatase was inhibited, the amount of ROS was increased comparing with the control group. The capacity of macrophages for phagocytizing and sterilizing conidia was enhanced. It’s suggested that acid phosphatase can preventPenicilliummarneffeifrom oxidative damage by inhibiting the levels of ROS.
Penicilliummarneffei; acid phosphatase; macrophage; oxidative damage; ROS
10.3969/j.issn.1002-2694.2015.09.007
廣東省自然科學基金資助(No.S2013010015189)
張軍民,Email:junminmx@163.com
中山大學孫逸仙紀念醫院皮膚科,廣州 510120
Supported by the fund of Natural Science Foundation of Guangdong Province (No. S2013010015189)
R379
A
1002-2694(2015)09-0817-05
2015-03-11;
2015-07-17

