福建東南沿海某戰區醫院MRSA感染特點及基因多態性分型研究
魏智藝,程君濤,李小毅,劉丁井
?
·論著·
福建東南沿海某戰區醫院MRSA感染特點及基因多態性分型研究
魏智藝,程君濤,李小毅,劉丁井
目的 了解福建東南沿海某戰區醫院MRSA感染特點及基因多態性分型情況,為制定院內MRSA感染的防治策略提供分子生物學依據。方法 采用頭孢西丁試紙片法初步鑒定MRSA菌株,聚合酶鏈反應(PCR)技術檢測MecA基因,最終鑒定臨床送檢標本所檢測出的MRSA菌株,并通過隨機引物DNA擴增技術(RAPD)對所檢測的MRSA菌株進行基因分型研究。結果 經PCR對MecA基因檢測,從臨床標本及醫護人員身上共分離出42株MRSA菌株。采用隨機引物DNA擴增技術(RAPD)對細菌進行基因分型,根據同源性分析,42株臨床菌株共可以分為12型。其中Ⅰ型共7株,Ⅱ型共2株,Ⅲ型共4株,Ⅳ型共4株,Ⅴ型共7株,Ⅵ、Ⅶ及Ⅷ各1株,Ⅸ型共8株,Ⅹ型共2株,Ⅺ型共3株,Ⅻ型共2株。結論 本院MRSA菌株存在相似度大小不同的遺傳距離,醫院內存在交叉感染可能。
耐甲氧西林金黃色葡萄球菌;院內感染;PCR;RAPD;聚類分析
近年來,院內感染中多重耐藥細菌感染有不斷增多趨勢,尤其是耐甲氧西林金黃色葡萄球菌(MRSA)感染,給嚴重燒傷、創傷及其他危重病患者的治療帶來嚴峻挑戰。雖然目前國內外對MRSA感染已有較多研究,但由于MRSA細菌基因具有多態性,不同地區醫院的MRSA基因分型和傳播特點也不盡相同。目前對福建東南沿海戰區醫院內MRSA細菌感染特點及基因多態性分型研究較少,給治療、預防帶來巨大困難,是當前為控制院內感染、提高本戰區創傷、燒傷的救治率,降低感染死亡率所迫切需要解決的一道難題。現將某戰區醫院內MRSA的研究報告如下。
1 材料與方法
1.1 標本采集 細菌標本采集自2011—2013年本院臨床科室住院患者送檢的痰液、創面分泌物、血液、靜脈導管尖端,以及陪護人員、醫務工作者的雙手、鼻腔前庭等部位。
1.2 主要材料 頭孢西丁紙片及藥敏實驗所用抗菌藥物:青霉素、苯唑西林、氨芐西林、莫西沙星、左氧氟沙星、頭孢唑林、哌拉西林/他唑巴坦、紅霉素、四環素、利福平、慶大霉素、復方新諾明、克林霉素(均為上海杰瑞絲生物公司產品)、利奈唑胺、替考拉寧、萬古霉素(大連醫諾生物有限公司產品)。Biospin細菌基因組DNA提取試劑盒(含蛋白酶K)(上海泛科實業有限公司產品),Premix溶液(包含Ex Taq、dNTP Mixture Ex等)、DNA Marker(大連TaKaRa公司產品),溶菌酶(上海泛科實業有限公司產品),瓊脂糖(南京森貝伽生物公司產品),TAE緩沖液(上海迪申生物公司產品),核酸染料(溴乙啶)(上海振宇化工科技公司產品),無水乙醇。
1.3 主要儀器 細菌接種環、無菌接種臺、酒精燈、CO2細菌孵育箱(德國Heraeus)、VIKET-2細菌鑒定儀(梅里埃),顯微鏡(OLYMPUS BX53)、移液管、電子比濁儀(HNTD5-TDR-1002)、漩渦混勻器(XK80-A型)、低溫冰箱(panasonic)。PCR擴增儀(德國Eppendorf公司)、電泳儀、電泳槽、凝膠成像系統、高速離心機、分光光度計、各種量程的微量移液槍。
1.4 引物設計 根據文獻[1]設計MecA引物,P1:5′-AAAATCGATGGTAAAGGTTGGC-3′,P2:5′-AGTTCTGCAGTACCGGATTTGC-3′。根據文獻[2]設計RAPD引物,EricⅡ:5′-AAGTAAGTGACTGGGGGTGAGCG-3′。以上引物均由福州貝克曼生物有限公司合成。
1.5 實驗方法及操作流程 收集臨床送檢標本,并進行細菌分離、培養。同時收集醫護人員的定植細菌。使用VIKET-2細菌鑒定儀鑒定被測細菌,并進行藥敏實驗,了解細菌對16種抗生素的耐藥情況。藥敏實驗采用微量肉湯稀釋法。
1.5.1 細菌DNA的提取:嚴格按照Biospin細菌基因組DNA提取試劑盒的說明書進行。
1.5.2 頭孢西丁試紙片法鑒定MRSA菌株:根據臨床實驗室標準化協會(CLSI)制定的標準判斷結果[3],凡頭孢西丁抑菌環直徑≤19 mm的即表示金黃色葡萄球菌對頭孢西丁耐藥,可初步判定為MRSA菌株。細菌鑒定和藥敏實驗使用VIKET-2細菌鑒定儀。
1.5.3 MecA基因PCR擴增體系及條件:反應體系為20 μl,其中DNA模板2 μl,PCR master 10 μl,引物各1.0 μl,最后用滅菌雙蒸水補足20 μl。反應參數:94℃預變性5 min;94℃變性30 s,55℃退火30 s,72℃延伸60 s,共35個循環;最后72℃延伸5 min,反應結束。取擴增產物5 μl在電壓120 V,1.5%瓊脂糖凝膠電泳40 min,以DNA標志物(DNA Marker)作為參照,凝膠成像系統照相,使用凝膠成像儀觀察結果并保存。
1.5.4 RAPD-PCR基因擴增:對MecA基因PCR擴增均陽性的MRSA菌株基因進行擴增并進行分型。RAPD反應體系為20 μl反應體系,其中待測DNA模板2 μl,PCR master 10 μl,Mg2+濃度2.0 mmol/L,引物各1.5 μl,最后用滅菌雙蒸水補足20 μl。擴增條件:94℃預變性5 min;94℃變性60 s,25℃退火60 s,72℃延伸120 s,共40個循環;最后72℃延伸5 min,反應結束。取擴增產物5 μl在電壓120 V,1.5%瓊脂糖凝膠電泳40 min,以DNA標志物(DNA Marker)作為參照,凝膠成像系統照相,使用凝膠成像儀觀察結果并保存。
2 結果
2.1 本院院內感染情況 本院檢驗科及感染控制科協助調查并統計院內感染情況,結果顯示,2011—2013年期間院內感染率為6.4%,其中呼吸道感染占50.3%(以下呼吸道感染為多見),創面感染占13.1%,其他感染部位還包括手術切口、胃腸道、泌尿生殖道等。院內感染仍以革蘭氏陰性桿菌為主,占64.5%,而革蘭陽性球菌占33.7%,存在小部分真菌感染,其中革蘭氏陽性球菌較前有上升的趨勢。在革蘭氏陽性球菌感染中,最主要的是金黃色葡萄球菌感染,且絕大部分金黃色葡萄球菌對抗菌藥呈不同程度的耐藥。本實驗所檢測出的MRSA占所有金黃色葡萄球菌的38.9%。
2.2 MecA基因檢測結果 通過PCR對使用頭孢西丁試紙片初步篩查所得的MRSA菌株進行MecA基因檢測。其中42株具有MecA電泳條帶(533 bp),被確定為MRSA,其余菌株由于無MecA電泳條帶而被排除,見圖1、2。
2.3 本院各臨床科室MRSA菌株檢出分布情況 本院各臨床科室共檢出MRSA菌株42株,其中神經外科檢出MRSA菌株12株(28.57%);燒傷整形科檢出10株(23.81%),呼吸內科檢出6株(14.29%),重癥醫學病房檢出5株(11.91%),胸外科、骨科分別檢出2株(4.76%),心內科、腫瘤內科分別檢出1株(2.38%),陪護及醫務人員檢出3株(7.14%)。42株MRSA菌株標本來自痰液18株(42.86%),創面分泌物10株(23.81%),血液6株(14.29%),導管尖端5株(11.90%),陪護人員鼻腔2株(4.76%),醫務人員手部1株(2.38%)。
2.4 MRSA菌株的藥敏實驗結果 所有檢測到的42株MRSA菌株對利奈唑胺、替考拉寧以及萬古霉素均敏感;對青霉素、苯唑西林、氨芐西林、頭孢唑林、哌拉西林/他唑巴坦均耐藥;而對復方新諾明、紅霉素、四環素、慶大霉素、克林霉素、左氧氟沙星、莫西沙星、利福平的耐藥率分別為:92.9%、92.9%、88.1%、88.1%、85.7%、76.2%、64.3%、61.9%,見表1。
2.5 RAPD基因多態性分型 經PCR檢測MecA基因鑒定后得到的42株MRSA菌株,經RAPD隨機擴增DNA片段,每株菌株均擴增出3~7條不等的電泳條帶,見圖3。使用Cross Checker V2.91和NTSYSpc V2.10e圖像分析、遺傳圖譜聚類分析軟件,對RAPD隨機擴增出的細菌DNA條帶進行聚類分析。根據條帶數目的不同,42株菌株可分為Ⅰ~Ⅻ共12型,其中Ⅰ型共7株,Ⅱ型共2株,Ⅲ型共4株,Ⅳ型共4株,Ⅴ型共7株,Ⅵ、Ⅶ及Ⅷ各1株,Ⅸ型共8株,Ⅹ型共2株,Ⅺ型共3株,Ⅻ型共2株,見圖4。
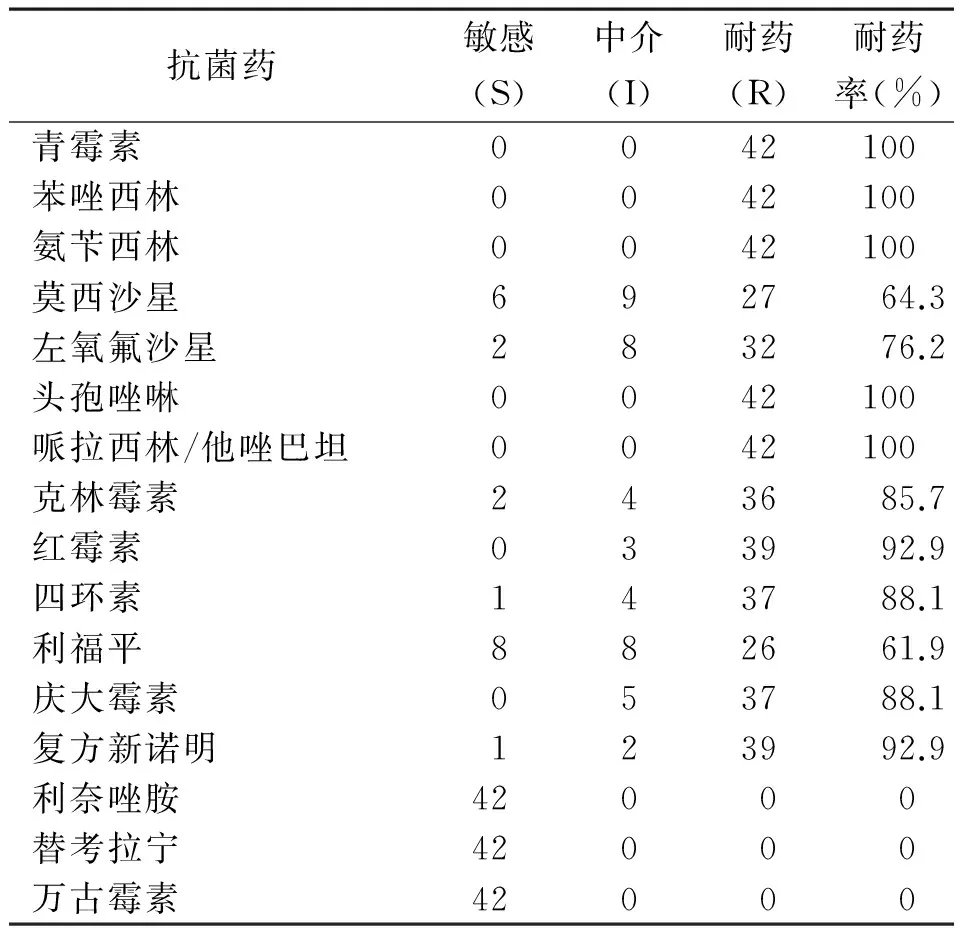
表1 42株MRSA菌株對16種常用抗菌藥的藥敏實驗結果

圖1 部分標本DNA抽提后行聚合酶鏈反應 MecA基因檢測結果
無電泳條帶標本為MecA陰性,M為DNA Marker
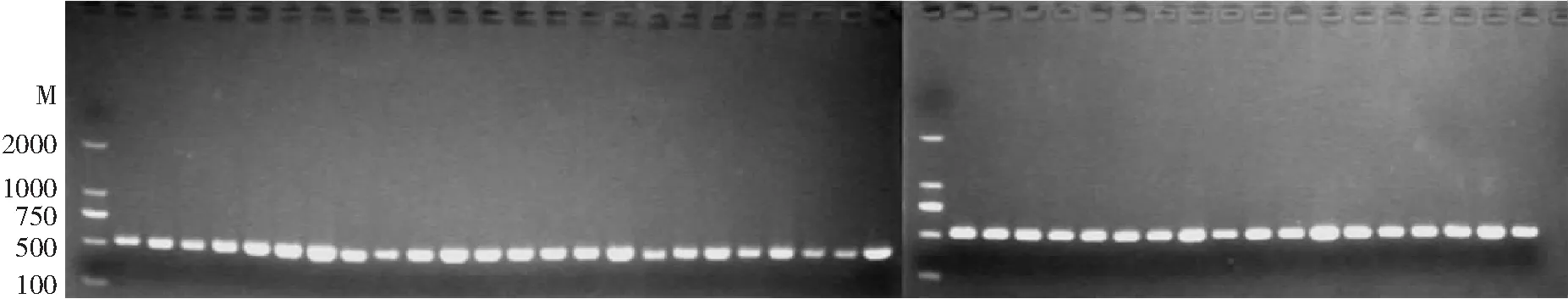
圖2 42株臨床MRSA菌株MecA陽性基因電泳圖譜
M為DNA-Marker
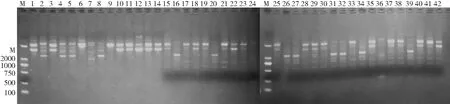
圖3 42株MRSA DNA抽提后行RAPD 基因擴增聚合酶鏈反應電泳圖譜
M為DNA Marker,1-42為菌株編號
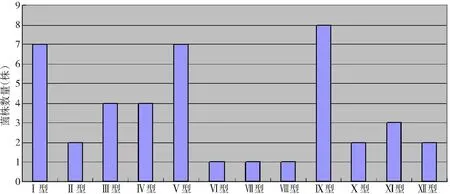
圖4 42株MRSA RAPD基因分型情況
各科室送檢MRSA菌株基因型的分布情況,其中神經外科主要以Ⅰ型及Ⅸ型為主,7株Ⅰ型,3株Ⅸ型;而燒傷整形科則以V型多見,共6株,同時檢測出3株Ⅲ型細菌;ICU病區分離出的MRSA菌株的型別則分離出4株Ⅳ型菌株;呼吸內科送檢5株MRSA菌株,包括4株Ⅸ型以及1株Ⅵ型。從神經外科患者家屬的鼻腔分離到的2株MRSA菌株,通過RAPD隨機擴增其DNA的多態性,經聚類分析,最后鑒定這2株菌株均為Ⅰ型;而ICU護士的手分離到的MRSA則為Ⅳ型,見圖5。
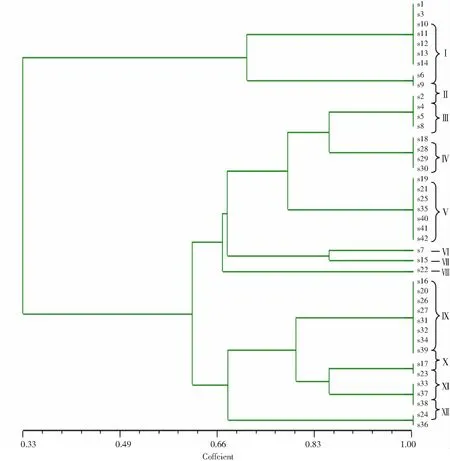
圖5 42株MRSA的基因圖譜遺傳距離樹狀圖
Coffcient為相關系數,S1-S42為菌株編號,Ⅰ~Ⅻ為基因分型
3 討論
大量研究資料表明MRSA在世界范圍內感染率呈逐年上升趨勢,是目前公認的院內感染的高危病原菌之一[4]。文獻報道,我國每年院內感染中MRSA感染占5%~10%。本次實驗共收集MRSA菌株42株,占我院院內感染的7.4%。從送檢標本上看,大部分以痰液及創面分泌物為主,與國內各地區及醫院的報道相一致[5]。MRSA菌株主要通過空氣傳播,MRSA菌株容易在呼吸道定植,特別是下呼吸道。此外,我們也發現,創面分泌物中MRSA的檢出率也較高,這些標本大部分來源于燒傷科,特別是大面積深度燒傷的危重患者,住院時間較長,長期、大量應用抗菌藥物進行抗感染治療。皮膚作為人體天然的保護屏障,皮膚燒傷、受損后極容易引起細菌的定植與感染[6]。對于燒傷患者應加強創面處理及保護,預防創面膿毒癥的出現。同時應提高對創面分泌物細菌培養的送檢率,對定植細菌進行動態觀察,做到早期預防、早期干預,可有效預防創面MRSA感染。
MRSA之所以對抗生素具有高度免疫性,是由于其耐藥機制的復雜多樣化決定的,其中通過MecA基因介導編碼產生PBP2a,是其最主要也是最重要的耐藥機制[7]。MecA基因編碼產生青霉素結合蛋白-PBP2a與β-內酰胺類抗生素的親和力低,從而導致抗菌藥物對細菌抑制能力大大下降,出現耐藥。據文獻報道,使用頭孢西丁紙片檢測、鑒定MRSA存在一定的誤差。MecA基因作為MRSA特有的耐藥基因,通過PCR技術檢測金黃色葡萄球菌的MecA基因已作為鑒定MRSA的金標準[8]。本次實驗首先使用頭孢西丁紙片進行篩查,最終通過PCR檢測菌株的MecA基因來鑒定MRSA菌株。實驗過程中我們發現單獨使用頭孢西丁紙片鑒定MRSA菌株,存在假陽性率。并且使用頭孢西丁紙片篩查MRSA菌株具有操作繁瑣、耗時長、消耗了大量的人力成本等問題。如進行大樣本的檢測,建議首選使用PCR技術直接檢測其MecA基因,特別是醫院內發生可疑的MRSA暴發流行時,可以為制定防治策略節省寶貴的時間。為了解細菌的耐藥機制,目前對院內病原菌進行分型更多的是通過細菌自身基因進行分型,隨著分子生物學的發展,目前基因分型的方法較多。20世紀90年代初人們開始利用RAPD技術來檢測DNA的多態性,其原理就是使用隨機引物,通過PCR技術對所研究的DNA進行隨機擴增,通過對所得到的不同電泳條帶進行分析,進而研究其是否存在同源性[9]。本實驗利用RAPD技術對篩查出的MRSA菌株進行檢測,分析其是否存在同源性。從電泳指紋圖譜的結果上看,大多數菌株的DNA可擴增出4~7個條帶。應用生物醫學軟件,對DNA擴增所得的條帶進行系統的同源聚類分析,42株臨床菌株共歸類為12個基因型,其中Ⅰ型、Ⅴ型及Ⅸ為我院主要的優勢菌株。本次實驗未發現我院某種細菌型在院內廣泛傳播,這與有關院內MRSA感染的流行菌株型較單一的報道存在一定的差異,這可能與本次實驗樣本量較小有關。同時本次實驗也發現各個科室的流行菌株較為集中。如神經外科以Ⅰ型為主,燒傷整形科以V型多見,而ICU病區分離出的MRSA菌株大部分為Ⅳ型。呼吸內科主要為Ⅸ型。某種程度上驗證了相關機構的研究結果。有研究顯示,患者感染的MRSA與其病房環境中分離出的MRSA菌株具有高度同源性[10]。本實驗發現,神經外科、燒傷整形科、呼吸內科、ICU等科室MRSA的檢出率較高,同時分別從神經外科患者家屬的鼻前庭以及ICU護士的手部分離出MRSA菌株,從基因型上看,其與該科室流行菌株具有高度的同源性。這進一步說明了醫院內病區之間、科室之間、患者之間以及醫護人員與患者之間可能存在相互傳播及交叉感染。
MRSA菌株在人體最常見的定植部位是皮膚和鼻前庭部,臨床上可使用鼻拭子定期采集檢測患者鼻腔定植菌的情況,特別是長時間住院患者。一旦發現攜帶MRSA菌株,應增強標本的送檢次數,密切觀察病情變化,盡可能做到單間隔離或者同種病原菌入住同一病房,以防交叉感染[11-13]。
[1] Weidner J, Cassens U, G?hde W. A new triplex real time PCR which distinguishes between MRSA,MSSA,and MecA coagulase negative strains by means of melting point analysis using SYTO9[J].Clin Lab, 2013,59(7-8):795-804.
[2] Kurlenda J, Grinholc M, Jasek K,etal. RAPD typing of methicillin-resistant Staphylococcus aureus: a 7-year experience in a Polish hospital[J].Med Sci Monit, 2007,13(6):13-18.
[3] Oksuz L, Gurler N. Susceptibility of clinical methicillin-resistant Staphylococci isolates to new antibiotics[J].J Infect Dev Ctries, 2013,7(11):825-831.
[4] Wagener J, Seybold U. MRSA-hygiene management, diagnostics and treatment[J].Dtsch Med Wochenschr, 2014,139(13):643-651.
[5] 王斌,史友權,司怡然,等.耐甲氧西林金黃色葡萄球菌流行病學特征的研究進展[J].大連醫科大學學報,2013,35(2):183-187.
[6] Warner P, Neely A, Bailey J K,etal. Methicillin-resistant Staphylococcus aureus furunculitis in the outpatient burn setting[J].J Burn Care Res, 2009,30(4):657-660.
[7] Titécat M, Lo?ez C, Senneville E,etal. Evaluation of rapid MecAgene detection versus standard culture in staphylococcal chronic prosthetic joint infections[J].Diagn Microbiol Infect Dis, 2012,73(4):318-321.
[8] Coban A Y. Rapid determination of methicillin resistance among Staphylococcusaureus clinical isolates by colorimetric methods[J].J Clin Microbiol, 2012,50(7):2191-2193.
[9] Vázquez S D, López C M, Saá I P,etal. Incidence and characterization of Staphylococcus aureus in fishery products marketed in Galicia (Northwest Spain)[J].Int J Food Microbiol, 2012,157(2):286-296.
[10]韓黎,常東,孟玉芬,等.燒傷病房內MRSA傳播途徑的IRS-PCR分析[J].軍醫進修學院學報,2006,27(5):352-354.
[11]Moore G, Ali S, FitzGerald G,etal. Ward assessment of SmartIdeas Project: bringing source isolation to the patient[J].J Hosp Infect, 2010,76(2):103-107.
[12]曾釗宇,張宇,鐘劍文,等. MRSA和MSSA的藥敏結果比較和MRSA檢出率變化趨勢[J].中國當代醫藥,2012,19(12):66-67.
[13]韋秀平,邵麗麗.醫院獲得性MRSA下呼吸道感染42例分析[J].首都醫科大學學報,2000,21(2):120-121.
A Study on Characteristics and Genetic Polymorphisms of MRSA Infection in a PLA Hospital in Southeast Coastal Region of Fujian Province
WEI Zhi-yi, CHENG Jun-tao, LI Xiao-yi, LIU Ding-jing
(Department of Burns and Plastic Surgery, 180 Hospital of the PLA, Quanzhou, Fujian 362000, China)
Objective To study the characteristics and genetic polymorphisms of methicillin resistant staphylococcus aureus (MRSA) infection in a PLA hospital in southeast coastal region of Fujian Province, and to provide the molecular biological basis for prevention and control strategies of nosocomial MRSA infection. Methods MRSA strains were initially detected using Cefoxitin indicator paper, and MecA genes were detected using polymerase chain reaction (PCR) technology, MRSA strains detected from clinical samples were identified, and then genotyping of detected MRSA strains were studied using synthetic primer and random amplification of polymorphic DNA technique(RAPD). Results The MecA genes after PCR detection showed that 42 strains of MRSA strains were isolated from clinical specimens and the medical staff. The MRSA genotypes were differentiated with RAPD technology, and homologous analysis categorized 42 clinical MRSA strains into 12 genotypes, in which 7 strains of Type I, 2 of Type II, 4 of Type III, 4 of Type IV, 7 of Type V, 1 of Type VI, 1 of Type VII, 1 of Type VIII, 8 of Type IX, 2 of Type X, 3 of Type XI and 2 of Type XII. Conclusion MRSA strains have genetic distances of different sizes of similarity in our hospital, therefore nosocomial cross infection is possible.
Methicillin-resistant staphylococcus aureus; Nosocomial infection; Polymerase chain reaction; Random amplification of polymorphic DNA technique; Cluster analysis
南京軍區“十一五”醫藥衛生基金支持項目(10MA080)
362000 福建 泉州,解放軍180醫院燒傷整形外科
程君濤,E-mail:c5481@sina.com
R632
A
2095-140X(2015)03-0079-06
10.3969/j.issn.2095-140X.2015.03.020
2014-09-14 修回時間:2014-11-30)

