SiRNA干擾慢性炎性痛大鼠患側背根神經節MrgC表達及PKCε磷酸化的研究
林小溪,方 芳,方劍喬,劉盈君
(浙江中醫藥大學第三臨床醫學院,杭州 310053)
SiRNA干擾慢性炎性痛大鼠患側背根神經節MrgC表達及PKCε磷酸化的研究
林小溪,方 芳,方劍喬,劉盈君
(浙江中醫藥大學第三臨床醫學院,杭州 310053)
目的 觀察鞘內注射小干擾 RNA(small interference RNA,siRNA)對完全弗氏佐劑(complete freund’s adjuvant,CFA)誘導的慢性炎性痛大鼠患側背根神經節(dorsal root ganglion,DRG)中MrgC(Mas-related G protein-coupled receptor C,MrgC)mRNA與蛋白表達的干擾作用,并觀察該作用對大鼠患足痛閾及患側DRG PKCε絲氨酸729點位磷酸化 (phosphorylation of PKCε Ser729,p-PKCε Ser729)水平的影響。方法健康雄性 SD (Sprague-Dawley,SD)大鼠16只,隨機分為對照siRNA組,MrgC siRNA組,每組8只。大鼠脊髓鞘內插管成功后,兩組大鼠給予相應藥物鞘內注射4 d,1次/d,5 μg/d/只。給藥第4 d,大鼠右后足底注射CFA 0.1 mL建立慢性炎性痛模型,此后隔日注射藥物,直至給藥第11 d處死。分別于鞘內置管前、給藥前、給藥4 d(CFA造模0 h)、給藥5 d (CFA造模24 h)、給藥11 d(CFA造模7 d)5個時點檢測大鼠患足機械縮腿閾(Paw withdrawal thresholds,PWTs)的變化。熒光定量PCR法檢測患側DRG MrgC的mRNA的表達,免疫熒光法檢測患側DRG MrgC表達量及p-PKCε Ser729的含量。結果 與給藥4 d比較,給藥5 d兩組大鼠的PWTs均有顯著的下降(P<0.01);給藥前后各時點,兩組大鼠之間PWTs沒有明顯差異。觀察給藥11d時大鼠患側L4-L6 DRG MrgC mRNA的表達,與對照siRNA組比較,MrgC siRNA組各神經節MrgC mRNA的表達均明顯下降(P<0.01);觀察大鼠給藥11d時大鼠患側L4-L6 DRG MrgC與p-PKCε Ser729的表達,與對照siRNA組比較,MrgC siRNA組患側DRG的MrgC陽性細胞率明顯減少(P<0.01),而p-PKCε Ser729的陽性細胞率顯著上升(P<0.05)。結論 MrgC siRNA片段可有效干擾CFA慢性炎性痛大鼠患側L4-L6 DRG MrgC mRNA與MrgC的表達,對MrgC的干擾作用能顯著上調PKCε Ser729磷酸化的水平,但不影響大鼠患足機械縮腿閾。
小干擾RNA;MrgC;蛋白激酶C ε亞基Ser729磷酸化;慢性炎性痛;背根神經節
慢性炎性疼痛廣泛地存在于各種疾病的進程中,目前抑制疼痛的藥物阿片受體激動劑嗎啡與炎性介質抑制劑的臨床療效都不佳,而慢性疼痛相關的外周細胞與分子功能研究成為鎮痛研究的重要方向。
2001年發現的 MrgC(Mas-related G proteincoupled receptor C,MrgC)是一種新型的G蛋白偶聯受體,其基因僅在外周神經系統中與痛覺調制有密切聯系的背根神經節(dorsal root ganglion,DRG)和三叉神經節的中小型感覺神經元高度表達[1-2]。研究證實MrgC參與慢性炎癥引發的外周痛覺過敏的調制,但其機制遠未闡明,且目前尚未有MrgC特異性抑制劑供進一步深入研究。
細胞內信號轉導分子蛋白激酶C(protein kinase C,PKC)是一種絲氨酸/蘇氨酸激酶[3]。其亞基PKCε在慢性疼痛外周痛覺敏化的形成中起著關鍵性作用[4]。PKCε磷酸化是其功能被激活的重要標志[2,5]。研究表明MrgC的調制作用與PKC密切相關[6],因此本實驗擬建立完全弗氏佐劑(complete freund’s adjuvant,CFA)慢性炎性痛模型,鞘內注射MrgC小干擾RNA(small interference RNA,siRNA),觀察該片段對大鼠患側L4-L6 DRG MrgC mRNA和受體表達的沉默作用及其對PKCε絲氨酸729點位磷酸化(phosphorylation of PKCε Ser729,p-PKCε Ser729)水平和機械痛的影響,為后續MrgC生理藥理功能的深入研究打下基礎。
1 材料和方法
1.1 實驗動物
選用清潔級健康雄性SD大鼠16只,體重280~300 g,購自上海斯萊克實驗動物有限公司【SCXK (滬)2013-0016】,由浙江中醫藥大學實驗動物中心飼養【SYXK(浙)2013-0184】,飼養期間給予嚙齒動物標準顆粒飼料及自由飲水,12 h循環燈光,室溫23±2℃。
1.2 主要實驗試劑和儀器
MrgC抗體(批號:0121212030827,美國Abnova有限公司);CFA(批號:051M8725,美國 Sigma公司);山羊血清封閉液(批次:140214;BIOSS公司);多聚賴氨酸處理載玻片(南通天盛實驗器材有限公司);MrgC siRNA與對照 siRNA(批號:3360;life technologies公 司);Goatanti-rabbitIgG(批 號: A120101F13;美國 Abnova有限公司);Anti-PKCε (phospho S729)antibody(批號F1510;美國Abnova有限公司);抗熒光淬滅 PVP封片液(產品編號: p0128;碧云天生物技術研究所);Trizol:(批號: 28218;life technologies公司)逆轉錄試劑盒(批號: RR047A,大連寶生物公司);PCR試劑盒(批號: 1725201AP;美國Bio-Rad公司)。其他試劑均為國產分析純。
Thermo冰凍切片機(型號:HM550,美國Thermo Scientific公司);激光共聚焦顯微鏡(型號: AIR;日本尼康公司);紫外分光光度計(型號: smartspecTMplus,BIO-RAD公司);熒光定量PCR儀(型號:CFX96TMReal-Time system,BIO-RAD公司);逆轉錄儀(S1000TMThermal cycler,BIO-RAD公司); PE導管(型號:PE-10,OD 0.5 mm,ID 0.25 mm;公司:寧波市科技園區安來軟件科技有限公司)。
1.3 實驗動物模型制備
1.3.1 脊髓鞘內置管模型[7-10]
大鼠禁食1 d后,水合氯醛350 mg/kg麻醉,剃除腰背部鼠毛,酒精消毒,切開皮膚,分離肌肉,暴露L5棘突,用咬骨鉗扳掉棘突,將PE-10聚乙烯管插入脊髓蛛網膜下腔,從L5向L2緩緩進管約3.5 cm。見有腦脊液流出后,即封住外口,縫合肌肉和皮膚,并將PE-10管固定于淺層肌肉上。術后恢復3 d后,鞘內給予10 μL鹽酸利多卡因,選取在30 s內雙下肢癱瘓,5~10 min內恢復正常的大鼠進行后續試驗。
1.3.2 CFA慢性炎性痛模型
從大鼠右后足墊部向踝關節方向注入 CFA (0.1 mL/只),4 h后注射關節局部出現炎癥反應,并出現痛覺過敏,大鼠致炎關節腫脹疼痛可持續4周以上[11]。
1.4 實驗動物分組與處理
1.4.1 實驗動物分組
大鼠行鞘內置管術后恢復5 d,檢測大鼠患側足縮腿閾,隨機分為兩組,對照 siRNA組和 MrgC siRNA組,每組8只。
1.4.2 藥物配制與實驗動物處理
1.4.2.1 藥物配制
MrgC siRNA序列為[12]5'-CAUGUCAGCUAU UAUAUGUt-ps-t-3'和 3'-t-ps-t GUACAGUCGAUAA UAUACA-5';錯 位 對 照 siRNA 序 列 為 5' CAAGUUAUC UAGUAAUUAUa-ps-t-3和 3'-t-ps-a GUU CAA UAG AUC AUU AAU A-5'。序列中的“t”代表2-O-甲基尿嘧啶核苷;“a”代表2'-O-甲基腺嘌呤;“ps”代表硫代磷酸鍵。均為life technologies公司制備。將siRNA 50 μg加入DEPC水43.3 μL配置成100 μm siRNA溶液,將siRNA加入216.5 μL的I-fectTM轉染試劑中,用槍頭輕輕攪拌,使之均勻,在室溫放置5 min,使siRNA和轉染試劑充分反應成有效的轉染試劑siRNA復合物。
1.4.2.2 實驗動物處理
兩組大鼠CFA造模前分別給予4 d不同藥物:對照siRNA組給予對照siRNA和MrgC siRNA組給予MrgC siRNA,第4天藥后CFA造模,造模后隔日注射相應藥物3次,劑量均為5 μg/d/10μL。
于鞘內置管前、給藥前、給藥4 d(CFA造模0 h)、給藥5 d(CFA造模24 h)、給藥11 d(CFA造模7 d)共計5個時點檢測大鼠患側足縮腿閾。
1.5 樣本制備
大鼠行腹腔水合氯醛350 mg/kg麻醉,用于免疫熒光檢測的大鼠生理鹽水經心灌注后,再用4%多聚甲醛滴注,快速取得患側L4-L6 DRG,用4%多聚甲醛溶液固定4 h,蔗糖溶液梯度脫水(15%蔗糖溶液24 h,30%蔗糖溶液48 h),經液氮速凍,放入-80℃冰箱中保存備用。用于PCR的大鼠僅灌注生理鹽水,冰上取患側L4-L6 DRG,立即置于-80℃冰箱中保存備用。
1.6 指標檢測
1.6.1 足縮腿閾(paw withdrawal thresholds,PWTs)
以患側PWTs作為機械痛敏的評定值:測量前,將大鼠放置于透明塑料盒(69 cm×17 cm×14 cm)中適應15 min。待大鼠安靜后,將類似Von Frey絲的金屬絲(φ0.5 mm)置于大鼠足底正中(避開足墊),從0開始以2.5 g/s遞增的強度刺激大鼠足底,直至引發大鼠縮足反射,記錄此時刺激強度,連續測量3次,每次間隔5 min,取平均值作為測定結果。設定最大刺激強度為50 g,截止時間為20 s,以免大鼠足爪損傷。
1.6.2 大鼠患側L4-L6 DRG中的MrgC mRNA的表達
總RNA的提取:取出大鼠L4-L6 DRG,加入1 mL Trizol,冰上超聲粉碎,室溫靜置5 min,加入200 μL氯仿,混勻后劇烈震蕩,靜置15 min,4℃,11,440 r/min離心15 min,取上清液再加入500 μL異丙醇,混勻后4℃,11,440 r/min離心10 min,取沉淀加入75%乙醇1mL,用移液槍進行輕輕吹打,4℃,10,444 r/min離心5 min,待RNA沉淀干燥后,加入0.1% DEPC水溶解。紫外分光光度法檢測 OD260/ OD280的比值,并計算其濃度。取該比值在1.8~2.0之間的RNA溶液進行后續實驗
逆轉錄:采用含DNA酶消化步驟的Takara的逆轉錄試劑盒,按說明書操作,合成cDNA:吸取2 μL總RNA溶液、隨機引物、RTmix(含RNAsin和DTT)、dNTP混合液、DEPC水按照逆轉錄體系比例配制反應體系。
定量PCR:采用 PRIMER5.0軟件設計引物,MrgC上游引物:5'-ACTCTGGCTCTTGGGATT-3',下游引物:5'-GAGGGACCGATGCTTTT-3';采用糖酵解反應中的甘油三磷酸脫氫酶(glyceraldehydephosphate dehydrogenase,GAPDH)為內參[13],其上游引物:5'-TGCTGAGTATGTCG TGGAG-3',下游引物:5'-GTCTTCTGAGTGGCAGTG AT-3',均由上海生工生物技術有限公司合成。參照BIORAD試劑盒,以cDNA為模板,GAPDH為內參,采用SYBR Green法在20 μL反應體系中擴增cDNA樣品。MrgC與GAPDH的反應條件為:95℃30 s,然后95℃5 s,56℃30 s,共39循環。設置溶解曲線檢測產物反應的純度65℃ ~95℃5 s,0.5℃步進。每次擴增的同時設置無cDNA的陰性對照,每個樣本設3個復孔。采用2-△CT法進行計算,結果以對照siRNA組基因表達量的倍率表示。
1.6.3 大鼠患側L4-L6 DRG中MrgC和p-PKCε的陽性細胞率的檢測
采用貼片法,DRG冰凍切片(14 μm),貼于載玻片上,室溫晾干1 h。用組化油筆將待染組織圈好,1%PBS浸洗4次,每次10 min。取出玻片,滴加10%山羊血清(1%PBS稀釋)37℃孵育1 h。棄山羊血清,加入 MrgC抗體(1∶100)(p-PKCε(1∶2000)),置濕盒中4℃過夜。次日拿出濕盒,放于37℃孵育45 min,棄一抗,1%PBS浸洗4次,每次10 min。滴加羊抗兔IgG(1∶1000)(羊抗小鼠IgG(1∶1000))進行熒光標記,37℃避光孵育1 h。棄二抗,1%PBS浸洗4次每次10 min(避光)。晾干后滴加抗熒光淬滅封片液封片。設立陰性對照:采用不含一抗的稀釋液替代一抗,其余條件不變。激光共聚焦顯微鏡下觀察并拍片。以陰性對照為參考,用Ipp 6.0軟件進行細胞計數,計算患側L4-L6 DRG中總細胞數及陽性細胞數,并計算MrgC與p-PKCε陽性細胞的表達率。
1.7 統計結果
2 結果
2.1 鞘內注射siRNA對CFA大鼠PWTs的影響
筆者分別檢測了鞘內置管前、給藥前、給藥4 d (CFA造模0 h)、給藥5 d(CFA造模24 h)、給藥11 d(CFA造模7 d)共計5個時點的大鼠患側PWTs,來評價大鼠機械痛閾,將給藥前的痛閾作為基礎痛閾。
如圖1所示,鞘內置管術前、給藥前兩組大鼠之間患側后足PWTs沒有明顯差異(P>0.05)。給藥4 d后于大鼠CFA造模前(CFA造模0 h)檢測兩組PWTs,MrgC siRNA組的足縮腿閾較對照siRNA組有所上升,但其差異無統計學意義(P>0.05)。給藥5 d(CFA造模后24 h)時,可見兩組PWTs較給藥4 d(CFA造模0 h)均明顯下降(P<0.01),MrgC siRNA組的PWTs高于對照siRNA組,兩組間差異仍無統計學意義(P>0.05)。此趨勢一直持續到給藥第11天,兩組的PWTs均低于給藥4 d(CFA造模0 h)的 PWTs,但兩組之間并無明顯差異(P>0.05)。
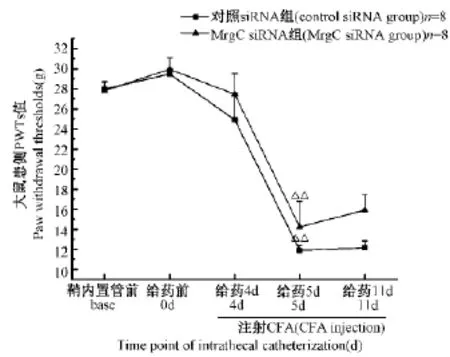
圖1 兩組大鼠在各時點PWTs變化情況Note:Compared with control siRNA group,**P>0.05;4d VS 5d,△△P<0.01.Fig.1 The PWTs of two groups at different time points
2.2 鞘內注射MrgC siRNA對大鼠患側L4-L6 DRG中MrgC mRNA表達的影響
分別檢測給藥11 d后兩組大鼠患側腰神經節L4、L5、L6的MrgC mRNA的表達量,以對照siRNA組表達量的倍數作圖,結果見下圖2。如圖中所示,MrgC siRNA組患側L4、L5、L6的MrgC mRNA表達量均低于對照siRNA組對應神經節的表達量(P<0.01,P<0.01,P<0.01),分別為對照siRNA組表達量的0.71、0.67、0.71倍。
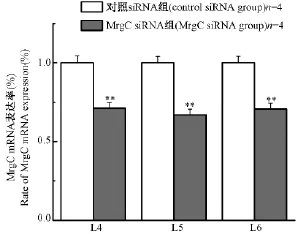
圖2 兩組大鼠患側L4-L6 DRG MrgC的mRNA表達量的變化Note:compared with control siRNA group,**P<0.01.Fig.2 Comparison of the expression of MrgC mRNA in ipsilateral DRG L4-L6 between two groups
2.3 鞘內注射MrgC siRNA對大鼠患側L4-L6 DRG中MrgC受體表達的影響
如圖3中所示,MrgC主要表達在DRG的中小神經元中。分別檢測給藥11d后兩組的MrgC表達變化,與對照siRNA組比較,MrgC siRNA組的MrgC陽性細胞率明顯降低(P<0.01),約為對照siRNA組的60%。熒光結果見彩插7圖5。
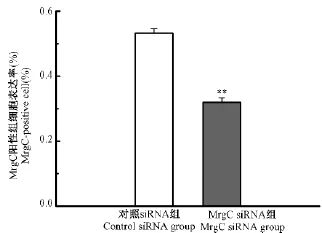
圖3 兩組大鼠患側L4-L6 DRG MrgC陽性細胞率的比較Note:compared with control siRNA group,**P<0.01.Fig.3 Rate of the expression of MrgC cells in L4-L6 ipsilateral DRG in each group
2.4 鞘內注射MrgC siRNA對大鼠患側L4-L6 DRG中p-PKCε陽性細胞率的影響
檢測給藥11 d后L4-L6 DRG PKCε Ser729點位磷酸化的變化,以 p-PKCε的陽性細胞率來評價。結果如圖4,與對照siRNA組比較,MrgC siRNA組的p-PKCε陽性細胞率明顯升高(P<0.05),約為對照siRNA組的126%。熒光結果見彩插7圖6。
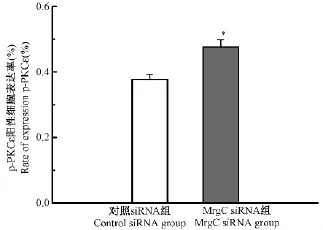
圖4 兩組大鼠患側DRG p-PKCε陽性細胞率的比較Note:compared with control siRNA group,*P<0.05.Fig.4 Rate of the expression of p-PKC in ipsilateral DRG of each group
3 討論
MrgC是2001年發現的一類新型的G蛋白偶聯受體,其基因僅僅高度表達于外周神經系統的DRG和三叉神經節的中小型感覺神經元中。研究發現MrgC參與慢性炎癥引發的外周痛覺過敏的調制[14]。但由于目前尚未發現MrgC特異性抑制劑,未有直接的證據證實MrgC在慢性炎性痛發展過程中對疼痛的調制作用,進一步的功能研究只能通過siRNA干擾mRNA表達或基因敲除。siRNA干擾是指內源性或外源性小片段雙鏈RNA與靶基因的mRNA同源互補,在細胞內特異降解靶mRNA,從而特異性封閉靶基因的過程[15]。研究報道,脊髓鞘內給予siRNA能夠通過轉染脊髓背角淺層的初級傳入神經纖維逆行至DRG發揮其干擾作用[16]。本實驗研究通過鞘內給予siRNA,觀察到給藥11 d時即CFA造模后第7天,MrgC siRNA組別DRG L4-L6的MrgC mRNA的表達量均明顯低于對照siRNA組相應神經節的表達量,進一步觀察發現MrgC siRNA組MrgC的表達明顯降低,約為對照siRNA組的60%,與MrgC mRNA變化相一致。這說明鞘內注射該siRNA片段有效的抑制MrgC基因及其蛋白的表達,從而在CFA慢性炎性痛的基礎上成功建立了MrgC基因沉默模型。
CFA致炎性痛模型為一種經典的研究慢性炎性痛的模型,單側注射CFA誘導產生的痛覺過敏一般在4 h內發展,為炎性痛的急性期,24 h~48 h為慢性炎性痛早期,隨后在7 d左右痛覺過敏有個小高峰,之后慢慢恢復。文獻報道患側的痛覺過敏可持續4~6周,而在健側產生的炎性鏡像痛一般在18 d以上[11]。以往的研究多集中在CFA慢性炎性痛早期,Jiang[14]等人發現在椎管內注射MrgC特異性激動劑牛腎上腺髓質 8-22肽(bovine adrenal medulla 8-22,BAM8-22)不能夠影響正常大鼠的基礎痛閾和削弱CFA引發的早期機械痛覺過敏(24 h),但能夠削弱CFA引發的早期熱痛覺過敏(24 h)。與該研究的結果相一致的是,本研究CFA造模前鞘內給與4次MrgC siRNA干擾(文獻報道以2 μg/次劑量,4次注射該siRNA片段能夠使正常大鼠的MrgC mRNA表達量下降50%[12]),與對照siRNA組比較,沒有顯著的改變大鼠的機械痛閾。CFA造模后24 h,可見兩組的PWTs較造模前均顯著下降,提示CFA模型的成功建立。但繼續給與siRNA干擾直至CFA第7天,兩組間機械痛閾仍未見明顯差異。這結果表明抑制MrgC的表達未能影響CFA引發的機械痛覺過敏。另有Guan Y等[17]敲除Mrg基因家族(含MrgC基因)后鞘內注射BAM8-22能同時延緩CFA引起的早期機械痛覺過敏與熱痛覺過敏(24 h),該現象可能是由于同時沉默了除MrgC基因之外的Mrg基因家族成員而引發的。因為本研究沒有觀察干擾MrgC基因對于CFA引起的熱痛覺過敏的影響,這將是我們進一步研究的目標。
PKC是一種重要的細胞內信號轉導分子[3],在損傷或炎癥引起的慢性痛覺過敏啟動與維持中起著重要的作用[18],它的膜移位和磷酸化是PKC被激活的重要標志[19]。Honan等人基于正常大鼠的原痛研究發現,鞘內給予 MrgC特異性激動劑BAM8-22,應用全細胞膜片鉗技術發現與熱痛密切相關的辣椒素受體(transient receptor potential vanilloid type 1,TRPV1)敏化的神經元大約占13%的DRG神經元,這一效應被PKC特異性抑制劑Ro-31-8220所抑制[6];有研究表明鞘內注射BAM8-22抑制了CFA誘發的脊髓背角膜上PKCγ的上升[20]。以上研究提示PKC在MrgC對疼痛的調控中起著重要的作用。但是目前尚無DRG中PKC在MrgC對CFA誘發的慢性炎性痛調制過程功能性改變的研究。PKC的亞基ε在90%以上的DRG中小直徑神經元中表達,其Ser729點位磷酸化是PKCε引發痛覺過敏的一個必要調節因素,本研究觀察到在有效沉默MrgC基因后,PKCε的Ser729點位磷酸化水平明顯上升,該結果提示抑制DRG中PKCε的Ser729點位磷酸化從而抑制PKCε功能性激活是MrgC調制CFA慢性炎性痛的重要細胞學機制。
綜上所述,本研究在CFA慢性炎性痛的基礎上成功地建立了 MrgC基因沉默模型,該模型中對MrgC的抑制作用顯著上調PKCε Ser729磷酸化的水平,基于PKC是一個蛋白激酶,它激活了多種與疼痛密切相關的傷害性感受器,如TRPV1,下一步的研究將圍繞著MrgC/PKC深入展開。
[1]Dong X,Han S,Zylka M J,et al.A diverse family of GPCRs expressed in specific subsets of nociceptive sensory neurons[J].Cell,2001,106(5):619-632.
[2]Lembo P M,Grazzini E,Groblewski T,et al.Proenkephalin A gene products activate a new family of sensory neuron-specific GPCRs[J].Nat Neurosci,2002,5(3):201-209.
[3]劉峰,田玉科.PKCγ的功能概述[J].醫學綜述,2010(5): 656-658.
[4]王遠勝,胡興國.蛋白激酶C與疼痛的中樞敏感化[J].國外醫學.麻醉學與復蘇分冊,2002(2):108-111.
[5]Liao G Y,Wagner D A,Hsu M H,et al.Evidence for direct protein kinase-C mediated modulation of N-methyl-D-aspartate receptor current[J].Mol Pharmacol,2001,59(5):960-964.
[6]Honan S A,Mcnaughton P A.Sensitisation of TRPV1 in rat sensory neurones by activation of SNSRs[J].Neuroscience Letters,2007,422(1):1-6.
[7]章沿鋒,張小洺,姚尚龍.大鼠三種鞘內置管術的效果比較[J].中華麻醉學雜志,2010,30(2):252-254.
[8]鄧亞南,劉艷芳,陳建平,等.經大鼠腰骶部鞘內置管給藥技術的研究[J].中國醫學創新,20 14(18):33-35.
[9]Yaksh T L,Rudy T A.Chronic catheterization of the spinal subarachnoid space[J].Physiol Behav,1976,17(6):1031-1036.
[10]Poon Y Y,Chang A Y,Ko S F,et al.An improved procedure for catheterization of the thoracic spinal subarachnoid space in the rat[J].Anesth Analg,2005,101(1):155-160.
[11]De Castro C M,De Sutter P,Gybels J,et al.Adjuvant-induced arthritis in rats:a possible animal model of chronic pain[J].Pain,1981,10(2):173-185.
[12]He S Q,Li Z,Chu Y X,et al.MrgC agonism at central terminals of primary sensory neurons inh ibits neuropathic pain[J].Pain,2014,155(3):534-544.
[13]Du J,Fang J,Liang Y,et al.Electroacupuncture attenuates mechanical allodynia by suppressing the spinal JNK1/2 pathway in a rat model of inflammatory pain[J].Brain Res Bull,2014,108:27-36.
[14]Jiang J,Wang D,Zhou X,et al.Effect of Mas-related gene (Mrg) receptors on hyperalgesia in rats with CFA-induced inflammation via direct and indirect mechanisms[J].Br.J.Pharmacol,2013,170(5):1027-1040.
[15]Fire A,Xu S,Montgomery M K,et al.Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J].Nature,1998,391(6669):806-811.
[16]Luo M C,Zhang D Q,Ma S W,et al.An efficient intrathecal delivery of small interfering RNA to the spinal cord and peripheral neurons[J].Mol Pain,2005,1:29.
[17]Guan Y,Liu Q,Tang Z,et al.Mas-related G-protein-coupled receptors inhibit pathological pain in mice[J].PNAS,2010, 107(36):15933-15938.
[18]Mochly-Rosen D,Das K,Grimes K V.Protein kinase C,an elusive therapeutic target?[J].Nat rev drug discov,2012,11 (12):937-957.
[19]Kang J,Toita R,Kim C W,et al.Protein kinase C(PKC) isozyme-specific substrates and their des ign[J].Biotechnol.Adv,2012,30(6):1662-1672.
[20]呂慶琴.大鼠MrgC受體抑制CFA誘發炎性疼痛的細胞學機制[D].福建師范大學,2013.
SiRNA interference on expression of MrgC and phosphorylation of PKCε in ipsilateral dorsal root ganglion of rats with chronic inflammatory pain
LIN Xiao-xi,FANG Fang,FANG Jian-qiao,LIU Ying-jun
(The Third Clinical Medical College,Zhejiang Chinese Medical University,Hangzhou 310053,China)
Objective To observe the Interference effects of siRNA(small interference RNA)intrathecal injection on the expression of mRNA and protein of MrgC,on PWTs(paw withdrawal thresholds)and the phosphorylation of PKCε Ser729 in ipsilateral DRG(dorsal root ganglion)of rats with chronic inflammatory pain induced by CFA(complete freund’s adjuvant).Methods 16 health adult male SD(Sprague-Dawley)rats were randomly divided into 2 groups:control siRNA group and MrgC siRNA group,8 rats in each group.After success of intrathecal catheterization,corresponding siRNA was injected in rats for 4d,once a day,5μg/d per rat.The model of chronic inflammatory pain was established by CFA(0.1ml per rat)subcutaneously injected into the right hind paw at 4th day post-administration,then two groups were administrated corresponding siRNA on alternate day and executed at the 11th day post-administration.The PWTs were measured at 5 time points of pre-intrathecal catheterization,pre-administration,4th day post-administration(0h post-CFA injection),5th day post-administration(24h post-CFA injection),11th day post-administration(7 d post-CFA injection).The expression of MrgC mRNA in ipsilateral DRG was detected by fluorogenic quantitative PCR,and the expression of MrgC and the phosphorylation of PKCε Ser729 in ipsilateral DRG was detected by immumofluorescence method.Result Compared with 4th day post-administration,PWTs of both two groups at 5th day post-administration decreased significantly (P<0.01).While there was no significant difference of PWTs between two groups at every detective time point.Compared with control siRNA group,the expression of MrgC mRNA and the rate of MrgC positive cells in MrgC siRNA group both decreased significantly(P<0.01,P<0.05),whereas the rate of p-PKCε Ser729 positive cells increased obviously(P<0.05)at 11th day post-administration.Conclusion MrgC siRNA can effectively interfere the expression of mRNA and protein of MrgC in L4-L6 ipsilateral DRGs of rats with chronic inflammatory pain induced by CFA,and the siRNA interference on MrgC can obviously up-regulate the phosphorylation of PKCε Ser729,while it has no significant effect on PWTs of rats.
SiRNA;MrgC;Phosphorylation of PKCε Ser729;Chronic inflammatory pain;Dorsal root ganglion
R-332
A
1671-7856(2015)07-0039-07
10.3969.j.issn.1671.7856.2015.007.009
國家自然科學基金資助項目(81202755);浙江省醫藥衛生科技計劃(2015KYA172)。
林小溪,女(1989-),碩士生。方芳,女(1976-),助理研究員。
方劍喬(1961-),男,教授,博士生導師。研究方向:針刺鎮痛的效應基礎研究。E-mail:Fangjianqiao7532@163.com。
2015-07-02

