果糖基轉移酶在釀酒酵母中異源表達及酶學性質分析*
王一恬,張玲,沈微,楊海麟
1(江南大學工業生物技術教育部重點實驗室,江蘇無錫,214122)2(江南大學 生物工程學院,江蘇 無錫,214122)
低聚果糖(Fructooligosaccharide,FOS)是一類重要的低聚糖,進入人體消化道后,不會被膽汁、胃酸、消化酶等分解吸收,可直達大腸中。腸道益生菌如雙歧桿菌、嗜酸性乳酸桿菌等可選擇性利用低聚果糖,獲得快速、大量繁殖,因此它是腸道益生菌的增殖因子[1-2]。果 糖 基 轉 移 酶 (fructosyltransferase,EC 2.4.1.9,縮寫FTase)可催化蔗糖分子果糖基上的β-(2,1)糖苷鍵,結合1~3個果糖基,生成低聚果糖。低聚果糖主要包括蔗果三糖(GF2)、蔗果四糖(GF3)和蔗果五糖(GF4)及其混合物等。果糖基轉移酶的主要來源包括兩方面:1)植物,如黑麥草、洋蔥等[3-4];2)微生物,如真菌、細菌等[5-7]。植物來源的果糖基轉移酶存在低含量等缺點,在低聚果糖工業生產中未被大規模采用。近年來,多種微生物(如絲狀真菌、酵母、節桿菌等)來源的果糖基轉移酶被逐步發現并得到研究,但主要集中在對產酶微生物的篩選、酶純化、酶學性質等初步研究[8-10]。本文采用反轉錄PCR(RT-PCR),獲得黑曲霉(Aspergillus niger)YZ59的果糖基轉移酶基因成熟酶區域(不含內含子)。采用食品級表達宿主釀酒酵母(Saccharomyces cerevisiae)W3031A,成功異源表達了A.niger YZ59果糖基轉移酶。純化后,對其酶學性質進行分析與討論。該研究對果糖基轉移酶的異源表達及高純度低聚果糖的工業化生產具有重要指導意義。
1 材料與方法
1.1 菌株與質粒
A.niger YZ59(CICIM F0901)保藏于中國高校工業微生物資源和信息中心;S.cerevisiae W3031A、大腸桿菌(Escherichia coli)宿主菌株JM109、質粒pYX212為本研究室保藏,其他質粒均為實驗中構建。
1.2 培養基
LB培養基(g/L):蛋白胨10、酵母提取物5、NaCl 10;
SC-Ura培養基(g/L):酵母氮基6.7、葡萄糖20、亮氨酸 0.12、色氨酸 0.12、組氨酸 0.12、腺嘌呤0.12、瓊脂 15;
YPD培養基(g/L):酵母提取物10、蛋白胨20、葡萄糖20。
1.3 果糖基轉移酶基因克隆及重組質粒構建
采用反轉錄酶III試劑盒(Invitrogen 18080-051)進行RT-PCR,獲得A.niger果糖基轉移酶cDNA。將已獲得的cDNA作為進一步PCR的模板。PCR引物序列為:上游5’-CCGGAATTCATGAAGCTTCAAACGGCTTC-3’;下游5’-CGCGGATCCTTAGTGATGATGATGATGAGACTGACGATCCGGCCA-3’。引物兩端的限制性酶切位點(下劃線)分別為:EcoR I與BamH I。
PCR產物和質粒pYX212均采用限制性內切酶EcoR I與BamH I進行酶切。采用連接酶,將酶切后的PCR產物和質粒pYX212進行連接,獲得重組質粒pYX212-fwt,測序驗證。采用電轉化方法將重組質粒pYX212-fwt轉化宿主S.cerevisiae W3031A,利用尿嘧啶缺陷型平板(SC-Ura培養基)篩選,獲得產果糖基轉移酶重組菌S.cerevisiae W3031A-pYX212-fwt。
1.4 酶液制備
在搖瓶(250 mL)中對重組菌 S.cerevisiae W3031A-pYX212-fwt進行培養,30℃發酵48 h后,4℃下,8 000×g離心10 min,獲得菌體細胞。用相同體積的磷酸-檸檬酸緩沖液(pH 5.5)洗滌菌體細胞3次,再加入等體積的緩沖液混勻后,采用超聲破碎儀破碎細胞。4℃下,10 000×g離心10 min,獲得含有果糖基轉移酶的上清液。
1.5 果糖基轉移酶酶活測定
果糖基轉移酶的測定是通過HPLC方法測定反應體系中蔗果三糖(GF2)的含量[11-12]。1個單位的果糖基轉移酶酶活定義為:每分鐘生成1 μmol GF2需要的酶量。
1.6 果糖基轉移酶純化
將“酶液制備”獲得的含有果糖基轉移酶的上清液,采用0.2 μm的膜過濾去除雜質。由于果糖基轉移酶的C端含有His標簽,實驗中采用Ni2+柱純化過濾后的酶液,蛋白純化儀為AKTA(GE,USA)。緩沖液A為含有20 mmol/L咪唑的磷酸緩沖液(50 mmol/L,pH 7.4)。緩沖液B為含有250 mmol/L咪唑的磷酸緩沖液(50 mmol/L,pH 7.4)。流速為1.0 mL/min。基于線性洗脫(0~100% 緩沖液B),收集目的樣品。
1.7 溫度和pH對果糖基轉移酶穩定性的影響
酶最適溫度測定時的條件為:溫度范圍為30~70℃、底物為蔗糖、100 mmol/L磷酸-檸檬酸緩沖液(pH 5.5)。在不同溫度下測定的最高酶活力設為100%。研究過程中,分析了酶在40、50、60℃條件下的溫度穩定性。在各溫度條件下,處理前的初始酶活力設為100%。
酶的最適pH是在不同pH條件下進行分析的,如pH3.0~8.0(磷酸-檸檬酸緩沖液,100 mmol/L)。在不同pH條件下測定的最高酶活力設為100%。酶pH穩定性測定的前處理條件為:不同pH緩沖液、25℃保溫24 h。采用的緩沖液為:磷酸-檸檬酸緩沖液(100 mmol/L,pH 3.0~8.0)、磷酸緩沖液(100 mmol/L,pH 8.0~9.0)、甘氨酸-NaOH 緩沖液(100 mmol/L,pH 9.0~11.0)。在不同pH緩沖液處理條件下,測得的最高殘留酶活力設為100%。
1.8 酶動力學參數測定
酶動力學參數測定條件為:磷酸-檸檬酸緩沖液(100 mmol/L,pH 5.5)、底物為蔗糖。底物濃度范圍為20~250 g/L。動力學參數Km和Vmax均采用Lineweaver-Burk作圖法進行計算。
1.9 金屬離子對酶的影響
為分析金屬離子對果糖基轉移酶的影響,5 mmol/L 不同金屬離子(K+、Li+、Ba2+、Na+、Ca2+、Fe3+、Zn2+、NH4+、Mn2+、Cu2+、Mg2+、Ni2+)分別添加到果糖基轉移酶酶反應體系中。以不添加金屬離子條件下測定的果糖基轉移酶酶活力為100%。
2 結果與討論
2.1 果糖基轉移酶基因的克隆及重組載體構建
通過RT-PCR方式,獲得來源于A.niger YZ59(CICIM F0901)的果糖基轉移酶cDNA。以該cDNA為模板,進一步通過PCR方式獲得不含內含子的果糖基轉移酶成熟序列fwt。采用限制性內切酶EcoR I與BamHI進行酶切,純化后,與質粒pYX212連接,獲得重組質粒pYX212-fwt(圖1)。
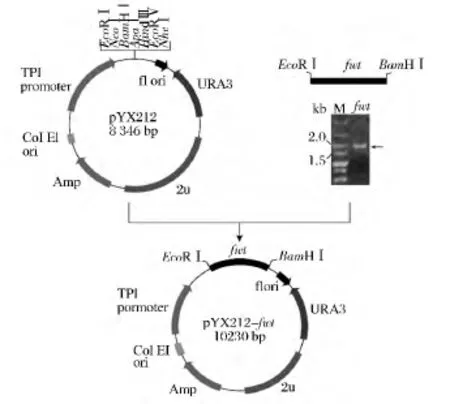
圖1 重組質粒pYX212-fwt的構建Fig.1 Construction of recombinant plasmid pYX212-fwt
2.2 果糖基轉移酶的表達
將重組質粒 pYX212-fwt轉化 S.cerevisiae W3031A,基于尿嘧啶缺陷型平板篩選,獲得產果糖基轉移酶重組菌S.cerevisiae W3031A-pYX212-fwt。提取重組菌 S.cerevisiae W3031A-pYX212-fwt的基因組,以其為模板進行PCR驗證,獲得已重組果糖基轉移酶基因的陽性S.cerevisiae重組子。
將陽性S.cerevisiae重組子接種YPD培養基,30℃發酵56 h(圖2)。隨著發酵的逐步進行,果糖基轉移酶的產量逐漸增加,當發酵至48 h時,酶活達到最大,為19.8 U/mL。同時,隨著發酵的不斷進行,重組S.cerevisiae的菌體濃度也逐漸增加。當發酵至48 h時,菌體濃度達到最大,OD600=3.2。果糖基轉移酶也有在其他非食品級表達宿主中進行異源表達的報道。例如,王玉海等將來源于米曲霉的果糖基轉移酶基因在E.coli BL21(DE3)中實現了異源表達,25℃條件下,1.0 μmol/mL異丙基硫代半乳糖苷(IPTG)誘導后,果糖基轉移酶酶活力達59.0 U/g[13]。

圖2 重組菌S.cerevisiae W3031A-pYX212-fwt產酶曲線Fig.2 Time profiles of FWT production by recombinant S.cerevisiae W3031A-pYX212-fwt
2.3 溫度對果糖基轉移酶的影響
如圖3A所示,果糖基轉移酶FWT的最適反應溫度為55℃。當反應溫度低于55℃時,隨著溫度的逐漸升高,FWT的酶活力逐漸增加。在最適反應溫度(55℃)條件下,FWT的酶活力是30℃下酶活力的2.3倍。但高于55℃時,隨著反應溫度的逐漸升高,FWT的酶活力迅速降低。70℃時,FWT的酶活力僅為55℃時酶活力的25.4%。對于果糖基轉移酶FWT的熱穩定性,分別分析了酶在40、50、60℃下的穩定性(圖3B)。在40℃下,處理60 min,果糖基轉移酶FWT基本不失活(酶活力殘留95%),這說明其在該溫度條件下穩定。在50℃下,處理60 min,果糖基轉移酶FWT酶活力殘留約為60%,這說明其在該溫度條件下也較穩定。但果糖基轉移酶FWT在60℃下,隨著處理時間的延長,酶活力迅速下降,甚至完全失活。由以上結果可以看出,果糖基轉移酶FWT具有良好的耐熱性。據報道,來源于米曲霉(A·oryzae)ZZ-01的果糖基轉移酶AoFT較果糖基轉移酶FWT的最適反應溫度偏低10℃,為45℃[8]。
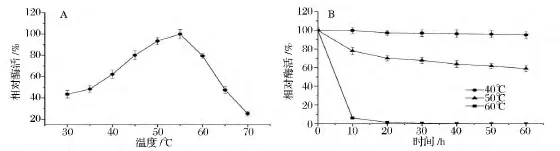
圖3 溫度對果糖基轉移酶FWT酶活力和穩定性的影響Fig.3 Effect of temperature on the activity and stability of FWT
2.4 pH對果糖基轉移酶的影響
果糖基轉移酶FWT的最適pH為5.5(圖4A)。當pH<5.5時(3.0~5.5),隨著pH值的增加,果糖基轉移酶FWT的相對酶活力逐漸增大。果糖基轉移酶FWT在pH 5.5條件下的酶活力為pH 3.0條件下酶活力的4倍。但當pH5.5時,隨著pH值的增加,果糖基轉移酶FWT的相對酶活力迅速降低。如圖4B所示,分析了果糖基轉移酶FWT在pH 2.0~11.0條件下的穩定性。在pH 6.0條件下,果糖基轉移酶FWT最為穩定。在pH 4.0~9.0條件下,果糖基轉移酶FWT的穩定性較高(酶活殘留90%)。由此可確定,果糖基轉移酶FWT具有較寬的pH穩定范圍。據報道,洋蔥來源的果糖基轉移酶FST-1在pH低于或高于5.5時,酶活力迅速降低,甚至完全失活[4]。

圖4 pH對果糖基轉移酶FWT酶活力和穩定性的影響Fig.4 Effect of pH on the activity and stability of FWT
2.5 果糖基轉移酶的動力學參數
基于Lineweaver-Burk雙倒數曲線,以蔗糖為反應底物,分別對果糖基轉移酶FWT的米氏常數Km和最大反應速率Vmax進行分析。如圖5所示,果糖基轉移酶FWT的Km值和Vmax值分別為169.5 g/L和0.7 g/(L·min)。果糖基轉移酶FWT的kcat值和kcat/Km值分別為9.8 ×103min-1和57.8 L/(g·min)。
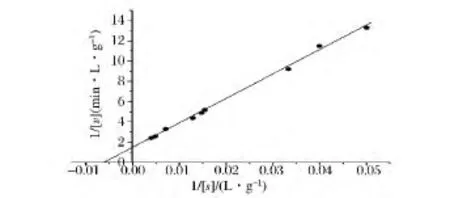
圖5 果糖基轉移酶FWT的Lineweaver-Burk雙倒數曲線Fig.5 Lineweaver-Burk plots for using sucrose as substrate by FWT
2.6 金屬離子對果糖基轉移酶的影響
為了分析金屬離子對果糖基轉移酶FWT酶活力的影響,測定了5 mmol/L濃度下不同金屬離子(K+、Li+、Ba2+、Na+、Ca2+、Fe3+、Zn2+、NH4+、Mn2+、Cu2+、Mg2+、Ni2+)對酶活力的影響關系。如圖6所示,果糖基轉移酶FWT可顯著被Ni2+和Mg2+激活。添加5 mmol/L Ni2+和Mg2+時,果糖基轉移酶FWT的酶活力分別為對照的112.3%和106.3%。同時,5 mmol/L K+和Fe3+也對果糖基轉移酶FWT有一定的激活作用。5 mmol/L Ba2+和Cu2+對果糖基轉移酶FWT具有顯著的抑制作用。金屬離子可以影響酶結構的正確折疊,進而影響酶的酶活力。不同金屬離子對果糖基轉移酶酶活力具有不同的激活或抑制作用。例如,Ca2+可激活來自萵苣的果糖基轉移酶,但其活性卻受Zn2+和 Cu2+的抑制[14]。

圖6 金屬離子對果糖基轉移酶FWT酶活力的影響Fig.6 Effect of metal ions on the activity of FWT
3 結論
本研究通過RT-PCR獲得了A.niger來源的果糖基轉移酶基因,成功在S.cerevisiae中實現了異源表達,并對純化后酶學性質進行了測定、分析。果糖基轉移酶在S.cerevisiae中無需誘導即可進行異源表達,發酵48 h后,最高酶活力可達19.8 U/mL。對該重組果糖基轉移酶FWT的性質進行研究發現,酶的最適反應溫度為55℃,酶在低于50℃的條件下穩定。果糖基轉移酶FWT的最適pH為5.5,具有較寬的pH穩定范圍。果糖基轉移酶 FWT的 Km、Vmax、kcat、kcat/Km分別為 169.5 g/L、0.7 g/(L·min)、9.8×103min-1、57.8 L/(g·min)。Ni2+和 Mg2+可顯著激活果糖基轉移酶FWT。S.cerevisiae作為食品級表達宿主,具有食品安全等優點,后期將對S.cerevisiae高效生產重組果糖基轉移酶進行進一步調控與優化研究。
[1] Ganaie M A,Rawat H K,Wani Q A,et al.Immobilization of fructosyltransferase by chitosan and alginate for efficient production of fructooligosaccharides[J].Process Biochemistry,2014,49(5):840 -844.
[2] Aguiar-Oiveira E,Maugeri F.Effects of the addition of substrate and salts in both the fructosyltransferase immobilization and its catalytic properties[J].Journal of Food Biochemistry,2013,37(5):520 -527.
[3] Rasmussen S,Parsons A J,Xue H,et al.Transcript profiling of fructan biosynthetic pathway genes reveals association of a specific fructosyltransferase isoform with the high sugar trait in Lolium perenne[J].Journal of Plant Physiology,2014,171(7):475 -485.
[4] HAN Y W,CHEN L P,MAO D B,et al.Expression and activity analysis of sucrose:sucrose 1-fructosyltransferase from onion[J].New Biotechnology,2010,27(4):324 -329.
[5] Alvarado-Huallanco M B,Maugeri F F.Kinetic studies and modelling of the production of fructooligosaccharides by fructosyltransferase from Rhodotorula sp.[J].Catalysis Science & Technology,2011,1(6):1 043 -1 050.
[6] Onderkova Z,Bryjak J,Vankova K,et al.Kinetics of thermal inactivation of free Aureobasidium pullulans fructosyltransferase[J].Enzyme and Microbial Technology,2010,47(4):134-139.
[7] Almeciga-Diaz C J,Gutierrez A M,Bahamon I, et al.Computational analysis of the fructosyltransferase en-zymes in plants,fungi and bacteria[J].Gene,2011,484(1-2):26-34.
[8] WEI T,YU X,WANG Y Y,et al.Purification and evaluation of the enzymatic properties of a novel fructosyltransferase from Aspergillus oryzae:a potential biocatalyst for the synthesis of sucrose 6-acetate[J].Biotechnology Letters,2014,36(5):1 015 -1 020.
[9] Aguiar-Oliveira E,Maugeri F.Effects of lyophilization on catalytic properties of immobilized fructosyltransferase from Rhodotorula sp.LEB-V10[J].Food and Bioproducts Processing,2013,91(C4):609 -616.
[10] Kikuchi H,Inoue M,Saito H,et al.Industrial production of difructose anhydride III(DFA III)from crude inulin extracted from chicory roots using Arthrobacter sp.H65-7 fructosyltransferase[J].Journal of Bioscience and Bioengineering,2009,107(3):262 -265.
[11] Arrizon J,Morel S,Gschaedler A,et al.Fructanase and fructosyltransferase activity of non-Saccharomyces yeasts isolated from fermenting musts of Mezcal[J].Bioresource Technology,2012,110:560 -565.
[12] Salinas M A,Perotti N I.Production of fructosyltransferase by Aureobasidium sp.ATCC 20524 in batch and two-step batch cultures[J].Journal of Industrial Microbiology& Biotechnology,2009,36(1):39-43.
[13] 張毅,王岳,王林.編碼米曲霉果糖基轉移酶基因在大腸桿菌中的重組表達[J].現代食品科技,2014,30(9):67-73.
[14] 李慧娟,邵先祥,孫云鵬,等.蔗糖:蔗糖-1-果糖基轉移酶的表面展示及酶學性質分析(英文)[J].微生物學通報,2014,41(11):2 190 -2 197.

