結核分枝桿菌抗原對人單核細胞核苷酸結合寡聚化結構域樣受體蛋白12表達的影響
劉艷華 王若 程小星
?
·論著·
結核分枝桿菌抗原對人單核細胞核苷酸結合寡聚化結構域樣受體蛋白12表達的影響
劉艷華 王若 程小星
目的 研究結核分枝桿菌(Mycobacteriumtuberculosis, Mtb)抗原對人單核細胞中核苷酸結合寡聚化結構域樣受體蛋白12(NLRP12)表達的影響,為深入研究NLRP12在結核病中的作用奠定實驗基礎。方法 采集15例活動性肺結核患者和15名健康人的抗凝血,分離外周血中單核細胞,用Mtb抗原H37Rv全菌裂解液、早期分泌靶抗原6(EAST-6)和培養分泌蛋白10(CFP-10)的抗原多肽刺激,提取單核細胞的總RNA,采用熒光定量PCR方法檢測NLRP12 mRNA的表達,采用配對t檢驗分析刺激前后單核細胞NLRP12的表達差異。以P<0.05為差異有統計學意義。結果 全菌裂解液、EAST-6和CFP-10抗原多肽刺激后的活動性肺結核患者單核細胞與未刺激前的單核細胞相比,其NLRP12 mRNA的表達顯著下調,由未刺激前的(1.8±1.26)×10-2分別下降到(1.09±0.78)×10-2(t=3.826,P<0.01)和(1.14±0.87)×10-2(t=3.695,P<0.01)。全菌裂解液、EAST-6和CFP-10抗原多肽刺激后,健康人單核細胞中NLRP12 mRNA的表達與未刺激前相比也降低,由未刺激前的(1.65±0.99)×10-2分別降至(1.2±0.87)×10-2(t=1.909,P>0.05)和(1.38±1.02)×10-2(t=1.151,P>0.05),差異無統計學意義。結論 Mtb抗原體外刺激能夠抑制活動性肺結核患者單核細胞NLRP12的表達。
結核, 肺; 結核分枝桿菌; 細胞內信號肽和蛋白質類:單核細胞; 重組融合蛋白質類
結核病是影響人類健康的重要傳染病,其病原是Mtb。世界約1/3的人口感染Mtb,多數感染者為潛伏狀態,5%~10%的感染者發展成為活動性結核病。單核和巨噬細胞是機體的天然免疫細胞,可以通過核苷酸結合寡聚化結構域樣受體(nucleotide-binding and oligomerization domain-like receptors, NLRs)、Toll樣受體(Toll-like receptor,TLR)和白細胞介素-1受體(interleukin-1 receptor, IL-1R)等模式識別受體識別Mtb抗原,啟動抗結核免疫,抑制或清除體內的Mtb。
核苷酸結合寡聚化結構域樣受體蛋白12(NLRP12),也稱之為Nalp12、Monarch-1和Pypaf-7,是最早已知與凋亡相關斑點樣蛋白(apoptosis-associated speck-like protein containing a CARD,ASC或PYCARD)相互作用組成炎癥體的NLR家族成員[1]。NLRP12通過減弱細胞核因子-κB(nuclear factor kappa B, NF-κB)信號通路的活化來抑制炎癥反應,NLRP12的缺失導致細胞因子的表達增加[2-3]。本研究發現,Mtb抗原體外可以抑制活動性肺結核患者單核細胞NLRP12的表達,提示NLRP12表達下調與Mtb感染相關。
材料和方法
一、受試者選擇與分組情況
活動性肺結核患者為解放軍第三〇九醫院全軍結核病研究所的住院患者,共15例,男∶女=8∶7,年齡范圍在32~42歲(平均年齡37歲)。活動性肺結核的診斷依據為《肺結核病診斷和治療指南》[4],包括臨床表現、X線檢查、痰涂片或細菌培養等,患者沒有肝炎、糖尿病和艾滋病等合并癥。健康人為解放軍第三〇九醫院體檢中心的健康體檢者,體檢結果顯示正常,包括常規體檢項目和X線檢查,共15例,男∶女=8∶7,年齡范圍在37~43歲(平均年齡40歲)。本研究通過解放軍第三〇九醫院倫理委員會審查,所有受試者均簽署知情同意書。
二、Mtb抗原準備
Mtb實驗室強毒株H37Rv為本室保存,用7H9培養基(美國BD公司)復蘇和培養,當生長至對數生長期后,離心獲得細菌沉淀,然后用雙蒸水(ddH2O)重懸細菌,通過超聲破碎和反復凍融的方法裂解細菌,離心后收集上清,即為H37Rv的全菌裂解液。早期分泌靶抗原6(EAST-6)和培養分泌蛋白10(CFP-10)的抗原多肽,由公司合成(北京賽百盛公司),每條多肽片段為15個氨基酸,相鄰片段重疊5個氨基酸,共34條多肽。
三、外周血單核細胞的分離與刺激
采集15例活動性肺結核患者和15名健康人的抗凝血,6 h內分離外周血中單核細胞。具體步驟為:先用Ficoll-Paque分離液(美國GE healthcare公司)分離抗凝血中的外周血單個核細胞(peripheral blood mononuclear cells, PBMCs),然后用1640完全培養基(美國Invitrogen公司)重懸細胞并接種至培養板中,37 ℃孵育靜置2 h,最后輕輕吹打,棄掉上清,貼壁細胞即為單核細胞,收集單核細胞并接種至96孔微孔培養板中,接種濃度為1×106個/ml。每個受試者的單核細胞分3孔,1孔細胞用終濃度為10 μg/ml全菌裂解液刺激,1孔細胞用終濃度為34 μg/ml的EAST-6和CFP-10的抗原多肽刺激(每條多肽終濃度為1 μg/ml),1孔細胞不用Mtb抗原刺激,設為未刺激孔。細胞置于37 ℃、5% CO2孵箱培養,16 h后收集細胞,TRIzol試劑(美國Invitrogen公司)處理細胞,-80 ℃保存。
四、細胞總RNA的提取和cDNA的合成
采用TRIzol試劑提取細胞總RNA[5], cDNA轉錄按試劑盒(大連寶生物公司)說明書進行。
五、NLRP12 mRNA的檢測
利用美國國家生物技術信息中心(National Center for Biotechnology Information, 簡稱NCBI)網站的Primer-Blast程序設計NLRP12的熒光定量PCR引物,引物序列如下:上游引物(forward primer):5′-CGTCCTCACTTGGGAACCAG-3′;下游引物(reserve primer): 5′-CATTGCGGTCTTCCATGAGC-3′ (Nucleotide數據庫,編號為NM_144687.3[6])。采用甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作為內參,引物序列如下:上游引物:5′-TGTTGCCATCAATGACCCCT-3′;下游引物: 5′-TCGCCCCACT-TGATTTTGGA-3′(Nucleotide數據庫,編號為NM_002046.5[7]),引物由上海生物工程有限公司合成。PCR擴增試劑為SYBR Green I熒光定量試劑(美國KAPA公司),擴增反應在熒光定量PCR擴增儀iQ5(美國Bio-Rad公司)上進行。反應程序為:首先95 ℃ 3 min變性,然后95 ℃ 10 s,57 ℃ 10 s,72 ℃ 10 s,擴增40個循環。
六、統計學分析
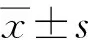
結 果
一、Mtb抗原刺激后活動性肺結核患者單核細胞NLRP12 mRNA的表達顯著下調
與未刺激前相比,活動性肺結核患者單核細胞經全菌裂解液刺激過夜后,NLRP12 mRNA的相對表達量顯著降低(t=3.826,P<0.01),由未刺激前的(1.8±1.26)×10-2下降到刺激后的(1.09±0.78)×10-2(圖1)。與未刺激前相比,活動性肺結核患者單核細胞經EAST-6和CFP-10抗原多肽刺激過夜后,NLRP12 mRNA的相對表達量也顯著降低(t=3.695,P<0.01),由未刺激前的(1.8±1.26)×10-2下降到刺激后的(1.14±0.87)×10-2(圖1)。比較全菌裂解液、EAST-6和CFP-10抗原多肽刺激的活動性肺結核患者單核細胞,發現NLRP12 mRNA的表達差異無統計學意義(t=0.3238,P>0.05)。
二、Mtb抗原刺激后健康人單核細胞NLRP12 mRNA的表達下調不明顯
與未刺激前相比,雖然健康人單核細胞經全菌裂解液刺激過夜后NLRP12 mRNA的表達量下降,由未刺激前的(1.65±0.99)×10-2下降到刺激后的(1.2±0.87)×10-2,但差異無統計學意義(t=1.909,P>0.05)(圖2)。雖然健康人單核細胞經EAST-6和CFP-10抗原多肽刺激過夜后NLRP12 mRNA的表達量也下降,由未刺激前的(1.65±0.99)×10-2下降到刺激后的(1.38±1.02)×10-2,但與未刺激前相比差異也無統計學意義(t=1.151,P>0.05)(圖2)。比較全菌裂解液刺激和抗原多肽刺激的健康人單核細胞發現,NLRP12 mRNA的表達差異無統計學意義(t=0.5064,P>0.05)。
三、活動性肺結核患者與健康人單核細胞刺激后NLRP12 mRNA表達差異
在Mtb抗原刺激前,活動性肺結核患者與健康人的單核細胞相比,其NLRP12 mRNA的表達差異無統計學意義(t=0.345,P>0.05)(圖3)。在Mtb抗原全菌裂解液、EAST-6和CFP-10抗原多肽刺激后,活動性肺結核患者與健康人的單核細胞相比,其NLRP12 mRNA的表達差異也無統計學意義(t=0.5979,P>0.05;t=0.6923,P>0.05)(圖3)。
討 論
NLR蛋白家族是天然免疫細胞中一類重要的模式識別受體,與天然和獲得性免疫反應的調節,炎癥反應和自身免疫性疾病的發生密切相關。NLR家族按功能分為三類,一類成員通過與半胱天冬酶1(caspase-1)前體組成炎癥體誘導IL-1β和IL-18的產生,促進炎癥反應,如核酸結合寡聚化結構域樣受體蛋白1(nucleotide-binding, leucine-rich repeat pyrin domain containing protein 1, NLRP1)和NLRP3等[8]。一類通過其他的信號通路如NF-κB和分裂素活化蛋白激酶(mitogen-activated protein kinase, MAPK)等激活炎癥反應,如核酸結合寡聚化結構域蛋白1(nucleotide-binding oligomerization domain-1, NOD1)和NOD2等[9-10]。第三類則通過減弱NF-κB等信號通路的活化來抑制炎癥反應,如核酸結合寡聚化結構域樣受體蛋白6(nucleotide-binding, leucine-rich repeat pyrin domain containing protein 6, NLRP6)和NLRP12等[11-12]。


圖3 活動性肺結核患者與健康人單核細胞中NLRP12 mRNA的表達情況
NLRP12含3個結構域,包含N末端的PYRIN,中間的核酸結合位點,和C末端的亮氨酸重復基序。人類NLRP12分子主要表達在外周血的單核細胞、粒細胞和樹突細胞中[13]。NLRP12在感染性疾病中發揮的作用及其機制還存在爭議。如Vla-dimer 等[14]報道NLRP12參與了宿主抗鼠疫耶爾森菌(Yersiniapestis)的感染免疫,NLRP12的缺陷會導致感染小鼠的死亡率增加,細菌載量增加,同時伴隨IL-18、IL-1β和IFN-γ的表達降低。Zaki等[15]發現,在沙門菌(Salmonella)感染中,NLRP12通過破壞IkBα和ERK磷酸化來抑制TLR誘導的NF-κB的活化,增強胞內細菌的存活。而Allen等[16]則認為NLRP12的缺失對宿主抗克雷伯肺炎桿菌(Klebsiellapneumonia)和Mtb感染沒有顯著影響。
目前,還沒有人單核細胞中NLRP12與結核病相關性的研究報道。本研究發現活動性肺結核患者單核細胞經過Mtb的全菌裂解液、EAST-6和CFP-10抗原多肽刺激后,其NLRP12 mRNA的表達顯著下調(圖1),健康人單核細胞經全菌裂解液、EAST-6和CFP-10抗原多肽刺激后,其NLRP12 mRNA的表達也降低,但NLRP12的下調并不顯著(圖2)。該結果表明Mtb抗原能抑制人單核細胞表達NLRP12,并且對活動性肺結核患者單核細胞表達NLRP12的抑制作用更加顯著。
研究發現Mtb全菌裂解液能促進宿主的免疫應答[17-18],而ESAT-6和CFP-10對宿主免疫反應的作用比較復雜。Pathak等[19]研究認為ESAT-6和CFP-10能抑制巨噬細胞活化,是宿主免疫反應的負調控因子;Chatterjee等[20]和Mir等[21]研究發現ESAT-6和CFP-10能促進宿主的免疫反應。本研究發現,全菌裂解液、EAST-6和CFP-10抗原多肽均能抑制人單核細胞表達NLRP12,當全菌裂解液的刺激濃度為10 μg/ml[17-18],EAST-6和CFP-10抗原多肽單條多肽的刺激濃度為1 μg/ml時[20-21],全菌裂解液、EAST-6和CFP-10抗原多肽對單核細胞中的NLRP12具有相近的抑制作用(圖1,2)。
總之,本研究發現Mtb抗原能夠誘導人單核細胞表達NLRP12下調,對活動性肺結核患者單核細胞表達NLRP12的抑制作用更加顯著,提示人單核細胞表達NLRP12下調與Mtb感染相關;這為進一步研究Mtb感染時NLRP12表達減少對單核細胞免疫的影響提供了實驗基礎。
[1] Wang L, Manji GA, Grenier JM, et al. PYPAF7, a novel PYRIN-containing Apaf1-like protein that regulates activation of NF-kb and caspase-1-dependent cytokine processing. J Biol Chem, 2002, 277 (33): 29874-29880.
[2] Williams KI, Lich JD, Duncan JA, et al. The CATERPILLER protein monarch-1 is an antagonist of toll-like receptor-, tumor necrosis factor alpha-, andMycobacteriumtuberculosis-induced pro-inflammatory signals. J Biol Chem, 2005, 280 (48):39914-39924.
[3] Lich JD, Williams KL, Moore CB, et al. Monarch-1 suppresses non-canonical NF-kappaB activation and p52 dependent chemokine expression in monocytes. J Immunol, 2007, 178 (3):1256-1260.
[4] 中華醫學會結核病學分會. 肺結核診斷和治療指南. 中華結核和呼吸雜志,2001, 24(2): 70-74.
[5] 劉艷華, 翟斐, 王心靜, 等. 活動性結核病人PBMCs中PLZF的表達降低與iNKT細胞的減少相關.中國免疫學雜志,2012, 28(9): 831-834.
[6] Shami PJ, Kanai N, Wang LY,et al.Identification and characterization of a novel gene that is upregulated in leukaemia cells by nitric oxide. Br J Haematol, 2001,112 (1): 138-147.
[7] Nowak K, Kuczek M, Ostropolska L, et al. The covalent structure of glyceraldehyde-phosphate dehydrogenase from human muscles. Isolation and amino acid sequences of peptides from tryptic digest. Hoppe Seylers Z Physiol Chem, 1975, 356 (7): 1181-1183.
[8] Kanneganti TD, Lamkanfi M, Núňez G. Intracellular NOD-like receptors in host defense and disease. Immunity, 2007, 27(4):549-559.
[9] Chamaillard M, Hashimoto M, Horie Y, et al. An essential role for NOD1 in host recognition of bacterial peptidoglycan containing diaminopimelic acid. Nat Immunol, 2003, 4(7):702-707.
[10] Inohara N, Ogura Y, Fontalba A, et al. Host recognition of bacterial muramyl dipeptide mediated through NOD2. Implications for Crohn’s disease. J Biol Chem, 2003, 278(8):5509-5512.
[11] Anand PK, Malireddi RK, Lukens JR, et al. NLRP6 negatively regulates innate immunity and host defence against bacterial pathogens. Nature, 2012, 488(7411):389-393.
[12] Allen IC, Wilson JE, Schneider M, et al. NLRP12 supresses colon inflammation and tumorigenesis through the negative regulation of noncanonical NF-kB signaling. Immunity, 2012, 36 (5):742-754.
[13] Williams KL, Taxman DJ, Linhoff MW, et al. Cutting edge: Monarch-1: A pyrin/nucleotide-binding domain/leucine-rich repeat protein that controls classical and nonclassical MHC class I genes. J Immunol, 2003, 170(11):5354-5358.
[14] Vladimer GI, Weng D, Paquette SW, et al. The NLRP12 inflammasome recognizesYersiniapestis. Immunity, 2012, 37(1):96-107.
[15] Zaki MD, Man SM, Vogel P, et al.Salmonellaexploits NLRP12-dependent innate immune signaling to suppress host defenses duing infection. Proc Natl Acad Sci U S A, 2014, 111(1):385-390.
[16] Allen IC, McElvania-Tekippe E, Wilson JE, et al. Characteri-zation of NLRP12 during the in vivo host immune response toKlebsiellapneumoniaeandMycobacteriumtuberculosis. PLoS One, 2013, 8(4):e60842.
[17] Dwivedi V, Manickam C, Patterson R, et al. Intranasal deli-very of whole cell lysate ofMycobacteriumtuberculosisinduces protective immune responses to a modified live porcine reproductive and respiratory syndrome virus vaccine in pigs. Vaccine, 2011, 29(23): 4067-4076.
[18] Manickam C, Dwivedi V, Miller J, et al.Mycobacteriumtuberculosiswhole cell lysate enhances proliferation of CD8 positive lymphocytes and nitric oxide secretion in the lungs of live porcine respiratory and reproductive syndrome virus vaccinated pigs. Viral Immunol, 2013, 26(1):102-108.
[19] Pathak SK, Basu S, Basu KK, et al. Direct extracellular interaction between the early secreted antigen ESAT-6 ofMycobacteriumtuberculosisand TLR2 inhibits TLR signaling in macrophages. Nat Immunol, 2007, 8(6):610-618.
[20] Chatterjee S, Dwivedi VP, Singh Y, et al. Early secreted antigen ESAT-6 ofMycobacteriumtuberculosispromotes protective T helper 17 cell responses in a Toll-like responses in a Toll-like receptor-2-dependent manner. PLoS Pathog, 2011, 7(11):e1002378.
[21] Mir SA, Verma I, Sharma S. Immunotherapeutic potential of recombinant ESAT-6 protein in mouse model of experimental tuberculosis. Immunol Lett, 2014, 158(1/2):88-94.
(本文編輯:范永德)
M.tuberculosisantigens inhibit the NLRP12 expression in monocytes from patients with active pulmonary TB
LIUYan-hua,WANGRuo,CHENGXiao-xing.
ArmyTuberculosisPreventionandControlKeyLaboratory,BeijingKeyLaboratoryofNewTechniquesofTuberculosisDiagnosisandTreatment,InstituteforTuberculosisResearch,The309thHospitalofChinesePLA,Beijing100091,China
Correspondingauther:CHENGXiao-xing,Email:xcheng2@139.com
Objective To study whether Mtb antigens have effect on the NLRP12 expression in peripheral blood monocytes, and provide experimental data to investigate the role of NLRP12 in tuberculosis. Methods Peripheral blood were collected from 15 healthy controls and 15 patients with active pulmonary tuberculosis. Monocytes were isolated from peripheral blood and then stimulated with Mtb antigens, including whole cell lysate of H37Rv strain and ESAT-6/CFP-10 peptide pool. Total RNA was extracted from unstimulated and stimulated cells, NLRP12 mRNA was detected by fluorescence quantitative PCR, and the difference of NLRP12 mRNA expression between stimulated and unstimulated cells was analyzed by pairedttest.Pvalue less than 0.05 was considered statistically significant. Results The reduction of NLRP12 mRNA in monocytes from active pulmonary TB was significant following stimulation by whole cell lysate and peptide pool, which reduced to (1.09±0.78)×10-2(t=3.826,P<0.01) and (1.14±0.87)×10-2(t=3.695,P<0.01) from (1.8±1.26)×10-2, respectively. The expression of NLRP12 mRNA in monocytes from healthy subjects was no significant change following stimulation by whole cell lysate and peptide pool, although which reduced to (1.2±0.87)×10-2(t=1.909,P>0.05) and (1.38±1.02)×10-2(t=1.151,P>0.05) from (1.65±0.99)×10-2, respectively. Conclusion Mtb antigens can inhibit the NLRP12 expression in monocytes from patients with active pulmonary Tin vitro.
Tuberculosis, pulmonary;Mycobacteriumtuberculosis; Intracellular signaling peptides and proteins; Monocytes; Recombinant fusion proteins
10.3969/j.issn.1000-6621.2015.04.002
國家自然科學基金青年基金項目(81101219)
100091北京,解放軍第三〇九醫院全軍結核病研究所 全軍結核病防治重點實驗室 結核病診療新技術北京市重點實驗室
程小星,Email: xcheng2@139.com
2014-07-02)

