Spn蛋白在結腸癌組織中表達的臨床病理意義
黃 河,羅 恩
結腸癌是消化系統常見的惡性腫瘤之一,其發生與多步驟基因突變及表型改變有關[1]。基因突變導致結腸癌細胞增殖、遷移、侵襲與分化能力發生改變,引起結腸癌發生與發展。經典的信號通路Wnt/b-catenin、TGF-b/BMP、K-RAS、PI3K 等均與結腸癌發生有關[2]。盡管目前診斷技術進步,很多結腸癌可在早期診斷,但仍有大約1/3患者診斷時有轉移,而復發率高達40%[3]。系統性化療目前對結腸癌治療取得一定效果,報道臨床有效反應率在40%~60%[4]。但臨床仍有一些患者對治療無反應,因此,尋找新的有效治療靶點具有重要的意義。
樹突棘親和素(spinophilin,Spn)是一種支架蛋白(scaffolding protein),定位于 17q21.33,這一基因區與細胞微衛星不穩及雜合性丟失密切相關。研究發現,位于 17q21 的 BRCA1,17q21.3 區基因缺失,與乳腺癌,前列腺癌及泌尿系腫瘤密切相關[5]。盡管目前研究報道Spn蛋白與頭頸部癌[6]、肝癌[7]等惡性腫瘤發生有關,但在結腸癌組織中Spn蛋白表達情況及Spn蛋白的臨床病理意義目前并未清楚,為此,本研究對Spn蛋白在結腸癌中表達情況作了深入的分析。
1 材料與方法
1.1 組織標本 收集2013年10月1日~2014年5月1日我院胃腸外科20例手術切除的結腸癌患者腫瘤組織、癌旁組織及距癌組織邊緣>5 cm的正常結腸組織,標本切除后,部分立即放入液氮,備RNA提取使用;部分采用4%多聚甲醛固定、石蠟包埋,4 μm切片備免疫組化用。同時于我院病理科調取46例結腸癌組織石蠟塊行免疫組化分析。所有患者術前未進行放、化療等抗腫瘤治療,所有標本均經術后病理確診。本組46例結腸癌患者中,男36例,女 10 例,年齡 17~70(54.36±10.30)歲,中位年齡55歲。結腸癌的分期按照2010年第7版國際抗癌協會制定的TNM分期標準。
1.2 主要試劑 總RNA提取試劑盒購于百泰克生物科技有限公司,逆轉錄試劑盒及RT-qPCRSYBR GreenⅠ檢測試劑盒購于TaKaRa公司,兔抗人Spn抗體購于北京博奧森生物技術有限公司,免疫組化SP檢測試劑盒及DAB顯色試劑盒購于北京中杉金橋生物技術有限公司。
1.3 RNA提取及RT-PCR 用Trizol從結腸癌組織和癌旁組織樣本中提取總RNA,濃度及純度用分光光度計檢測,然后按照試劑盒說明將RNA反轉錄為cDNA。RT-PCR中Spn引物序列參考文獻[8],forward 5'-GCCCAGCTAATTCAGCAGAC-3',reverse 5'-GGAG CTCCTTGAACTTGTGC-3';及內參GAPDH引物序列為 ,5'-GACTCATGACCACAGTCCATGC-3'(forward),5'-AGAGGCAGGGATGATGTTCTG-3'(reverse)。 每 個實驗重復3次。取2 μg總RNA行RT-PCR,按試劑盒說明操作。 mRNA 相對表達量=2-△△Ct,△Ct=Ct目的基因-Ct內參,△△Ct=△Ct癌-△Ct癌旁。
1.4 免疫組化 按照免疫組化SP檢測試劑盒說明書操作:結腸癌石蠟切片用二甲苯脫蠟,然后梯度酒精水化,用pH值為6的0.01 mol/L枸櫞酸鈉溶液在95℃抗原修復10 min,加入1∶100兔抗人Spn單克隆抗體4℃冰箱過夜,PBS洗3次,5 min/次;然后加入二抗室溫作用30 min,DAB顯色,蘇木素復染,透明采用二甲苯溶液,封片用中性樹膠。采用空白一抗作為陰性對照;用已知Spn蛋白表達陽性的乳腺癌切片作陽性對照。
[7]方法評估染色結果,采用染色百分比與染色強度相結合方法。染色百分比評分:0為沒有細胞染色,1為1%~10%細胞染色,2為11%~50%細胞染色,3為51%~80%細胞染色,4為>80%細胞染色;染色強度評分:0為陰性,1為弱陽性,2為中等,3為強陽性。染色百分比與染色強度評分結果相乘,總分為0~12分,總分≤6為陰性,>6為陽性。病理閱片結果不一致時,由兩位有經驗的病理醫師重新評估并協商確定。
1.5 Western blot 提取結腸癌與癌旁組織Spn蛋白,取50 μg蛋白做10%SDS-PAGE電泳,轉膜采用聚二氟乙烯(PVDF)膜,采用5%脫脂奶粉封閉2 h,TBST 洗膜 3 次,15 min/次,然后加入兔抗人 Spn(1∶100)及內參抗體 GAPDH (1∶1000),4 ℃搖床過夜。TBST 洗膜后加入相應 HRP 標記的二抗(1∶2000),室溫孵育2 h,然后采用ECL化學發光試劑盒進行發光顯影。
1.6 統計學方法 應用SPSS 17.0統計軟件進行統計學分析,計量數據以x±s表示,比較采用t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 結腸癌及癌旁組織中Spn表達情況 Q-PCR檢測結果表明,20例結腸癌組織及癌旁組織中,Spn的mRNA僅在2例增高,增高率為10%;Spn的mRNA 在結腸癌組織相對表達量為 1.03±0.16,而在癌旁組織中相對表達量為 3.86±0.32。免疫組化檢測結果提示,Spn蛋白主要定位于細胞漿或胞膜,呈淡黃至棕黃,團塊或片狀分布,癌組織中呈弱陽性或不著色。癌旁組織的Spn陽性率為90%(18/20),明顯高于結腸癌組織的 43.5%(20/46)(圖 1)。 Western blot顯示結腸癌旁組織Spn蛋白明顯高于結腸癌組織(圖 2)。

圖1 結腸癌旁組織及不同分化程度的結腸癌組織Spn表達(Envision×200)A:結腸癌旁組織Spn表達強陽性;B:高分化結腸癌組織中Spn表達較弱;C:低分化結腸癌組織Spn表達陰性

圖2 Western blot檢測結腸癌與癌旁組織Spn蛋白表達1:癌組織;2:癌旁組織
2.2 結腸癌組織中Spn低表達與臨床病理特征關系 46例結腸癌組織標本中,Spn低表達20例。分析Spn蛋白表達與患者臨床病理特征關系,發現Spn蛋白表達情況與患者性別、年齡無關,但與患者腫瘤分化程度(P=0.002)和浸潤情況(P=0.024)及淋巴結轉移情況(P=0.014)有關。盡管Spn蛋白表達與患者遠處轉移無統計學差異(P=0.141),但有轉移患者70.6%Spn蛋白陰性表達,明顯高于48.3%的無遠處轉移患者。見表1。
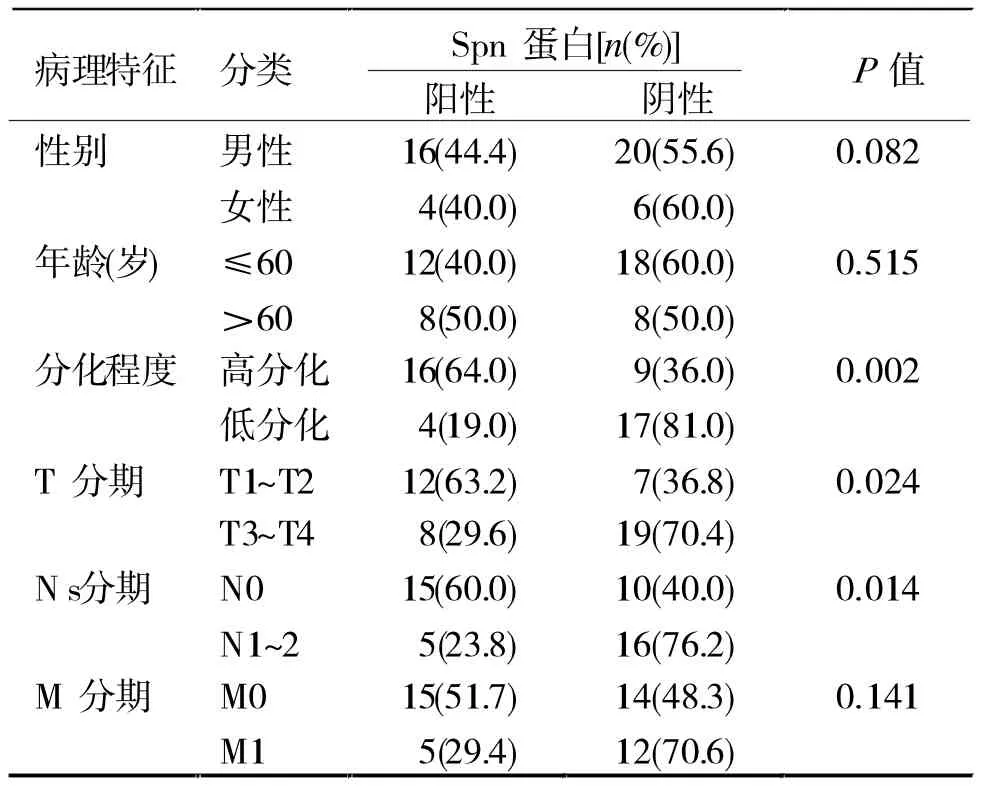
表1 Spn蛋白表達與結腸癌臨床病理特征的關系
3 討論
Spn定位于染色體17q21.33,目前研究發現這一區域含有較多的抑癌基因,包括BRCA1、NME1、prohibitin等,其突變被認為與惡性腫瘤發生有關[8]。目前17q21研究較多的是BRCA1,其突變在乳腺癌等惡性腫瘤中發揮重要作用。而最近研究發現,惡性腫瘤中Spn缺失可能在腫瘤發生中有重要的作用,在肺癌中報道Spn突變率高達53%[9]。但目前已知Spn可與多達30種蛋白相互作用,包括蛋白磷酸酶 1(protein phosphatase 1,PP1)及 F-actin。
其他的信號通路包括細胞骨架和細胞黏附分子、酶、G蛋白信號通路、膜受體、離子通路和腫瘤抑制蛋白ARF等。Spn也調節著跨膜蛋白,通過p70S6與細胞內的促有絲分裂的信號事件相關。Spn可導致pRb磷酸化,使pRb抑制腫瘤功能喪失有關,導致惡性腫瘤增殖。Spn可通過與PP1結合形成復合體,抑制PP1磷酸酶活性,通過干擾線粒體紡錘體,導致膠質瘤細胞死亡。本研究發現,結腸癌組織中Spn表達較癌旁明顯減低,而且分化較差的結腸癌組織中Spn表達較分化高的Spn蛋白表達低,表明結腸癌中存在Spn缺失,而且Spn缺失與結腸癌惡性進展密切相關。
P53突變可能與Spn缺失導致惡性腫瘤進展密切相關,Spn缺失可促進腫瘤發展,Spn缺失同時合并P53缺失可明顯促進腫瘤發展。在肺癌中,Spn缺失伴隨著明顯的P53突變。P53突變促進Spn缺失致腫瘤發生的機制可能與P53增殖抑制作用喪失,導致Spn缺失使惡性腫瘤細胞增殖密切相關。而結腸癌中P53突變率高達50%,P53突變導致腫瘤細胞化療藥物耐藥,與P53調亡作用喪失有關,提示結腸癌中P53突變可能更加促進Spn缺失導致的結腸癌細胞增殖,促進結腸癌進展。
惡性腫瘤中Spn表達降低的機制除了堿基缺失及基因突變外,研究發現miRNA調控異常也是重要原因。目前發現miRNA-106a可靶向作用于Spn,惡性腫瘤中miRNA-106a與Spn存在相反的關系,miRNA-106a表達增高可促進Spn表達減低,促進惡性腫瘤發生、發展。
總之,本研究發現結腸癌中Spn表達較癌旁組織中低,而且低表達Spn與患者不良預后有關,表明Spn缺失可能在結腸癌惡性進展中發揮重要作用。通過調控Spn蛋白表達,可能對結腸癌的治療有一定的價值。
【參考文獻】
[1]Zheng ZX,Zheng RS,Z hang SW,et al.Colorectal cancer incidence and mortality in China,2010 [J].Asian Pac J Cancer Prev,2014,15(19):8455-8460.
[2]Coppede F,Lopomo A,Spisni R,et al.Genetic and epigenetic biomarkers for diagnosis,prognosis and treatment of colorectal cancer[J].World J Gastroenterol,2014,20(4):943-956.
[3]Mohajeri G,Mohajeri MR,Afshar-Moghaddam N,et al.The significance of clinicopathological aspects of tumor for the detection of liver micrometastasis in patients with colorectal cancer[J].J Res Med Sci,2014,19(5):410-413.
[4]Bilir C,Engin H,Temi YB.Effect of gender on coagulation functions:a study in metastatic colorectal cancer patients treated with bevacizumab,irinotecan,5-fluorouracil,and leucovorin[J].Adv Hematol,2014,13(5):473-482.
[5]Carnero A.Spinophilin:a new tumor suppressor at 17q21[J].Curr Mol Med,2012,12(5):528-535.
[6]Aigelsreiter AM,Aigelsreiter A,Wehrschuetz M,et al.Loss of the putative tumor suppressor protein spinophilin is associated with poor prognosis in head and neck cancer[J].Hum Pathol,2014,45(4):683-690.
[7]Aigelsreiter A,Ress AL,Bettermann K,et al.Low expression of the putative tumour suppressor spinophilin is associated with higher proliferative activity and poor prognosis in patients with hepatocellular carcinoma [J].Br J Cancer,2013,108(9):1830-1837.
[8]Ferrer I,Peregrino S,Canamero M,et al.Spinophilin loss contributes to tumorigenesis in vivo[J].Cell Cycle,2011,10(12):1948-1955.
[9]Molina-Pinelo S, Ferrer I, Blanco-Aparicio C, et al.Down-regulation of spinophilin in lung tumours contributes to tumourigenesis[J].J Pathol,2011,225(1):73-82.

