桑葉不同提取部位對α-葡萄糖苷酶抑制活性體外研究
唐明敏,劉洋,田思敏,馬曉云,隗麗,程笑,趙保勝(北京中醫藥大學中藥學院,北京000;北京中醫藥大學科研實驗中心,北京0009)
桑葉不同提取部位對α-葡萄糖苷酶抑制活性體外研究
唐明敏1,劉洋1,田思敏1,馬曉云1,隗麗1,程笑1,趙保勝2
(1北京中醫藥大學中藥學院,北京100102;2北京中醫藥大學科研實驗中心,北京100029)
目的建立體外α-葡萄糖苷酶抑制活性評價體系,觀察桑葉不同提取物對α-葡萄糖苷酶的抑制作用。方法經大鼠小腸獲得α-葡萄糖苷酶,以4-硝基苯基-α-D-吡喃葡萄糖苷(pNPG)為底物,以阿卡波糖(Acarbose)為陽性對照,測定桑葉水提液(WE)、水提上清液(AP-A)、水提沉淀(AP-P)及75%乙醇提取液(EE)對α-葡萄糖苷酶活性抑制作用。結果桑葉不同提取液均有α-葡萄糖苷酶抑制活性,不同提取液的半數抑制濃度(IC50)分別是WE:0.08 g/L;AP-A:0.17 g/L;AP-P:0.42 g/L;EE:0.12 g/L;桑葉提取液α-葡萄糖苷酶抑制活性強弱順序為: WE>AP-A>EE>AP-P,其中WE IC50小于Acarbose(0.11 g/L)。結論桑葉水提液抑制α-葡萄糖苷酶活性作用最強,為桑葉在該機制發揮降糖作用的主要活性部位,體外α-葡萄糖苷酶活性抑制評價體系可作為該藥效成分篩選平臺。
桑葉;α-葡萄糖苷酶抑制劑;1-脫氧野尻霉素DNJ;半數抑制濃度IC50
α-葡萄糖苷酶為小腸黏膜二糖酶的一種類型,絕大部分附著于小腸絨毛刷狀緣的粘膜表面,小腸絨毛兩側酶的活性最高[1]。為了降低餐后血糖,避免葡萄糖穩態異常,從而降低糖尿病、肥胖病、高脂血癥(Ⅳ型)等疾病的微血管并發癥及心血管疾病的發作風險,20世紀70年代后期研發出了α-葡萄糖苷酶抑制劑,如拜糖平等[2],其作用機制為競爭性的抑制α-葡萄糖苷酶,從而減緩碳水化合物降解為單糖的速度,降低餐后血糖水平。
研究表明,桑葉具有顯著的α-葡萄糖苷酶抑制活性,其中1-脫氧野尻霉素(DNJ)為主要活性成分,該化合物為生物堿類化合物,可在水提液中富集[3]。此外,桑葉中多糖類[4]、黃酮類[5]也顯示有α-葡萄糖苷酶抑制活性。近年來,結合色譜、質譜、核磁等技術從桑葉中篩選了一部分α-葡萄糖苷酶抑制劑單體,如氧化白藜蘆醇、黃芪苷、蘆丁等[6]。
本實驗建立了α-葡萄糖苷酶體外反應體系,對桑葉不同處理方式獲得的提取部位的體外α-葡萄糖苷酶抑制活性進行了評價,為后續活性成分篩選研究提供參考。
1 材料與方法
1.1 材料桑葉藥材購買于北京仟草中藥飲片有限公司;拜糖平,拜耳醫藥保健有限公司生產。對硝基苯-α-D-葡萄糖吡喃苷(pNPG),對硝基苯酚,購買于江萊生物有限公司;血清清蛋白(BSA)、HEPES,購買于Sigma公司;其他試劑均為分析純。
1.2 儀器酶標儀(Multiskan Ascent美國Thermo公司),電動玻璃勻漿機(DY89-Ⅱ寧波新芝生物科技股份有限公司生產),混合器(QL-866浙江海門市其林貝爾儀器廠),離心機(1-15PK德國Sigma公司),真空干燥箱(DZ-2BC南京遠拓科學儀器有限公司),智能溶出儀(ZRS-8G天津大學無線電廠),電子天平(BSA124S賽多利斯科學儀器有限公司)。
1.3 實驗動物SPF級SD大鼠,雄性,體質量280~300 g,由斯貝福(北京)實驗技術有限公司提供,合格證號:SCXK(京)2011-0004。動物飼養于北京中醫藥大學實驗動物部標準屏障環境內,許可證號: SYXK(京)2011-0024,自由飲食,明暗節律12 h/ 12 h。
1.4 方法
1.4.1 桑葉不同提取物制備30 g桑葉藥材,加12倍量水浸泡30 min,加熱回流90 min,過濾,濾渣加10倍量水回流60 min后,過濾,合并兩次濾液,得桑葉總水提物(WE);取部分水提液濃縮,加入95%乙醇至含醇量為60%,靜置24 h以上,3 000 r/min,離心15min,取上清液回收乙醇至無醇味,得桑葉水提上清液部位(AP-A);沉淀為桑葉水提沉淀部位(APP);桑葉藥材加75%乙醇,方法同WE回流提取得桑葉醇提物(EE)。
1.4.2 大鼠小腸α-葡萄糖苷酶制備雄性大鼠,禁食12 h,麻醉,腹主動脈取血致死,取胃幽門以下小腸約15 cm,預冷的生理鹽水沖洗2次,刮取黏膜層,按1∶10比例加入0.5 mol/L NaCl-KCl溶液,勻漿。于4℃,10 000 r/min,離心30 min,棄上清液,沉淀用預冷的生理鹽水洗沖2次,4℃,10 000 r/min,離心30 min,最后沉淀按體積1∶5用生理鹽水稀釋后,于4℃,500 r/min,離心10 min,取上清液,考馬斯亮藍法測定上清液蛋白含量,-20℃保存備用[7-9]。
1.4.3 α-葡萄糖苷酶反應體系優化[10]
1.4.3.1 對硝基酚濃度-吸光度標準曲線分別吸取濃度為2 mmol/L的對硝基苯酚20、40、80、120、160、200、240μL,并分別加入400μL Na2CO3及一定體積67 mmol/L磷酸緩沖液至總體積為750μL,樣品溶液置于96孔板中,405 nm處測定吸光度。以對硝基苯酚濃度為橫坐標,405 nm處吸光度為縱坐標,作標準曲線。
1.4.3.2 蛋白濃度-酶活力標準曲線取10 mmol/L對-硝基苯酚-α-吡喃葡萄糖苷(pNPG)底物溶液50μL,分別加入不同濃度的大鼠小腸粘膜α-糖苷酶提取液50μL(0.21、0.42、0.62、0.83、1.03、1.65 mg/mL),反應30 min,405 nm處測定吸光度值,計算α-葡萄糖苷酶活力,觀察酶濃度對酶活力的影響。
1.4.3.3 底物濃度-酶活力曲線在體系中加入50μL酶液(0.62 mg/mL),并加入不同體積pNPG,使底物終濃度為0.33、0.83、1.67、2.08、2.92、3.75、5.00、6.67、8.33、10.00 mmol/L,觀察不同底物濃度對酶活力的影響,Lineweaver-Burk作圖法計算該酶的Km。
1.4.4 桑葉提取物體外α-葡萄糖苷酶抑制試驗
取50μL腸提取液加入67 mmol/L磷酸鹽緩沖液(pH 6.8),37℃水浴溫孵10min,加入桑葉提取物飽和5 min后再加入100μL pNPG(10 mmol/L),體系總體積為350μL,水浴30 min后,加入0.1 mol/L Na2CO3400μL終止反應。樣品溶液置于96孔板中用酶標儀于405 nm處測定吸光度,每組反應平行做3次。同時設立陽性對照(相應濃度的阿卡波糖),陰性對照(不加抑制劑,補充緩沖液)和空白對照(不加底物和抑制劑,補充緩沖液)計算抑制率,并繪制不同濃度提取物抑制率曲線,計算IC50。
抑制率(%)=[(A陰性-A試樣)/(A陰性-A空白)]×100%。
此外,酶活力定義為37℃,pH 6.8條件下,酶蛋白每分鐘催化1μmol對硝基苯酚生成為一個活力單位。
2 結果
2.1 α-葡萄糖苷酶體外反應體系優化
2.1.1 對硝基苯酚標準曲線如圖1所示,對硝基苯酚在8~88mol/L濃度范圍內線性良好(r=0.999 9)。2.1.2最適蛋白濃度考馬斯亮藍法測定大鼠小腸提取液的蛋白含量為:1.65 mg/m L,結果顯示在酶反應體系中,蛋白終濃度在0.03~0.28 mg/mL范圍內與酶的活力呈線性(r=0.987 9),根據實驗實際情況選擇蛋白終濃度為0.17 mg/mL,如圖2。
2.1.3 最適底物濃度酶活力隨著底物濃度的增大,變化速率減緩,最終選擇3.3 mmol/L底物終濃度為反應最適濃度,如圖3。此外,Lineweaver-Burk作圖結果顯示,37℃,pH 6.8條件下,以對-硝基苯基-α-吡喃葡萄糖苷為底物,α-葡萄糖苷酶Km值為1.8±0.2 mmol/L,如圖4。
2.1.4 最適反應時間根據酶活力-時間曲線,如圖5顯示,產物生成量在10~60 min內呈良好的線性(r=0.997 9),根據酶活力檢測及操作可行性,酶反應終止時間選擇為30min。
2.2 桑葉提取物對α-葡萄糖苷酶活性的抑制作用對生藥濃度為0.062 5、0.250 0、0.500 0、0.750 0、1.000 0 g/L的桑葉不同提取物進行α-葡萄糖苷酶的抑制率測定,根據測定結果繪制抑制率曲線并計算IC50,如圖6,表1。比較各提取物IC50結果顯示,α-葡萄糖苷酶抑制活性強度順序為WE>AP-A>EE>AP-P,其中,水提液活性較阿卡波糖高,為活性最高的提取物,水提液上清液活性較沉淀高,表明桑葉水提物中α-葡萄糖苷酶抑制活性成分可能大多存在于上清液中。此外,桑葉75%醇提液也存在一定的α-葡萄糖苷酶抑制活性,但是較水提液活性低,水提仍然為桑葉在進行此方面研究的最佳提取方式。

表1 桑葉提取物不同部位對α-葡萄糖苷酶抑制率
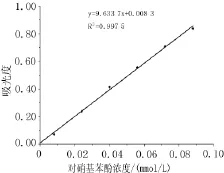
圖1 對硝基苯酚標準曲線

圖2 蛋白濃度與酶活力的關系

圖3 底物濃度與酶活力關系

圖4 1/Vma x-1/[S]關系圖
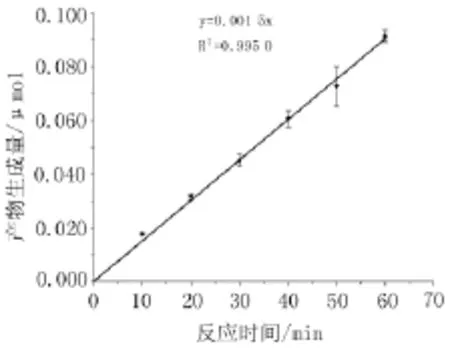
圖5 反應時間與產物生成量
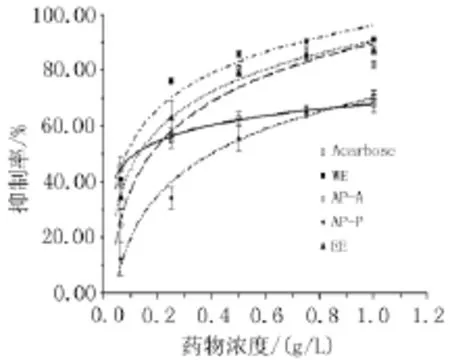
圖6 桑葉不同提取物對α-葡萄糖苷酶的抑制
3 討論
桑葉降糖作用的有效成分(部位)已有許多報道,其中以DNJ為代表的生物堿類成分為主要活性組分,桑葉水提物中含有較多的DNJ,75%醇提物主要存在黃酮、酚類化合物[3],其水提沉淀可能主要以多糖類成分為主,本實驗證明這些成分均存在一定的α-葡萄糖苷酶抑制活性。中藥具有“多成分、多靶點、多途徑”綜合起效的作用特點,而“多成分”的問題為首要問題,并不是所有成分都能起效,都可到達靶點部位,因此有必要進一步明確暴露于靶點部位的成分種類及效量。
“暴露-反應-機制”三聯研究模式為中醫藥現代化研究提供創新性研究方法,一方面,藥物的體內暴露成分是產生反應的物質基礎,在藥物作用靶標定位明確的基礎上,可通過各種手段明確中藥產生作用的“反應成分組”和不產生作用的“無反應成分組”[11]。
本研究結果顯示,桑葉不同提取部位IC50比較,水提液抑制作用最強,該提取方式仍可做為桑葉在α-葡萄糖苷酶抑制活性研究的首選提取方式,也符合桑葉傳統的水煎煮入藥方式,水提液中的“暴露”成分與α-葡萄糖苷酶靶點接觸直接“反應”。水提液醇沉后,上清液較整體水提液抑制率有所下降,可將沉淀棄去,有針對性地提取保留與治療相關的有效成分,去除藥效拮抗成分和無作用成分,不僅可以提高療效、減少副作用,而且還可以大幅度縮小制劑劑量。水提醇沉法即可為桑葉提取工藝優化提供參考,也為下一步動物實驗、細胞實驗及分子機制研究提供適宜的物質基礎。另一方面,桑葉總水提液的抑制活性較上清液與沉淀高,可能為這兩部位的協同作用的最終結果。因此,在考慮單個“暴露”成分分離研究的同時,多成分配伍也應該被關注[12]。中藥藥物良好的成藥性是以適合有效組分和功能組分的最優化配置,通過篩選中藥有效組分的組成和功能組分的組成,最終開發中藥創新藥物[13-14]。
同時,本研究擬合了桑葉不同提取部位的α-葡萄糖苷酶抑制率曲線,反映了α-葡萄糖苷酶抑制活性隨藥物濃度的變化規律。與阿卡波糖對比,桑葉提取液在高濃度時抑制活性均高于阿卡波糖,桑葉在α-葡萄糖苷酶抑制活性方面存在較大潛質,各個類型的化合物可做為該方面深入研究的對象。但是,就抑制率曲線的趨勢來看,阿卡波糖α-葡萄糖苷酶活性抑制率隨藥物濃度變化率較小,桑葉提取液在該藥效發揮的過程中受藥物濃度變化較靈敏,這也是桑葉做為天然藥物在開發過程中需要克服的問題。
此外,實驗優化了α-葡萄糖苷酶活性體外評價體系,獲得了37℃,PH 6.8環境下以4-硝基苯基-α-D-吡喃葡萄糖苷(pNPG)為底物,大鼠腸α-葡萄糖苷酶酶促反應動力學研究的最適體系。酶促反應隨反應環境變化較靈敏,需根據具體實驗設計來確定反應體系,本研究則為α-葡萄糖苷酶酶促反應體外評價體系的建立提供了比較完整的方法學研究依據。
[1]Dahlqvist A.Localization of the small-intestinal disaccharidases[J].Am JClin Nur,1967,20(2):81-88.
[2]Puls W,Keup U,Krause HP,et al.Glucosidase inhibition.A new approach of the treatment of diabetes obesity and hyperlipoproteinaemia[J].Naturwiss,1977,64(10):536-537.
[3]Kim JY,Chung HI,Jung KO,et al.Chemical profiles and hypoglycemic activities ofmulberry leaf extracts vary with ethanol concentration[J].Food Sci.Biotechnol,2013,2(5):1-5.
[4]胡竟一,雷玲,劉亞歐,等.桑葉的α-葡萄糖苷酶抑制作用研究[J].中藥藥理與臨床,2006,22(6):44-45.
[5]Hong HC,Li SL,Zhang XQ,et al.Flavonoidswithα-glucosidase inhibitory activities and their contents in the leaves of Morus atropurpurea[J].Chinmed,2013,8(1):19-22.
[6]Tao Y,Zhang Y,Cheng Y,et al.Rapid screening and identification ofα-glucosidase inhibitors from mulberry leaves using enzymeimmobilized magnetic beads coupled with HPLC/MS and NMR[J].Biomed Chromatogr,2013,27:148-155.
[7]Dahlqvist A.Method for assay of intestinal disaccharidases[J].A-nal Biochem,1964,7(1):18-25.
[8]張冉,劉泉,申竹芳,等.應用α-葡萄糖苷酶抑制劑高通量篩選模型篩選降血糖中藥[J].中國藥學雜志,2007,10(24): 740-743.
[9]Marshall T,Williams KM.Coomassie blue protein dye-binding assaysmeasure formation of an insoluble protein-dye comp lex[J].Anal Biochem,1992,24(1):107-109.
[10]Hao H,Lu YH.Comparison of inhibitory activities and mechanisms of fivemulberry plantbioactive components against α-glucosidase.[J].JAgric Food Chem,2013,61:8110-8119.
[11]趙保勝,劉洋,王晶娟,等.“暴露-反應-機制”三聯研究模式學術思想及其中醫藥領域應用[J].世界中醫藥,2014,12 (9):1234-1237,1240.
[12]劉洋,潘艷麗,王晶娟,等.多成分藥物代謝理論及技術方法分析[J].中草藥,2014,45(12):1663-1667.
[13]張涓,張晶晶,程江雪,等.清熱藥體外抗菌作用的文獻再評價[J].川北醫學院學報,2013,28(1):23-26.
[14]賈曉斌,陳彥,李霞,等.中藥復方物質基礎研究新思路和方法[J].中華中醫藥雜志,2008,30(5):420-425.
α-glucosidase inhibition by different extracts of folium mori in vitro assay
TANG Mingm in1,LIU Yang1,TIAN Sim in1,MA Xiaoyun1,YU Li1,CHENG Xiao1,ZHAO Baosheng2
(1College of Chinese Materia Medica,Beijing University of Chinese Medicine,Beijing 100102,China;2Center of Scientific Experiment,Beijing University of Chinese Medicine,Beijing 100029,China)
Objective To establishα-glucosidase inhibitory activity evaluation in vitro system,and study the activity ofα-glucosidase inhibitation of differentmulberry extracts.Methods The experimentwas carried outwith 4-nitro phenol-α-D-glucopyranoside(pNPG)as substrate tomeasurewater extractofmulberry leaves(WE),water extraction supernatant(AP-A),precipitation(AP-P)and 75%ethanol extract(EE)for the inhibitory activity ofαglucosidase obtained from small intestine in rats.Resu lts All mulberry leaves extracts haveα-glucosidase inhibitory activity,and the concentrations of IC50of the extracts are as follows:WE:0.09 g/L;AP-A:0.18 g/L; AP-P:0.40 g/L;EE:0.25 g/L;that is,WE>AP-A>EE>AP-P,where IC50ofWE was less than Acarbose(0.16 g/L).Conclusion The water extraction ofmulberry leaf has the strongestα-glucosidase inhibition activity which plays the role on themechanism of hypoglycemic as principal components.The evaluation system ofα-glucosidase inhibition activity in vitro provided a platform for screening the compounds ofα-glucosidase inhibition.
Mulberry leaves;α-glucosidase inhibitors;DNJ;IC50
R963
A
1009-5551(2015)06-0711-04
10.3969/j.issn.1009-5551.2015.06.012
2015-01-05]
(本文編輯施洋)
國家自然科學基金(81374027)
唐明敏(1992-),女,在讀碩士,研究方向:多成分藥物代謝與新藥研發。
趙保勝,男,博士,副教授,碩士生導師,研究方向:中藥藥效與物質基礎研究,E-mail:zhaobs1973@163.com。

