“點(diǎn)、線、面”三維視角認(rèn)識離子積和溶度積曲線
王波 董厚方

離子積帶數(shù)和溶度積常數(shù)是電解質(zhì)溶液的難點(diǎn),特別是離子積、溶度積曲線,既考查化學(xué)原理的理解,又滲透化學(xué)圖像的分析。現(xiàn)結(jié)合典型試題,從“點(diǎn)、線、面”三個層面對離子積和溶度積曲線進(jìn)行分析。
一、水的離子積曲線
水的離子積,水的離子積曲線是溶液中與關(guān)系的曲線。
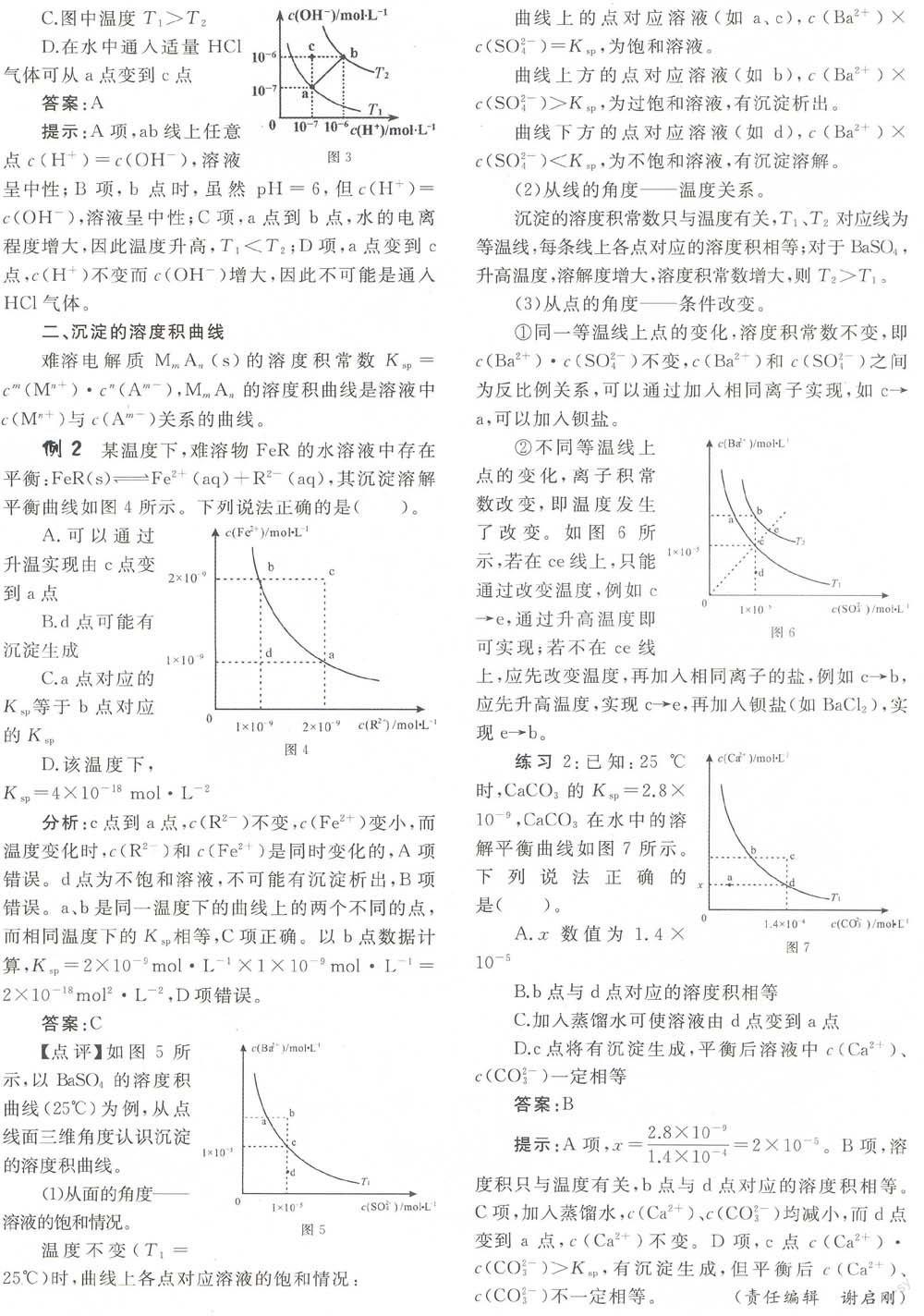
例1一定溫度下,水溶液中H+和OH-的濃度變化曲線如圖1,下列說法正確的是()。
A.升高溫度.可能引起由c向1)的變化
B.該溫度下,水的離子積常數(shù)為1.0×10”
C.該溫度下,加入FeCl3可能引起由b向a的變化
D.該溫度下,稀釋溶液可能引起m c向d的變化
分析:A項.圖中曲線上的點(diǎn)代表某溫度下的水的電離.升高溫度,水的離子積常數(shù)發(fā)生改變,所以升溫不可能引起由c向b的變化,錯誤。B項,b點(diǎn)對應(yīng)的,錯誤。C項,水解顯酸性,而圖中a點(diǎn),正確。D項,C和d的溫度不同,所以稀釋不會引起由c向d的變化,錯誤。
答案:C
【點(diǎn)評】如圖2所示,從點(diǎn)線面三維角度認(rèn)識水的咆離平衡曲線。
(1)從面的角度——溶液酸堿性。
ab線上,溶液呈中性,ab線以上,溶液呈堿性,ab線線以下,溶液呈酸性。
(2)從線的角度——溫度關(guān)系。
水的離子積只與溫度有關(guān),T1、T2對應(yīng)線為等溫線,每條線上各點(diǎn)對應(yīng)的離子積相等;水的電離吸熱,升高溫度,水的電離程度增大.水的離子積增大,則T2>T1,。
(3)從點(diǎn)的角度—一條件改變。
①同一等溫線上點(diǎn)的變化,離子積常數(shù)不變,即不變,和之間為反比例關(guān)系,可以通過加入酸堿鹽,如a→b可以加入HCL等酸或加入AICI3,等強(qiáng)酸弱堿鹽。
②不同等溫線上點(diǎn)的變化,離子積常數(shù)改變,即溫度發(fā)生了改變。若……

