全面剖析“酸堿中和滴定”為2016年高考化學把脈
2015-05-30 23:13:28朱紅文
中學生數理化·高三版
2015年9期
關鍵詞:實驗
朱紅文


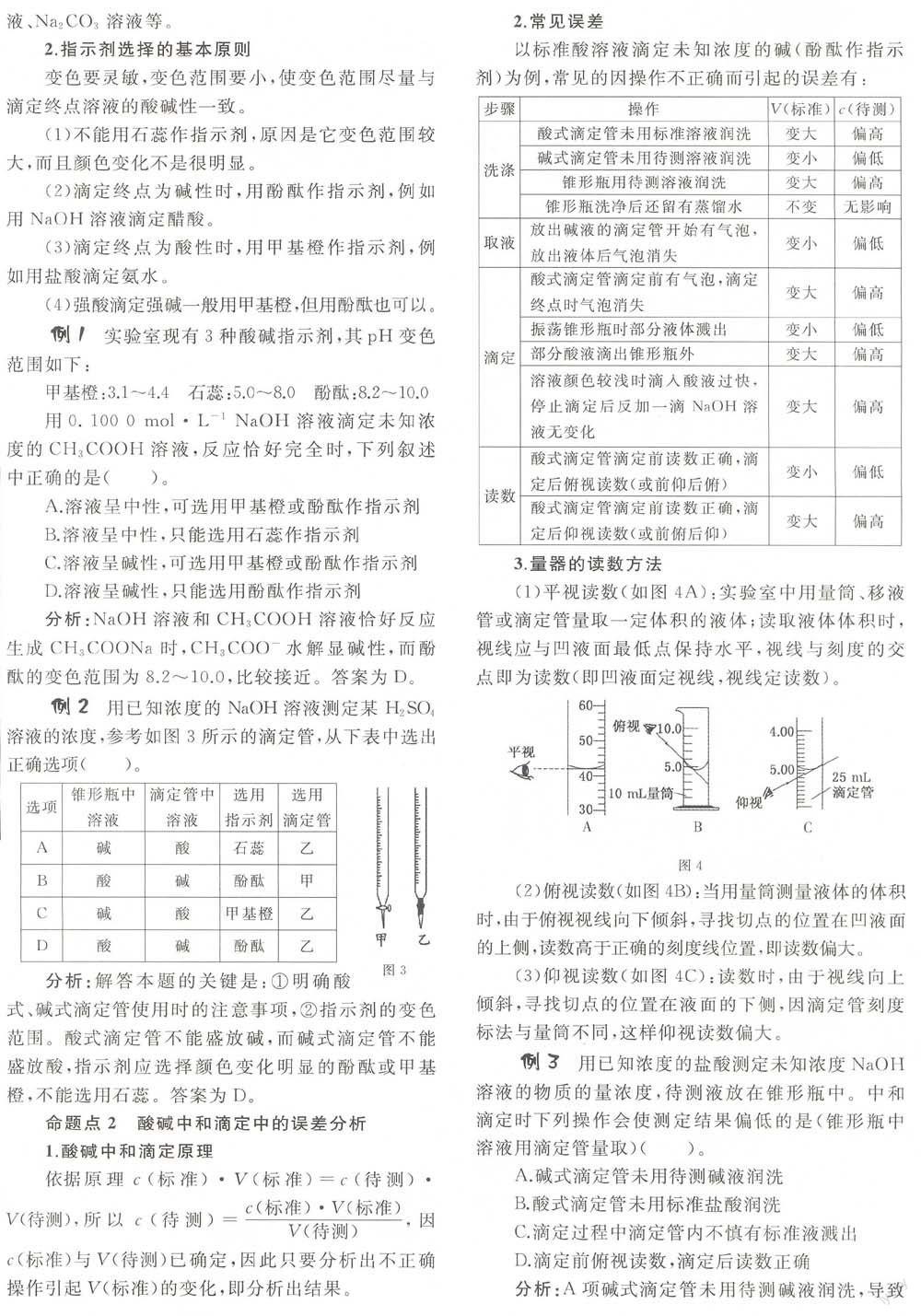
酸堿中和滴定實驗是高中化學中的定量實驗,高考中常常以酸堿中和滴定實驗的基本原理進行氧化還原滴定、沉淀滴定的考查等,而另一種常見的考查方式就是酸堿中和滴定實驗的一些基本操作、誤差分析、化學計算等。所以中和滴定在高考當中具有重要地位,我們要對它給予重視。下面我們就來對它進行一次全面而細致的理解。
1.實驗原理
(1)用已知濃度的酸(或堿)滴定未知濃度的堿(或酸),根據中和反應的等量關系來測定酸(或堿)的濃度。
(2)利用酸堿指示劑明顯的顏色變化,表示反應已完全,指示滴定終點。
2.實驗用品
(1)儀器:酸式滴定管(如圖1A)、堿式滴定管(如圖1B)、滴定管夾、鐵架臺、錐形瓶。
(2)試劑:標準液、待測液、指示劑、蒸餾水。
(3)滴定管的使用:
3.實驗操作(以標準鹽酸滴定待測NaOH溶液為例)
(1)滴定前的準備:
(2)滴定:如圖2。
(3)終點判斷:等到滴人最后一滴標準液,溶液由紅色變為無色,且在半分鐘內不恢復原來的顏色,視為滴定終點并記錄標準液的體積。
(4)操作步驟:
①儀器的洗滌:
滴定管(或移液管):自來水一蒸餾水→待裝溶液潤洗。
錐形瓶:自來水→蒸餾水(禁止用所裝溶液洗滌)。
②裝液調整液面:
裝液,使液面一般高于“O”刻度,驅除玻璃尖嘴處的氣泡。
③讀數:調整液面在“O”刻度或“0”刻度以下.讀出初讀數,滴定終點,讀出末讀數。
4.數據處理
按上述操作重復二至三次,求出用去標準鹽酸體積的平均值,根據計算。
命題點1 酸堿中和滴定中儀器、指示劑的選擇
1.滴定管的選擇
盛放強氧化性溶液、酸性溶液時選擇酸式滴定管,如酸性高錳酸鉀溶液、硝酸溶液、稀硫酸等。……
登錄APP查看全文
猜你喜歡
作文·小學低年級(2025年2期)2025-02-13 00:00:00
小雪花·小學生快樂作文(2024年11期)2024-12-31 00:00:00
作文·小學低年級(2024年2期)2024-04-29 00:00:00
作文·小學低年級(2023年3期)2023-04-29 00:00:00
小獼猴智力畫刊(2022年9期)2022-11-04 02:31:42
小主人報(2022年4期)2022-08-09 08:52:06
小哥白尼(趣味科學)(2019年6期)2019-10-10 01:01:50
發明與創新(2016年38期)2016-08-22 03:02:52
太空探索(2016年5期)2016-07-12 15:17:55
實驗流體力學(2011年5期)2011-01-14 01:25:28

