氚照射對大鼠海馬神經細胞黏附分子L1、NCAM表達的影響
王永生,姚曉波,蔡二朋,邱 俊,吳翠萍,王明明
氚照射對大鼠海馬神經細胞黏附分子L1、NCAM表達的影響
王永生1,姚曉波2,蔡二朋3,邱 俊4,吳翠萍5,王明明1
目的探討低劑量氚照射對大鼠海馬神經細胞黏附分子L1、神經細胞黏附分子(NCAM)表達的影響。方法取24 h新生鼠腦海馬細胞培養,培養第7天以3.7×102、3.7×103、3.7×104、3.7×105、3.7×106Bq/m l終濃度氚水照射細胞24 h,并設對照組(0 Bq/m l),活細胞工作站測定各處理組細胞的遷移距離;Western blot法、免疫細胞化學法檢測各濃度氚水照射下神經細胞黏附分子L1及NCAM蛋白的表達情況。結果神經細胞遷移距離測定結果顯示,與對照組相比,受照組細胞遷移距離明顯縮短,且隨著氚水濃度的不斷增加而逐漸縮短(P<0.05);Western blot法、免疫細胞化學法檢測顯示受照組神經細胞黏附分子L1、NCAM蛋白表達含量均低于對照組,并隨氚水濃度的升高表達量呈遞減趨勢(P<0.05)。結論氚照射可致神經細胞黏附分子表達量減少進而可影響神經細胞的正常遷移。
大鼠;氚水;神經細胞黏附分子;神經細胞
腦中樞神經系統發育時期是哺乳動物胚胎發育的關鍵階段,有研究[1,2]表明這個時期的孕鼠暴露于低濃度氚水輻射下其后代會出現特征性的大腦皮質畸形以及成年后行為表現異常。日本原爆幸存者輻射流行病調查[3]表明,胎齡8~15周受照幸存者神經元前體細胞增殖及增殖后的細胞從腦室遷移至大腦皮層的進程受到抑制,出現嚴重智力障礙。神經細胞的遷移過程涉及多種遷移相關因子參與,在這些遷移相關因子中神經細胞黏附分子L1、神經細胞黏附分子(neural cell adhesion molecule,NCAM)作為細胞遷移受體分子在神經細胞軸突生長、神經纖維成束、突觸可塑性等方面發揮重要作用[4],而低濃度氚水β輻射對神經細胞黏附分子表達的影響鮮有報道。為此,該研究從神經細胞黏附分子L1、NCAM受低濃度氚水輻射后的表達情況來探討氚對腦發育期間神經細胞遷移的影響及機制。
1 材料與方法
1.1 材料
1.1.1 實驗動物 72只SPF級Sprague-Dawley(SD)大鼠,3月齡,購自常州卡文斯實驗動物有限公司,大鼠均飼養于本實驗室動物房。
1.1.2 試劑及儀器 氚水(中國原子能科學研究院);DMEM/F12(1∶1)和B27(美國Gibco公司);EGF、bFGF、胰蛋白酶、多聚賴氨酸(Poly-L-lysine)、阿糖胞苷(Ara-c)、蘇木精(美國Sigma公司);新生小牛血清(杭州四季青生物工程材料有限公司);L1及NCAM抗體(英國Abcam公司);二抗羊抗兔IgG(北京博奧生物有限責任公司);β-actin抗體、HRP標記的羊抗小鼠IgG抗體、免疫組化試劑盒、DAB顯色試劑盒(北京中杉金橋生物技術有限公司);水合氯醛(上海生物工程有限公司);SW-CJ-1F型超凈工作臺(蘇州凈化設備有限公司);BX-52型光學顯微鏡成像系統(日本佳能公司);XS-212-201型光學顯微鏡(南京光電集團股份有限公司);2123型CO2孵箱(美國Shellab公司);Leica AF 6000活細胞工作站。
1.2 方法
1.2.1 海馬神經細胞的原代培養 取24 h內的新生SD大鼠,性別不限,置于無菌操作室內,剝離出海馬組織,并用預冷PBS液沖洗后備用。將所獲得的新生大鼠海馬組織放入無菌玻璃皿中,用眼科剪將其適量剪碎后加入0.125%胰蛋白酶消化20 min,加入同等體積胎牛血清終止消化。將消化后的液體裝入一無菌小玻璃瓶放入低速離心機(1 000 r/min),離心5 min后在無菌操作臺上棄去上清液,重新懸浮細胞,用血細胞計數板計數后分別接種在不含蓋玻片和含蓋玻片的6孔板中(6孔板已提前使用0.25%的多聚賴氨酸包被,滅菌雙蒸水清洗3遍),種植密度5×106/皿,加入培養基4 ml,置于37℃、5%CO2飽和濕度的培養箱中。培養24 h后,將培養液半換液,培養第3天時,加入阿糖胞苷(終濃度為3μg/ml),24 h后去除。此后每2~3 d全換液1次。
1.2.2 細胞照射和培養 將培養的神經細胞經NF160免疫組化染色證實純度達90%以上。培養7 d后加入氚水使各培養孔氚水終濃度分別為3.7× 102、3.7×103、3.7×104、3.7×105、3.7×106Bq/ml,照射24 h后進行實驗,同時設細胞對照組。
1.3 活細胞工作站測定細胞遷移距離用Leica AF 6000活細胞工作站分別觀察各處理組神經細胞的遷移情況,各處理組觀察3個細胞,每個細胞觀察時間為8 h,結果用LAS-AF-LITE 2.3.0軟件進行分析。
1.4 Westernblot法檢測L1、NCAM蛋白的表達
1.4.1 總蛋白提取及蛋白質定量 收集各實驗組神經細胞,用預冷的PBS漂洗2~3次,按總蛋白提取試劑盒說明書步驟提取神經細胞內蛋白質。將總蛋白提取液取5μl樣品加入995μl超純水,于分光光度計下測量樣本的各組蛋白質濃度。根據測出的樣品蛋白濃度將其進行稀釋,使各組樣本的蛋白質終濃度一致。加入等體積蛋白上樣緩沖液混合煮沸8 min,適量分裝,-80℃保存備用。
1.4.2 Western blot步驟 配置10%分離膠和5%濃縮膠,取20μl總蛋白上樣,經十二烷基硫酸鈉-聚丙稀酰胺凝膠(SDS-PAGE)電泳后,轉移到PVDF膜上,5%脫脂奶封閉1~2 h,TBST洗3次;加入一抗L1(1∶1 000)、NCAM(1∶1 000);4℃封閉過夜,TBST洗3次;加二抗羊抗兔IgG(1∶5 000)室溫孵育1 h,TBST洗3次;ECL工作液發光顯影,定影晾干。
1.4.3 圖像分析 分別對各組Western blot結果進行圖像掃描,從各組隨機抽取3張掃描圖像,以Quantity-One生物醫學圖像分析系統進行目的條帶半定量分析,各條帶累積光密度(integral optical density,IOD)值/β-actin的IOD值,得到一相對強度(relative intensity,RI),通過各處理組RI值的比較可得出蛋白表達的變化規律。
1.5 免疫細胞化學染色法檢測L1、NCAM蛋白的表達4%多聚甲醛固定細胞,室溫15 min,0.5% TritonX-100孵育20 min,3%雙氧水封閉內源性過氧化物酶,室溫15 min,正常山羊血清處理,工作液室溫孵育10~15 min,棄去上清液,一抗于37℃孵育2~3 h,生物素化二抗37℃孵育10~15 min,辣根過氧化物酶標記的鏈親和素37℃孵育10~15min,DAB顯色,蘇木精復染細胞核,脫水,封片。常規設立陰性對照。各組每張蓋玻片分別任意選取3個不同視野的細胞,于400倍鏡下拍照,用Image Pro Plus軟件進行陽性染色的平均光密度值分析。免疫組織化學染色以細胞質和(或)細胞膜出現黃棕色顆粒為陽性。
1.6 統計學處理采用SPSS 16.0統計軟件進行分析,結果用±s表示,進行單因素方差分析(ANOVA),兩兩比較采用Dunnett-t檢驗。
2 結果
2.1 神經細胞遷移距離遷移距離測定結果顯示,與對照組相比,各受照組神經細胞遷移距離普遍縮短(F=47.553,P<0.01),并且隨著氚水濃度的逐漸升高呈現遞減的趨勢。見圖1、表1。
表1 不同濃度氚水照射下神經細胞的遷移距離(n=3
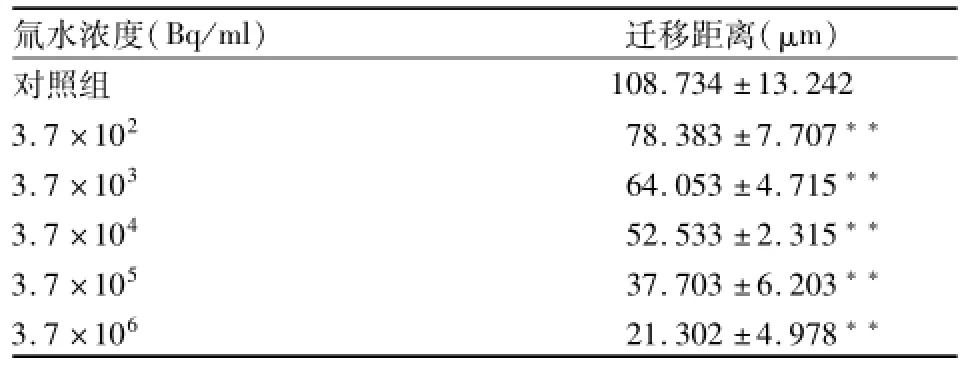
表1 不同濃度氚水照射下神經細胞的遷移距離(n=3
與對照組比較:**P<0.01
氚水濃度(Bq/m l)遷移距離(μm)對照組108.734±13.242 3.7×10278.383±7.707**3.7×10364.053±4.715**3.7×10452.533±2.315**3.7×10537.703±6.203**3.7×10621.302±4.978**
2.2 Westernblot檢測結果與對照組相比,受照組細胞隨著氚水濃度的增加,神經細胞表達的L1、NCAM蛋白含量逐漸降低,L1蛋白各組RI值比較,差異有統計學意義(F=74.520,P<0.01);NCAM蛋白各組RI值比較,差異有統計學意義(F=12.466,P<0.01)。見圖2。
2.3 免疫細胞化學染色法檢測結果與對照組相比,受照組神經細胞平均光密度值普遍低于對照組,并隨著氚水濃度的不斷增加而逐漸降低,神經細胞L1、NCAM蛋白平均光密度值比較,差異有統計學意義(F=53.968,P<0.01;F=19.736,P<0.01)。見圖3。
3 討論
在中樞神經系統發育過程中,神經細胞遷移過程是復雜并被精細調控的,神經細胞在接受胞外信號后,將信號傳遞至胞內,最終到達胞內細胞骨架,通過微管、微絲及神經細胞黏附分子等共同作用完成整個遷移過程,到達大腦特定部位,構成復雜的神經網絡體系,進而發揮正常的腦功能。在神經細胞遷移過程中,任何環節出現異常都會影響到神經細胞最終的正確定位。細胞遷移距離結果顯示,神經細胞受氚水照射后,其遷移距離較對照組明顯縮短,并且隨著氚水濃度的不斷增大遷移距離逐漸縮短。
神經細胞黏附分子L1、NCAM歸屬于免疫球蛋白超家族,是一種結構復雜的跨膜糖蛋白,通過親同性和異同性結合介導細胞與細胞之間及細胞與細胞外基質之間的相互作用,能夠多個分子共同作用于細胞外區域,在細胞質內也可以與細胞骨架蛋白actin可逆的結合[5]。目前的研究[6-8]表明,L1及NCAM充當整合素、生長因子的共同受體的同時也作為一種受體排斥的軸突導向分子。在促進神經細胞突觸生長,神經細胞目標識別及神經細胞的正確遷移等過程中起著重要作用。
L1主要影響大腦皮層顆粒細胞的遷移過程[9],在神經細胞發育和突觸形成中都起著非常重要的作用,可通過同親性機制或與其他的蛋白分子,如整合素、纖粘連蛋白受體和蛋白聚糖等異同性結合共同介導神經細胞的黏附。Ll還可通過錨蛋白與細胞骨架相連,參與細胞遷移運動過程及可在膜內通過它的寡聚甘露糖與NCAM結合,通過調節細胞黏附的作用來影響神經細胞正常的遷移過程。NCAM主要通過介導同源相鄰細胞黏附來影響神經細胞的正常遷移過程,其主要通過三種機制[10]:①兩個NCAM分子各自的IgⅢ結構域的相互作用;②兩個NCAM分子的免疫球蛋白結構域反平行結合;③兩個NCAM分子上的IgI和IgⅡ結構域的交互結合。這種同源性結合可介導細胞內的信號轉導途經,過程可能與成纖維細胞生長因子(fibroblast growth factor,FGF)受體有關。NCAM可以和FGF受體上與NCAM同源的結構域相結合來調節FGF活性,進一步激活磷脂酶Cγ產生甘油二酯,通過電壓依賴性鈣通道誘導Ca2+內流,促進神經細胞軸突生長,最終影響神經細胞的遷移過程。相關研究[11]表明電離輻射可導致L1、NCAM的表達含量降低進而影響大腦神經細胞的遷移過程,導致遷移障礙。先前的研究[12]也顯示孕鼠腦受氚β射線輻射后,其神經細胞的L1、NCAM的含量普遍降低,妨礙了神經細胞的正常遷移,導致腦機能發生障礙。本研究結果表明,神經細胞受氚水照射后,L1、NCAM表達量較對照組明顯減低,并且呈現出隨氚水濃度不斷增大而逐漸降低的趨勢,這與細胞遷移距離的結果及先前的研究結果是相一致的,提示氚水可通過影響神經細胞黏附分子L1、NCAM的表達來影響發育期間腦神經細胞的正常遷移過程。
綜上所述,氚水照射可下調仔鼠腦內神經細胞黏附分子L1、NCAM的表達,影響神經細胞黏附及神經細胞軸突生長等方面來妨礙神經細胞的正常遷移,通過研究氚水照射對發育中腦的影響可以深入了解氚輻射如何影響神經細胞遷移使神經細胞定位異常而最終導致腦機能障礙的機制,為日后預防氚的危害、治療氚輻射損傷及制定安全衛生法規和標準、管理決策提供重要實驗依據。
[1] Fushiki S,Matsushita K,Yoshioka H,et al.In utero exposure to low-doses of ionizing radiation decelerates neuronalmigration in thedeveloping rat brain[J].Int JRadiat Biol,1996,70(1):53-60.
[2] Streffer C,Shore R,Konermann G,et al.Biological effects after prenatal irradiation(embryo and fetus).A report of the International Commission on Radiological Protection[J].Ann ICRP,2003,33(1-2):5-206.
[3] JValentin.Human evidence on the effects of in-utero radiation exposure on neurological and mental processes[M]//ICRP Publication 30:Limits for Intakes of Radionuclides by Workers.Oxford:Pergamon Press Ltd,1981,40(4):477-84.
[4] Schmid R S,Maness P F.L1 and NCAM adhesion molecules as signaling coreceptors in neuronalmigration and process outgrowth[J].Curr Opin Neurobiol,2008,18(3):245-50.
[5] Maness P F,Schachner M.Neural recognition molecules of the immunoglobulin superfamily:signaling transducers of axon guidance and neuronalmigration[J].Nat Neurosci,2007,10(1):19-26.
[6] Kleene F,Mzoughi M,Joshi G,et al.NCAM-induced neurite outgrowth depends on binding of calmodulin to ncam and on nuclear import of ncam and fak fragments[J].J Neurosci,2010,30(32):10784-98.
[7] Hansen R K,Christensen C,Korshunova I,etal.Identification of NACM binding peptides promoting neurite outgrowth via a heterotri-meric G-protein-coupled pathway[J].J Neurochem,2007,103(4):1396-407.
[8] Polo-Parada L,Bose C M,Plattner F.Distinct roles of different neural cell adhesionmolecule(NCAM)isoforms in synapticmaturation revealed by analysis of NCAM 180 kDa isoform-deficient mice[J].JNeurosci,2004,24(8):1852-64.
[9] Cohen N R,Taylor JS,Scott L B,et al.Errors in corticospinal axon guidance in mice lacking the neural cell adhesion molecule L1[J].Curr Biol,1998,8(1):26-33.
[10]Ditlevsen D K,Kolkova K.Signaling pathways involved in NCAM-induced neurite outgrowth[J].Adv Exp Med Biol,2010,663:151-68.
[11]Sun X Z,Zhang R,Cui C,et al.Expression of neural cell adhesionmolecule L1 in the brain of rats exposed to X-irradiation in utero[J].JMed Invest,2003,50(3-4):187-91.
[12]姚曉波,王永生,邱 俊,等.氚宮內照射對大鼠神經細胞分布及腦機能的影響[J].安徽醫科大學學報,2014,49(10):1371-5.
Effects of irradiation from tritiated water on the expression of neural cell adhesion molecule L1 and NCAM of hippocam pus in rats
Wang Yongsheng1,Yao Xiaobo2,Cai Erpeng3,et al
(1Institute of Radiation Medicine,School of Clinical Medicine,Anhui Medical University,Hefei 230032;2Dept of Nuclear Medicine,Anhui Provincial Hospital,Hefei 230031;3Dept of Radiology,The Second People’s Hospital,Wuhu 241000)
Objective To explore the effects of low concentrations of tritium irradiation using tritiated water on the expression of neural cell adhesion molecule L1(L1)and neural cell adhesion molecule(NCAM)in vitro.MethodsHippocampal neuron cells from neonatal Sprague-Dawley(SD)rats(24 h)were primarily cultured in DMEM for 7 d,followed by exposure to tritiated water at concentrations of 3.7×102,3.7×103,3.7×104,3.7×105,3.7×106Bq/ml for24 h respectively,and cellswithout tritium irradiation served as control group(0 Bq/ml).Live Cell Imaging System was performed to detect neuronalmigration capacity.Western blot and immunocytochemistry(ICC)were used tomeasure the expression levels of neural cell adhesion molecule L1 and NCAM.ResultsThe migration distance of irradiated neural cells was significantly shorter than that of the control group and declined gradually with increasing tritiated water(HTO)concentrations(P<0.05);Western blot and ICC showed that the expression of L1 and NCAM were both presented a dose-dependent decrease in hippocampalneuron cellswhen irradiated by tritium(P<0.05).ConclusionNeurons exposed to tritium irradiation are probably undergoing the decreased expression of neural cell adhesionmolecules,further leading to abnormal neuronalmigration.
rats;tritiated water;neural cell adhesion molecule;neural cell
R 811.5
A
1000-1492(2015)08-1102-05
2015-03-11接收
國家自然科學基金(編號:81273003);安徽省自然科學基金(編號:1208085MH162);安徽省教育廳自然科學基金(編號:KJ2011Z162)
1安徽醫科大學臨床醫學院放射醫學研究所,合肥 230032
2安徽省立醫院核醫學科,合肥 230032
3蕪湖市第二人民醫院影像科,蕪湖 241000
4安徽省第二人民醫院MRI室,合肥 230001
5肥東縣人民醫院呼吸科,合肥 230001
王永生,男,碩士研究生;
王明明,男,副教授,碩士生導師,責任作者,E-mail:wmgene@163.com

