淺談滴眼劑生產車間的工藝設計要求
胡士高 竇穎輝 羅京京 楊士友
淺談滴眼劑生產車間的工藝設計要求
胡士高 竇穎輝 羅京京 楊士友
(安徽省食品藥品審評認證中心,安徽合肥230051)
根據多劑量溶液型滴眼劑生產工藝流程和生產操作特點,介紹了多劑量溶液型滴眼劑生產車間的布局原則,并通過對車間布局、區域劃分等方面的論述,從工藝布局設計的角度提出了避免生產中交叉污染的方法。
滴眼劑;工藝布局;設計;要求
0 引言
眼睛是心靈的窗戶,是人體的重要感覺器官,是人類與外界交流的重要工具。《中國藥典》2010年版制劑通則規定,眼用制劑系指直接用于眼部發揮治療作用的無菌制劑,這就意味著眼用制劑需要按要求進行無菌項目的檢查并符合規定,眼用制劑的生產納入無菌藥品管理的范疇,眼用制劑的安全性、質量可控性逐步等同于注射劑的要求。
我國于2011年3月1日頒布實施的《藥品生產質量管理規范(2010年修訂)》要求藥品生產企業血液制品、疫苗、注射劑等無菌藥品的生產,應在2013年12月31日前達到新修訂藥品GMP要求,并于2012年4月20日前進一步明確眼用制劑等產品實施新修訂藥品GMP期限;眼內注射液,眼內插入劑,供手術、傷口、角膜穿透傷用的眼用制劑以及眼用液體制劑應在2013年12月31日前達到新修訂藥品GMP要求,其他眼用制劑應在2015年12月31日前達到新修訂藥品GMP要求。
滴眼劑作為臨床上使用最廣泛的一種眼用液體制劑,是由藥物與適宜輔料制成的供滴入眼內的無菌液體制劑。新修訂藥品GMP提高了對無菌藥品的生產要求,滴眼劑生產企業將面臨廠房設施的改造或重建,下面就多劑量溶液型滴眼劑的生產車間設計要求談一點認識。
1 法規要求
無菌藥品按生產工藝可分為采用最終滅菌工藝的最終滅菌產品和部分或全部工序采用無菌生產工藝的非最終滅菌產品。目前多劑量溶液型滴眼劑的內包裝材質多為低密度聚乙烯、聚丙烯、聚酯類等,在高溫下易變形,因此一般不能采用最終滅菌工藝,需要采用非最終滅菌的無菌生產工藝進行生產。
2 工藝流程設計
圖1為多劑量溶液型滴眼劑生產車間的工藝平面布局圖。
2.1 生產工藝
多劑量溶液型滴眼劑的生產工藝為原輔料稱量后,先加注射用水溶解進行濃配,再用注射用水定容進行稀配,經粗濾和除菌過濾、灌裝、壓內塞、旋外蓋、燈檢、貼簽、裝盒、裝箱得到成品。
2.2 生產環境潔凈區域
無菌藥品生產所需的潔凈區分為A級高風險操作區、無菌配制和灌裝等高風險操作A級潔凈區所處的背景區域B級潔凈區,以及無菌藥品生產過程中重要程度較低的C級和D級操作潔凈區。在多劑量溶液型滴眼劑生產中,容器具的清洗及滅菌干燥、消毒液的配制在D級潔凈區進行;原輔料的稱量、濃配、稀配、除菌過濾設置在C級潔凈區進行;二級除菌過濾、灌裝、加內塞、旋外蓋都屬于高風險操作區,應該選擇在B級背景下的A級潔凈區中進行。
2.3 工藝平面布局
在平面布局時,應根據所生產的藥品特性、生產工藝流程以及生產環境潔凈度要求來進行設計,使上下游操作崗位連續、順應流程要求,以利于生產操作,并能保證對生產過程進行有效管理。同時應使人物流路線盡量短些,避免迂回往返。人物流通道要分開設置以最大限度地避免混雜以及交叉污染。在無菌生產的工藝平面布局中,生產所用的包裝材料、容器、設備、工衣通過雙扉滅菌柜滅菌后進入無菌生產區,灌裝藥液以及消毒液除菌過濾后進入無菌生產區。B級區是核心區域,管理或監控人員應該能夠從外部觀察到內部的操作。無菌操作區設置獨立的人凈系統,并且為了避免退出時微粒和微生物污染更衣區,無菌區的更衣區需設置退出通道。無菌區所用器具通過傳遞窗傳出后,在D級區清洗后通過雙扉滅菌柜滅菌后傳入;C級區所使用器具在C級區清洗。因此,在平面布局時一般都圍繞無菌區設置其他相關輔助功能間,在工藝布局時也優先考慮無菌生產區。
2.4 內包材滅菌
根據《直接接觸藥品的包裝材料和容器管理辦法》(局令第13號)的規定,多劑量溶液型滴眼劑的內包材生產環境一般為十萬級背景下,在可見異物、無菌等方面難以達到要求。由于材質的限制,其無法耐受濕熱蒸汽滅菌或干熱滅菌,為了保證內包材的無菌、可見異物符合要求,基于目前內包材的生產條件,除加強內包材的源頭管理,嚴格供應商審計外,還應對購進的內包材進行處理,在C級區清洗、低溫干燥后采用三層聚乙烯袋包裝后進行滅菌,滅菌的方式有輻射滅菌、環氧乙烷滅菌等。為便于控制和操作,選擇采用環氧乙烷滅菌,環氧乙烷是一種廣譜滅菌劑,穿透性很強,可在常溫下殺滅各種微生物。為確認滅菌效果,應對環氧乙烷滅菌柜和滅菌工藝進行確認和驗證,在滅菌過程中,需要監測滅菌溫度、濕度、氣體濃度、滅菌時間等,滅菌結束后,通過檢測環氧乙烷殘留確定解析時間以及滅菌后包材的存放期限。環氧乙烷殘留、無菌檢查符合要求后的內包材通過三次脫包進入A級區,采用經除菌過濾的去離子風吹洗去除帶電異物。
3 結語
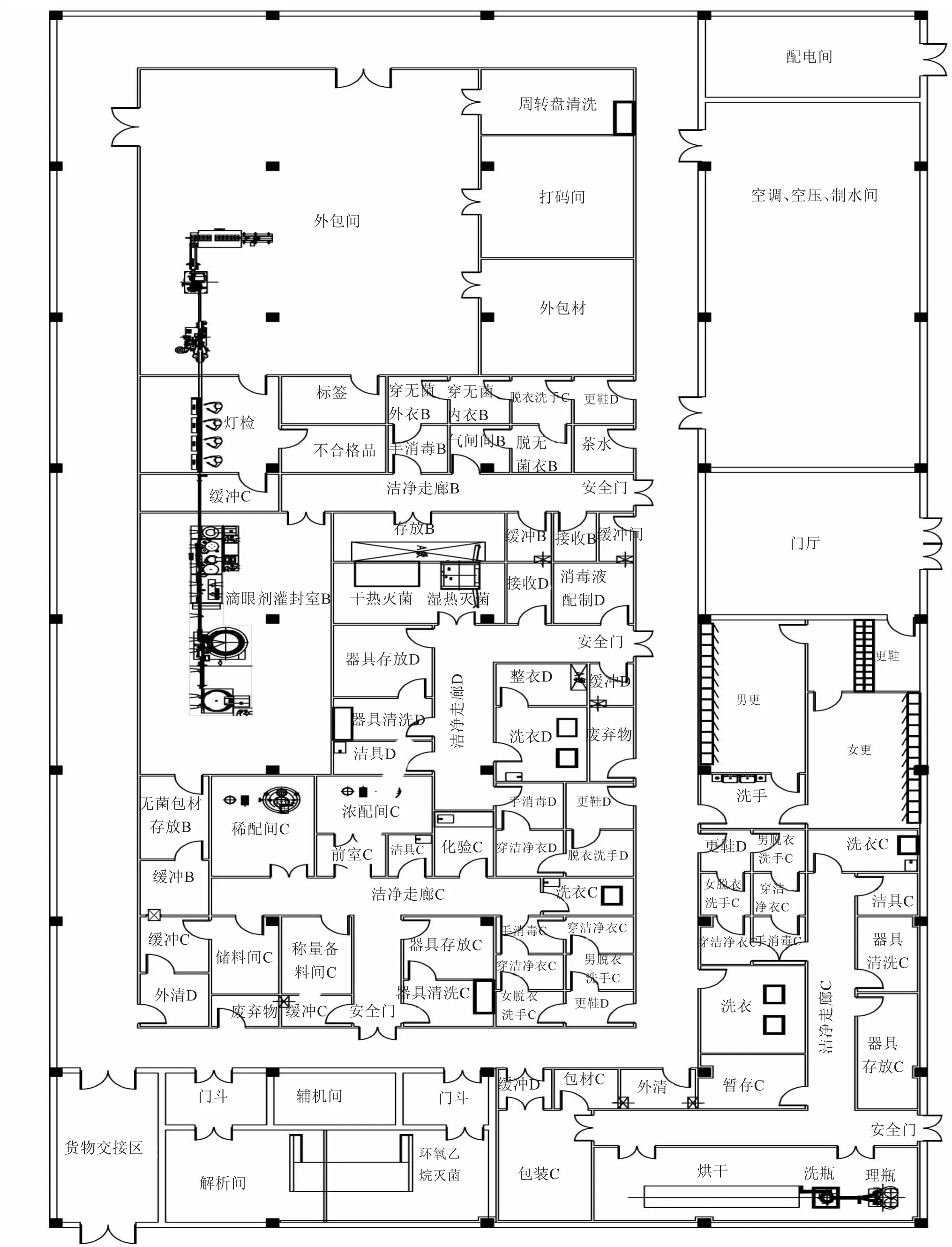
圖1 多劑量溶液型滴眼劑生產車間的工藝平面布局圖
質量源于設計。為保證藥品質量,將藥品生產中的污染、交叉污染、混淆、差錯降到最低,杜絕藥害事件的發生,一個符合新修訂藥品GMP要求的多劑量溶液型滴眼劑生產工藝布局的設計是醫藥工程建設中不可缺少的環節。
[1] 國家藥典委員會.中國藥典(2010年版)[M].北京:中國醫藥科技出版社,2010.
[2] 中華人民共和國衛生部. 藥品生產質量管理規范(2010年修訂)[S].2011.
[3] 國家食品藥品監督管理局.關于進一步明確眼用制劑等產品實施新修訂藥品GMP期限的通知[Z].2012.
[4] 寧黎麗,邵穎.對眼用制劑無菌要求和滅菌工藝的思考[J].中國新藥雜志,2008,17(9).
[5] 國家食品藥品監督管理局.直接接觸藥品的包裝材料和容器管理辦法[S].2004.
Discussion of Process Design in Guttae Ophthalmicae Workshop
Hu Shigao Dou Yinghui Luo Jingjing Yang Shiyou
(Anhui Center for Food and Drug Evaluation & Certification, Anhui Hefei 230051)
In this article, we introduced the workshop layout principle of multi-dose guttae ophthalmicae, according to the characters of process and production. Methods to avoid cross-contamination were proposed through discussing the division of production area.
guttae ophthalmicae; workshop layout; design; requirements
2015-04-27
胡士高(1978—),男,安徽肥東人,副主任藥師,研究方向:藥品審評認證。

