小腸細菌過度生長對非酒精性脂肪肝患者腫瘤壞死因子-α、C反應蛋白的影響
李偉偉 韓紅波
(1 河南科技大學第二附屬醫院 消化內科,河南 洛陽 471000;2 河南科技大學醫學院病理及病理生理教研室,河南 洛陽 471000)
伴隨著肥胖、高脂血癥和糖尿病等代謝紊亂的高發,非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)的發病率不斷升高,在經濟發達地區其發病率已超過酒精性脂肪肝,成為慢性肝病的首要病因。范建高等在上海地區調查表明,中國成人NAFLD患病率15.35%,其中15%~25%的患者最終發展為脂肪肝性肝炎,甚至發展為肝硬化[1]。非酒精性脂肪肝病因和發病機制尚不明確。肝臟是門靜脈首過器官,接收大部分腸道回流血液,因此在解剖和功能上與腸道微生態有著密切聯系,腸道微生態失衡主要表現為小腸細菌過度生長(small intestinal bacterial overgrowth,SIBO),研究表明小腸細菌過度生長(small intestinal bacterial overgrowth,SIBO)所引起的腸源性內毒素血癥在NAFLD發病中起著重要作用[2]。因此可從腸道微生態角度出發,探討非酒精性脂肪性肝病(NAFLD)的發病機制,為NAFLD診療提供新的思路。本研究通過對NAFLD患者小腸細菌過度生長(small intestinal bacterial overgrowth,SIBO)情況及相關細胞因子檢測,進一步探討SIBO對NAFLD發病機制影響。
1 資料與方法
1.1 一般資料:收集2013年2月~8月在我院消化內科門診就診的NAFLD患者32例,男26例,女6例,年齡25~65歲,均符合NAFLD臨床診斷標準[3],并排除病毒性、藥物性、自身免疫性肝炎、肝硬化以及酒精性肝病(乙醇量男性≥40 g/d;女性≥20 g/d)的患者。所有人員在檢查前1 d禁煙、禁食高纖維和難消化的碳水化合物食品。
1.2 研究方法
1.2.1 主要儀器及試劑:HHBT-01型氫呼氣測試儀,由深圳中核海德威生物科技有限公司提供;乳果糖口服溶液10 mL(5 g)購自丹東康復制藥有限公司。按說明書有專門人員操作。陽性診斷標準:符合以下三者之一判斷為陽性[4]。①空腹基礎呼氣H2值>20 ppm,且每隔30 min重復測定2次,H2值均>20 ppm。②出現雙峰圖形(小腸峰和結腸峰),第1峰起始點在90 min之前出現,上升至少12ppm 1 h后出現第二個更高得多的氫氣水平,雙峰可能會合并出現一個早期上升平臺。③服用基質后90 min內產氫,且與基礎呼氣氫濃度差值H2>20 ppm。
1.2.2 采用鱟試驗檢測血漿內毒素(鱟試劑由廈門鱟試劑廠提供);雙抗體夾心ELISA法檢測血漿腫瘤壞死因子(相關試劑盒購自深圳晶美公司);C反應蛋白:超敏血清C-反應蛋白(hs-CRP)測定用HITACHI 7600自動生化分析儀,以免疫透射比濁法進行測定,測定范圍正常值0~10 mg/L。
2 結 果
2.1 32例NAFLD患者中SIBO陽性20例,陰性12例,陽性率62.5%,SIBO與血漿內毒素的關系:血漿內毒素在SIBO陽性患者為(0.75±0.21)EU/ML,陰性者為(0.37±0.23)EU/ML。SIBO與血漿TNF-α的關系:血漿TNF-α在SIBO陽性患者為(43.2±13.5)ng/L,陰性者為(26.4±12.6)ng/L。見表1。
表1 兩組間ET、CRP、TNF-α的比較(s)
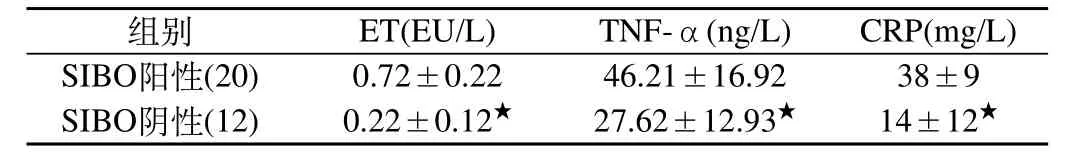
表1 兩組間ET、CRP、TNF-α的比較(s)
注:SIBO陽性組與陰性組相比★P<0.05
組別 ET(EU/L) TNF-α(ng/L) CRP(mg/L)SIBO陽性(20) 0.72±0.22 46.21±16.92 38±9 SIBO陰性(12) 0.22±0.12★ 27.62±12.93★ 14±12★
2.2 相關性分析討論:經Spearman相關分析,NAFLD患者SIBO陽性組ET濃度與CRP及 TNF-α呈正相關(r=0.317,P<0.05,r=0.324,P<0.02)。SIBO陽性組CRP與TNF-α呈正相關(r=0.278,P<0.05)。
3 討 論
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是一種與胰島素抵抗(insulin resistance,IR)和遺傳易感密切相關的代謝應激性肝臟損傷,其病理學改變以彌漫性肝細胞大泡性脂肪變性為特征,與酒精性肝病(alcoholic liver disease,ALD)相似,但患者無過量飲酒史[1]。目前認為非酒精性脂肪性肝病是代謝應激性肝臟損傷,為胰島素抵抗(insulin resistance,IR)在肝臟表現。其疾病譜包括非酒精性單純性脂肪肝(nonalcoholic simplefatty liver,NAFL)、非酒精性脂肪性肝炎(nonalcoholic hepatitis,NASH),并且可能是隱源性肝硬化和肝細胞癌病因。
NAFLD發病機制尚不明確,多用“二次打擊”學說進行解釋,IR引起的肝內脂質沉積,過多肝細胞發生脂肪變性被認為是第1次打擊。二次打擊主要指各種原因所致的氧化應激及脂質過氧化(1ipid peroxidation.LP),使脂肪變性的肝細胞對二次打擊敏感性增加,引起非酒精性脂肪性肝炎(NASH),反復肝細胞炎癥壞死、凋亡、修復,最終導致肝纖維化和肝硬化的發生[5]。研究表明,腸道菌群失調及腸源性內毒素血癥在NAFLD的發病中起著重要作用[6-7]。SIBO主要因為小腸淤滯,結腸細菌移位到小腸過度繁殖從而造成營養吸收障礙,臨床上出現腹瀉、腹脹、脂肪瀉、貧血、小腸動力異常為主的臨床綜合征。正常人腸道內存在有大量的Gran陰性細菌,不斷釋放內毒素,當腸黏膜屏障正常時,僅少量內毒素進入門靜脈,經過肝臟后被枯否細胞所清除,故不能進入體循環。在NAFLD患者,當存在腸道菌群紊亂及異常增殖時,內毒素產生增多,同時腸黏膜細胞之間緊密連接下降、通透性增高,造成大量內毒素易位進入門脈系統,引起腸源性內毒素血癥(IETM)。NAFLD患者存在脂肪組織和肝臟的自身免疫功能紊亂,其內毒素清除能力下降。內毒素系Gran陰性大腸肝菌等細胞壁外層的脂多糖(LPS),是細菌的毒性因子,不僅直接導致肝細胞損害,更重要的是通過激活枯否細胞釋放促炎遞質TNF-α,IL-1,IL-6等肽類遞質,白三烯、血小板活化因子、血栓素等脂類遞質,擴大了炎性反應,引起肝細胞凋亡、壞死[8]。其中TNF-α是內毒素引起肝損害中最關鍵的促炎遞質。Higuchi、Miele等[9-10]發現,在LPS誘導的肝損傷中Kupffer細胞活化及其釋放的TNF-α是介導LPS性肝損傷的重要媒介,腸道通透性增加的同時伴有血清炎性因子顯著上升。本研究表明,SIBO陽性患者其內毒素水平、CRP、TNF-α明顯高于SIBO陰性患者。內毒素水平與CRP、TNF-α呈正相關。研究表明TNF-α在NAFLD的進展中發揮關鍵作用,TNF-α誘導中性粒細胞在肝內聚集,加強中性粒細胞和枯否細胞產生超氧陰離子的作用,TNF-α促使中性粒細胞及單核細胞產生呼吸爆發,釋放氧自由基,導致膜損傷,DNA損傷和脂質過氧化反應,進一步加重肝壞死;另一方面又促進肝內凝血系統活化,引起肝微循環障礙導致肝組織缺血、缺氧,進一步加重肝損傷。
hs-CRP由肝細胞合成分泌,是機體受到損傷或發生各種急慢性炎癥后的一種敏感的急性期反應蛋白。有研究表明Hs-CRP是NAFLD獨立危險因素,本研究表明,SIBO陽性患者其hs-CRP明顯高于SIBO陰性患者,且與TNF-α水平具有一定相關性。其可能機制是NAFLD患者的脂肪細胞分泌過多TNF-α,后者刺激肝細胞合成和分泌CRP,CRP可以誘發并促進胰島素抵抗發生[11]。
近年的研究認為,NAFLD患者存在脂肪組織和肝臟的自身免疫功能紊亂,脂肪組織和肝臟聚集了異常增多的巨噬細胞,后者是炎性細胞因子的重要來源。我們研究發現NAFLD伴小腸細菌過度生長患者血漿內毒素、CRP、TNF-α水平均高于不伴小腸細菌過度生長患者。提示NAFLD患者小腸細菌過度生長與血漿內毒素水平有關,支持內毒素血癥為腸源性內毒血癥的學說。腸源性內毒素血癥則在這些細胞因子活化過程中起了重要作用。
在NAFLD患者中,SIBO發生率明顯增高,腸道內菌群異位引起小腸黏膜的通透性增加,進而導致腸源性內毒素血癥的發生,可能是誘發NAFLD患者二次打擊一個重要因素,從而觸發或加劇脂肪性肝炎,加重肝功能的損害。同時肝功能損傷進一步加重內毒素血癥,形成惡性循環,進而加速脂肪肝的發展進程。越來越多的研究表明,小腸細菌過生長及其產生的內毒素血癥在NAFLD的發病過程中起著重要作用[12-13]。因此在治療NAFLD時,從腸道微生態的角度出發,調整腸道菌群,降低內毒素血癥對肝臟的繼發性損傷,或保護肝細胞免受內毒素的損害,將為預防脂肪肝的發生和發展提供新的思路。
[1] 范建高,朱軍,李新建,等.上海市成人脂肪肝患病率及其危險因素流行病學調查[J].中國肝臟病雜志,2005,13(2):83-88.
[2] Wigg AJ,Roberts-Thomson IC,Dymock RB,et a1.The role of small intestinal bacterial overgrowth,intestinal permeability,endotoxae mia,and tunlour necrosis Factor alpha in the pathogenesis of nonalcoholic steatohepatitis[J].Gut,2001,48(2):206-211.
[3] 中華醫學會肝病學分會脂肪肝和酒精性肝病學組.非酒精性脂肪性肝病診療指南(2010年修訂版)[J].中華肝臟病雜志,2010,18(3):163-166.
[4] Park JS,Yu JH,Lim HC,et al.Usefulness of lactulose breath test for the predition of small intestinal bacterial overgrowth in irritable bowel syndrome [J].Korean J Gastroentrrol,2010,56(4):242-248.
[5] Adams LA,Angulo P,Lindor KD.Nonalcoholic fatty liver disease[J].CMAJ,2005,172(7):899-905.
[6] Cani PD,Amar J,Iglesias MA,et a1.Metabolic endotoxemia initiates Obesity and insulin resistance [J].Diabetes,2007,56(7):1761-1772.
[7] Wigg AJ,Roberts-Thomson IC,Dymock RB,et a1.The role of small intestinal bacterial overgrowth,intestinal permeability,endotoxae mia,and tumour necrosis factor alpha in the pathogenesis of nonalcoholic steatohepatitis [J].Gut,2001,48(20):206-211.
[8] 趙龍鳳,李紅,韓德五.腸源性內毒素血癥與肝病[J].世界華外消化雜志,2000,8:1145-1149.
[9] Higuchi Y,Kawakami S,Yamashita F,et a1.The potential role of fucosylated cationic liposome NFkappaB decoy complexes in the treatment of cytokine-related liver disease[J].Biomaterials,2007,28(3):532-539.
[10] Miele L,Valenza V,La Torre G,et al.Increased intestinal permeability and tight junction alterations in nonalcoholic fatty liver disease[J].Hepatology,2009,49(6):1877-1887.
[11] Park SH,Kim BI,Yun JW,et al.Insulin resistance and C-reactive protein as independent risk factors for non-alcoholic fatty liver disease in non-obese Asian men[J].J Gastroenterol Hepatol,2004,19(6):694-698.
[12] Cani PD,Amar J,Iglesias MA,et a1.Metabolic endotoxemia initiates Obesity and insulin resistance[J].Diabetes,2007,56(7):1761-1772.
[13] Wigg AJ,Roberts-Thomson IC,Dymock RB,et a1.The role of small intestinal bacterial overgrowth,intestinal permeability,endo toxaemia,and tumour necrosis factor alpha in the pathogenesis of non-alcoholic steatohepatitis[J].Gut,2001,48(20):206-211.

