高鹽上調壓力超負荷大鼠的腦內APJ受體表達
張 琪,譚穎穎,劉東敏,趙小明
(陜西中醫學院 1.醫學科研實驗中心、2.第一臨床醫學院,陜西 咸陽 712046)
高鹽上調壓力超負荷大鼠的腦內APJ受體表達
張 琪1,譚穎穎2,劉東敏2,趙小明1
(陜西中醫學院 1.醫學科研實驗中心、2.第一臨床醫學院,陜西 咸陽 712046)
目的 觀察高鹽對壓力超負荷大鼠的交感神經活性和腦內Apelin和APJ系統的影響。方法 ♂ SD大鼠,在腎動脈分支上方部分結扎腹主動脈,建立主動脈縮窄大鼠模型。術后4 周,分別給予含8% NaCl 的高鹽飼料或含0.3% NaCl的常規飼料,喂養1周后,記錄各組大鼠的血流動力學變化;ELISA分析24 h尿去甲腎上腺素(NE)水平;real-time RCR和Western blot 方法觀察室旁核Apelin和APJ的表達變化。另一組實驗中,在給予高鹽飼料的同時使用Alzet微滲透泵側腦室灌流ML221或benzamil,觀察24 h尿NE水平和心臟指數(HW/BW)變化。此外,在正常SD大鼠側腦室灌流高鈉腦脊液1周后,觀察大鼠血壓、24 h尿NE和APJ表達水平的變化。結果 壓力超負荷大鼠給予高鹽飲食1周后,平均動脈血壓(MAP)、心率(HR)、左室收縮末期壓(LVESP)和24 h尿NE水平,以及室旁核的APJ mRNA和蛋白表達均較對照明顯增加 (P<0.05);而假手術組大鼠在進食高鹽飼料后,血流動力學、24 h尿NE水平和APJ表達均未見明顯改變。在側腦室分別灌注APJ受體拮抗劑ML221或ENaC拮抗劑benzamil后,可以明顯抑制高鹽引發的壓力超負荷大鼠24 h尿NE水平和HW/BW比值變化(P<0.01)。在正常血壓大鼠側腦室灌注高Na+腦脊液1周后,也可出現腦內APJ表達上調以及MAP、HR和尿NE水平升高(P<0.01)。結論 高鹽可以增加壓力超負荷大鼠模型的交感神經活性,而該效應與腦內的APJ受體表達上調和Na+敏感性增加密切相關。APJ受體可能是腦內鹽敏感性形成的重要調控靶點。
Apelin;APJ受體;高血壓;交感神經;主動脈縮窄;鹽敏感性
鹽敏感性是高血壓最重要的中間表現型之一。已有研究證實,交感神經系統調節缺陷是鹽敏感者的關鍵病理生理特點,如鹽負荷后的血漿去甲腎上腺素水平升高、心率變異性中的夜間低頻成分增多和血壓的應激反應增強等[1]。長期高鹽攝入可在鹽敏感者中形成交感中樞的抑制紊亂和相繼外周交感神經張力增加,繼而通過影響腎臟的血流動力學、腎小管對鈉和水的處理,產生血壓的鹽敏感性[2-3]。然而,在鹽敏感性高血壓形成中,交感神經活動增強的發生機制目前尚不清楚。發現鹽敏感性形成的關鍵機制是高血壓研究面臨的重要問題。
Apelin是由同一基因編碼的具有不同分子結構的一組內源性活性肽,該類肽通過作用于7次跨膜的G蛋白偶聯受體APJ而參與心血管功能、體液平衡、神經系統功能等的調節。形態學研究表明,腦內Apelin和APJ主要分布于下丘腦、腦干和丘腦,包括室旁核(PVN)、視上核(SON)、延髓頭端腹外側核(RVLM)和孤束核(NTS)等心血管調節中樞[4-5]。我們課題組近來的研究發現,延髓的頭端腹外側核和PVN的Apelin和APJ參與自發性高血壓大鼠的交感神經異常活動的形成[5-6]。然而, Apelin和APJ系統是否參與腦內鹽敏感性的形成,以及是否具有調控效應,目前尚未見報道。因此,本實驗采用腹主動脈縮窄方法建立壓力負荷性高血壓模型,觀察高鹽對壓力超負荷大鼠的交感神經活性和腦內Apelin和APJ系統的影響,以明確APJ受體在腦內鹽敏感性形成中的調節作用。
1 材料與方法
1.1 試劑與儀器ML221、benzamil和戊巴比妥鈉為Sigma產品;兔抗APJ抗體為美國Santa Cruz生物技術公司產品;Power Lab數據分析處理系統為澳大利亞AD instrument公司產品;Qiagen RNeasy Mini Kit試劑盒為Qiagen公司產品;ABI Prism 7000 熒光定量PCR儀為美國ABI公司產品;去甲腎上腺素(norepinephrine,NE)酶聯免疫試劑盒由美國Rocky Mountain Diagnostics公司提供;Apelin酶聯免疫試劑盒由美國DRG國際有限公司提供。
1.2 實驗動物和分組實驗選用♂SD大鼠,體質量180~200 g,適應性喂養1周后,隨機分成6組:假手術組(sham)、假手術+常規鹽組(sham+R),假手術+高鹽組(sham+H)、主動脈縮窄組(AB)、主動脈縮窄+常規鹽組(AB+R)和主動脈縮窄+高鹽組(AB+H)。實驗動物由西安交通大學實驗動物研究中心提供,合格證:SCXK(陜)2007-001。
1.3 主動脈縮窄大鼠模型大鼠2%戊巴比妥鈉腹腔麻醉后,腹部正中線偏左0.5 cm處行縱切口,暴露腹主動脈,在腎動脈分支上1cm處游離腹主動脈,平行放置7號針頭(直徑0.7 mm),用0號縫合線將動脈與針頭一并結扎后,抽去針頭,形成約70% 管腔狹窄。假手術組不作主動脈結扎,其余步驟與手術組相同。術后4周,sham+H 和AB+H 組大鼠給予含8% NaCl 的高鹽飼料,而sham+R和AB+R組大鼠給予含0.3% NaCl的常規飼料。大鼠在溫度 22℃,濕度 30%~40%的環境中飼養,自由飲水和攝食。
1.4 動脈血壓和心功能記錄參照我們以前的方法[7],在實驗的第5周末,各組大鼠給予2%異氟烷(isoflurane)吸入麻醉,分離右側頸總動脈,將充有肝素生理鹽水的自制導管插入頸動脈以及逆行插入左心室,經壓力傳感器與橋式放大器相連,經Power Lab數據分析處理系統記錄各組大鼠的平均動脈血壓(MAP)、心率(HR),以及左室收縮末期壓(left ventricular end-systolic pressure,LVESP)、左室舒張末期壓(left ventricular end-diastole pressure,LVEDP)及心室收縮時室內壓最大上升速率(+dP/dt)。
1.5 酶聯免疫法(ELISA)檢測NE水平收集各組大鼠24 h尿液,使用ELISA分析尿NE水平。嚴格按照說明書進行操作,選擇相應的波長,用酶標儀測定樣品的吸光值,并用樣品濃度進行標化。試劑盒的敏感性為1.5 μg·L-1。
1.6 Real-time PCR參照我們以前的方法[6-7],用TRIzol一步法抽提細胞總RNA,經Qiagen RNeasy Mini Kit試劑盒提純,并測定A260/280值,鑒定RNA濃度與純度。APJ的引物探針由Invitrogen公司提供。取5 μg RNA用ABI逆轉錄試劑盒逆轉錄RNA合成cDNA,使用ABI公司7000型熒光定量PCR儀檢測RNA表達,10 μL的反應體系中包括:1 μL cDNA、3.5 μL無核酸酶純水、0.5 μL引物、5 μL TaqMan Mastermix。
1.7 Western blot參照我們以前的方法[6-7],各組樣品在細胞裂解液中提取蛋白后,按Bradford 法測定蛋白含量,用SDS-PAGE 凝膠電泳分離蛋白。電泳結束后,將蛋白從聚丙酰胺凝膠轉移到硝酸纖維素膜上,并在室溫下5% 的脫脂奶粉封閉液封閉1 h。加入兔抗APJ一抗(1 ∶400),4℃ 孵育過夜,漂洗3 次后,加入標記辣根過氧化物酶的抗兔的IgG二抗,室溫下孵育1 h。膜在漂洗3次后,加入ECL 顯色液,顯色2 min,在暗室里曝光1~2 min,蛋白印跡結果采用圖像分析系統進行分析。
1.8 側腦室藥物慢性灌流參照我們以前的方法[5],取主動脈縮窄模型建立4周后的大鼠,經2%戊巴比妥鈉腹腔麻醉后,大鼠頭部固定于腦立體定位儀,參照Paxinos和Watson大鼠腦圖譜,無菌狀態下將不銹鋼套管(外徑0.7 mm,內徑0.4 mm,長11 mm)放入右側側腦室(前囟后1.0 mm, 中線旁開1.4 mm, 顱骨表面下4.5 mm),并用牙托粉固定于顱骨。其中內充ML221、benzamil或人工腦脊液(aCSF)的微滲透泵(model 2004, 美國Alzet公司) 連接于套管外端進行側腦室灌流,灌流速度為0.28 μL·h-1,時間為1周,ML221的劑量為50 μg ·kg-1·d-1和200 μg·kg-1·d-1,benzamil的劑量為100 μg·kg-1·d-1。將微滲透泵放置于大鼠背部皮下后,縫合切口,單籠飼養,同時給予含8% NaCl 的高鹽飼料,觀察記錄側腦室灌流1周后的尿NE水平和心臟指數(HW/BW)的變化。
另一組實驗中,♂ SD大鼠,隨機分為常規鈉組和高鈉組,每組6只。參照我們以前的方法,采用無創尾套法測壓系統間接測定2組大鼠清醒狀態下的血壓和心率。在麻醉狀態下,分別在右側側腦室植入連接微滲透泵的不銹鋼套管。其中,高鈉組大鼠給予高鈉腦脊液(aCSF中Na+濃度為 800 mmol·L-1),常規鈉組給予正常腦脊液(aCSF中Na+濃度為 145 mmol·L-1),進行側腦室灌流,灌流速度為0.28 μL·h-1,時間為1周。實驗結束后記錄血壓、心率、尿NE水平和PVN APJ表達的變化。
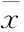
2 結果
2.1 高鹽對壓力超負荷大鼠血流動力學和尿NE水平的影響如Tab 1所示,SD大鼠行主動脈縮窄術4周后,與對照sham組比較,MAP、HR和LVESP均明顯增加(P<0.01),而LVEDP、+dP/dt和尿NE水平未見明顯變化(P>0.05)。壓力超負荷大鼠給予高鹽飲食1周后,與AB+R組比較,MAP、HR、LVESP和24 h尿NE水平均明顯增加 (P<0.05);而sham組大鼠進食高鹽飼料后,血流動力學和24 h尿NE水平均未見明顯變化(P>0.05)。
2.2 高鹽對壓力超負荷大鼠腦內Apelin和APJ表達的影響使用real-time PCR方法對各組大鼠下丘腦PVN的APJ mRNA和Apelin mRNA的表達進行分析,如Fig 1B所示,AB+H組的APJ mRNA表達較對照組明顯增加(P<0.01)。使用Western blot方法分析APJ的蛋白表達,如Fig 1C所示,AB+H組PVN的APJ蛋白表達也較對照組明顯增加(P<0.01),而各組Apelin的表達未見明顯變化(P>0.05)。
2.3 APJ阻斷劑和ENaC阻斷劑對壓力超負荷大鼠交感神經活性的影響使用微滲透泵在AB+H組大鼠側腦室分別灌注APJ拮抗劑ML221(50、200 μg ·kg-1·d-1)或ENaC拮抗劑benzamil(100 μg·kg-1·d-1)1周后,如Fig 2所示,24 h尿NE水平和HW/BW比值均明顯下調(P<0.05)。
2.4 側腦室注射高鈉腦脊液對交感神經活性和APJ表達影響使用微滲透泵ICV灌注高Na+腦脊液1周,如Fig 3所示,與對照組相比,腦內APJ表達明顯上調(P<0.01),同時可見MAP、 HR和24h尿NE水平明顯增高(P<0.01)。而對照組大鼠在側腦室灌流常規腦脊液后,MAP、 HR、24h尿NE和APJ表達水平均未見明顯變化(P>0.05)。
3 討論
采用腹主動脈縮窄方法建立的壓力負荷性高血壓模型,是一個較為成熟的研究高血壓病理機制的模型。本實驗使用0.7 mm針頭在右腎動脈上方1 mm處結扎,可形成腹主動脈70%~72%縮窄,術后4周平均動脈壓、心率和左室收縮末期壓均明顯升高,提示該方法可以通過增加壓力負荷形成高血壓。
鹽是高血壓形成和病理進展的重要環境因素之一,大量研究發現個體間對鹽負荷或限鹽卻存在敏感性差異。發現鹽敏感性形成的關鍵機制是高血壓研究面臨的重要問題[2]。本實驗發現,主動脈縮窄術4周后,給予含8% NaCl 的高鹽飼料喂養1周,可以明顯增加MAP、HR、LVESP以及尿NE水平,而對照大鼠的血流動力學和尿NE水平未見變化。該結果表明主動脈縮窄模型的鹽敏感性增加,而高鹽可通過增加交感神經活性升高血壓并降低心功能。已有的研究也證實,高鹽負荷作用于中樞神經系統,引起的交感神經活性異常增加,是高血壓形成的重要機制[8]。
APJ的內源性配體為Apelin,基因定位于X染色體q25-26.1,編碼一個77個氨基酸的前蛋白原。該蛋白原經過蛋白的水解作用斷裂產生36、17和13個氨基酸大小的生物活性肽。APJ受體蛋白的30%氨基酸序列與血管緊張素AT1受體相同,而在跨膜區相同氨基酸序列達54%,但并不與血管緊

Tab 1 Changes of hemodynamic and urine NE levels in rats ±s, n=7)
**P<0.01vssham;#P<0.05vsAB+R.

Fig 1 Changes of Apelin and APJ expression in hypothalamic paraventricular nucleus of rats ±s, n=7)
A: Representative Western blot demonstrating the change of APJ expression in paraventricular nucleus of rats; B: Graphs showing APJ mRNA expression; C: Graphs showing APJ protein expression; D: Graphs showing Apelin mRNA expression. E: Graphs showing Apelin protein expression.**P<0.01vsAB+R group. sh:sham; sh+R: sham+regular salt diet; sh+H: sham+high salt diet; AB: Aortic banding; AB+R: Aortic banding+ regular salt diet; AB+H: Aortic banding+ high salt diet.

Fig 2 Effect of intracerebroventricular infusion of APJ blocker or ENaC blocking on urinary NE
A: The 24 h U-NE in each group after ICV ML221(ABH+M5, ABH+M20) or benzamil(ABH+B)infusion; B: Heart weight to body weight ratio (HW/BW) in each group after ICV ML221(ABH+M5, ABH+M20) or benzamil(ABH+B)infusion.*P<0.05vsABH+C group.

Fig 3 Effect of intracerebroventricular infusion of Na+-rich aCSF on APJ protein expression in paraventricular nucleus of rats ±s, n=6)
A-B: Response of arterial pressure and heart rate to ICV high-Na+aCSF infusion; C: 24 h U-NE excretion after ICV high-Na+aCSF infusion; D: Western blot demonstrating the expression of APJ in paraventricular nucleus of rats.**P<0.01vsRegular Na+aCSF group.1 mmHg=0.133 kPa.
張素Ⅱ結合[4-5]。在中樞神經系統內,Apelin/APJ 系統主要分布于下丘腦、腦干和丘腦,包括PVN、SON、RVLM和NTS等心血管調節中樞,其中在下丘腦的PVN和SON表達最高[6]。本研究發現高鹽飼料可以明顯上調壓力超負荷大鼠PVN的APJ mRNA和蛋白的表達,而高鹽飲食對正常大鼠的APJ表達無明顯影響。該研究結果提示PVN內的APJ受體表達上調可能參與了腦內鹽敏感性的形成。為進一步明確腦內APJ受體在鹽敏性高血壓形成中的作用,我們分別觀察了側腦室慢性灌流APJ受體拮抗劑ML221以及ENaC拮抗劑benzamil對外周交感神經活性的影響,結果發現ML221和benzamil均可降低高鹽引起的尿NE水平變化,并下調大鼠的HW/BW比值,表明腦內的APJ受體是壓力超負荷大鼠的鹽敏感性增加的關鍵調控分子。
Simchon等[9]研究發現,鹽敏感性高血壓大鼠靜脈給予4 μCi22NaCl后,腦脊液中的22Na+濃度是鹽抵抗性大鼠的5倍,表明鹽敏感性大鼠的血腦屏障的通透性是Dahl鹽抵抗性大鼠的5倍。PVN是自主性和內分泌性反應的重要整合中樞,且在維持心血管活動的動態平衡中起著關鍵作用。靠近中線處是小細胞性區域,靠近背側是大細胞性區域。小細胞性區域的一些神經元細胞與RVLM、NTS和脊髓交感神經節前神經元直接聯系,是交感神經活動調控的關鍵中樞[10]。已有研究發現,損毀Dahl鹽敏大鼠的PVN則能阻止高鹽誘發的高血壓的形成,表明PVN在鹽敏性高血壓形成中發揮關鍵作用[8]。本實驗使用微滲透泵在正常血壓大鼠的側腦室灌注高Na腦脊液后,PVN內APJ蛋白的表達明顯上調,同時大鼠的MAP、HR和尿NE水平均明顯增高,表明腦內APJ受體參與了鹽敏感性高血壓的交感神經異常活動的形成。
綜上,本研究發現高鹽可以增加壓力超負荷大鼠模型的交感神經活性,而該效應與腦內的APJ受體表達上調和Na+敏感性增加密切相關。APJ受體可能是腦內鹽敏感性形成的重要調控靶點。
[1] 羅 怡, 陳 明. 鹽敏感性高血壓研究進展[J].心血管病學進展, 2013, 34(5): 644-8.
[1] Luo Y, Chen M. Research process for salt-sensitive hypertension [J].AdvCardiovascDis, 2013, 34(5): 644-8.
[2] Fujita T.Mechanism of salt-sensitive hypertension: focus on adrenal and sympathetic nervous systems [J].JAmSocNephrol, 2014, 25(6):1148-55.
[3] Stocker S D, Monahan K D, Browning K N. Neurogenic and sympathoexcitatory actions of NaCl in hypertension [J].CurrHypertensRep, 2013, 15(6): 538-46.
[4] Yu X H, Tang Z B, Liu L J, et al. Apelin and its receptor APJ in cardiovascular diseases[J].ClinChimActa, 2014, 428(1): 1-8.
[5] 張 琪, 譚穎穎. 側腦室慢性灌流(pyr1)apelin-13對大鼠心血管功能的影響[J]. 中國藥理學通報, 2014, 30(1): 144-5.
[5] Zhang Q, Tan Y Y. Effect of chronic intracerebroventricular infusion of (pyr1) apelin-13 on cardiovascular regulatory actions [J].ChinPharmacolBull, 2014, 30(1):144-5.
[6] Zhang Q, Yao F, Raizada M K, et al. Apelin gene transfer into the rostral ventrolateral medulla induces chronic blood pressure elevation in normotensive rats [J].CircRes, 2009, 104(12):1421-8.
[7] 張 琪, 譚穎穎.血管緊張素1-7減弱醋酸去氧皮質酮鹽型高血壓大鼠的左心室重構 [J].中國藥理學通報, 2014, 30(7):994-9.
[7] Zhang Q, Tan Y Y. Angiotensin 1-7 attenuates left ventricular remodeling in deoxycorticosterone acetate salt hypertensive rats [J].ChinPharmacolBull, 2014, 30(7): 994-9.
[8] Gabor A, Leenen F H.Central neuromodulatory pathways regulating sympathetic activity in hypertension [J].JApplPhysiol, 2012, 113(8):1294-303.
[9] Simchon S, Manger W, Golanov E, et al. Handling22NaCl by the blood-brain barrier and kidney: its relevance to salt-induced hypertension in dahl rats [J].Hypertension, 1999, 33(1 Pt 2):517-23.
[10] Osborn J W, Olson D M, Guzman P, et al. The neurogenic phase of angiotensin II-salt hypertension is prevented by chronic intracerebroventricular administration of benzamil [J].PhysiolRep, 2014, 2(2):e00245.
Upregulation of brain APJ receptor expression induced by high salt in pressure overload rats
ZHANG Qi1, TAN Ying-ying2, LIU Dong-min2, ZHAO Xiao-ming1
(1.MedicalResearchCenter, 2.theFirstClinicalMedicalCollege,ShanxiUniversityofChineseMedicine,XianyangShanxi712046,China)
Aim To observe the effect of high salt stress on sympathetic nerve activity and brain Apelin and APJ system in pressure overload rats. Methods The suprarenal abdominal aorta was banded in male SD rats to create the pressure overload model. Four weeks later, the rats were fed a high-salt (8% NaCl) diet or a regular-salt (0.3% NaCl) diet for 1week, and the hemodynamic changes of the rats were recorded. Sympathetic activity was evaluated by measuring 24 h urinary norepinephrine (NE) by ELISA. Real-time RCR and Western blot method were used to analyze the Apelin and APJ expression in the paraventricular nucleus of rats. In another protocol, ML221 or benzamil was intracerebroventricularly infused in the aorta banding rats fed with high-salt, and levels of 24 h urinary NE and cardiac index were recorded. In addition, normal SD rats were intracerebroventricularly infused with Na+-rich aCSF for 1 week, and the changes of blood pressure, 24 h urine-NE and APJ expression levels were detected. Results In the pressure overload rats fed with high salt diet for 1 week, the mean arterial blood pressure (MAP), heart rate (HR), left ventricular end systolic pressure (LVESP), 24 h urinary NE and APJ mRNA protein expression in paraventricular nuclear were significantly increased compared with those in control groups (P<0.05). However, the hemodynamics, 24 h urinary NE and APJ expression showed no significant change in the sham rats fed a high salt diet. In addition, ICV infusion of APJ receptor antagonist ML221 or the ENaC antagonist benzamil significantly inhibited the 24 h urinary NE level and HW/BW ratio in the pressure overload rats fed high salt diet(P<0.01). Intracerebroventricular infusion of high Na+aCSF for 1 week in normotensive rats also significantly increased the MAP, HR, urinary-NE levels and brain APJ expression (P<0.01). Conclusions High salt increases the sympathetic nerve activity in rats with pressure overload model, which is closely related to the brain APJ receptor expression and Na+sensitivity. Brain APJ receptor may be an important target in the development of salt sensitivity.
Apelin; APJ; hypertension; sympathetic nerve; aorta banding; salt sensitivity
時間:2015-4-15 15:44 網絡出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150415.1545.010.html
2014-12-29,
2015-01-14
國家自然科學基金資助項目(No 31171101,81100175,81470543);教育部科學技術研究重點項目(No 212173);陜西省教育廳科學研究計劃項目(No 2013JK0819,2013JK0763)
張 琪(1977-),男,博士,副教授,研究方向:心血管藥理學,通訊作者,Tel:029-38183452,E-mail:zhangqimail@163.com
10.3969/j.issn.1001-1978.2015.05.009
A
1001-1978(2015)05-0630-06
R-332;R322.81;R392.11;R544.1;R543.1;R977.6