顳葉癲癇合并抑郁焦慮的臨床評估及聯合用藥分析
藍崧 張偉國
癲癇疾病主要是因為大腦神經元的異常放電,對中樞神經系統產生影響,導致其功能出現暫時性失常的慢性大腦疾病[1]。臨床治療中此類患者需要長期用藥,部分嚴重患者甚至需要終生服藥治療。此類疾病反復發作,治療周期長,對患者的生活質量產生影響,并對其心理造成不同程度的損害;大部分的癲癇患者均具有顯著的心理以及行為上的障礙,而此又是癲癇發作的誘因,對臨床治療效果具有直接的影響。癲癇合并抑郁焦慮發生的患者臨床主要表現為抑郁、偏執、焦慮、人格變化、強迫等,并具有較明顯的自卑感,自我評價低下伴嚴重的羞恥感,部分嚴重的患者甚至具有自殺傾向或是自殺行為等[2-3]。本文通過對45例癲癇合并抑郁焦慮的患者進行臨床評估,并根據用藥治療進行對照研究,取得較滿意療效,形成如下分析報告。
1 資料與方法
1.1 一般資料 選取2012年5月30日-2014年12月25日本院收集的45例癲癇合并抑郁焦慮患者作為本次研究對象,根據患者臨床用藥的不同將其分為治療組(23例)和對照組(22例),治療組男13例,女10例,年齡15~55歲,平均(37.5±6.1)歲,平均病程(10.8±2.7)年,HAMA評分平均(35.1±7.5)分,HAMD評分平均(78.2±7.3)分。對照組男10例,女12例,年齡16~58歲,平均(38.1±6.7)歲,平均病程(11.3±3.3)年,HAMA評分平均(36.2±8.3)分,HAMD評分平均(77.3±6.8)分。所有患者均行視頻腦電圖檢查結合臨床表現進行診斷,行MRI或顱腦CT檢查,通過簡易智能量表評估篩選,均符合顳葉癲癇合并抑郁焦慮的診斷。排除非顳葉癲癇、認知功能障礙、合并嚴重機體器質性疾病、精神分裂癥、器質性精神障礙等疾病患者[4]。兩組患者基線指標比較,差異無統計學意義,具有可比性。
1.2 臨床用藥方式 分別根據HAMA、HAMD量表內容設計問卷,對患者的焦慮、抑郁情況進行調查研究。完成臨床評估后,對照組患者接受常規抗癲癇藥物治療,給予卡馬西平片(得理多)(北京諾華制藥有限公司,國藥準字H11022278,0.2 g)或者是奧卡西平片(仁澳)(北京四環制藥有限公司,國藥準字H20051518,0.3 g)治療,卡馬西平初始劑量為1/2片/次,1~2次/d,治療1周后增加到1片/次,2次/d;根據治療情況逐漸加量,但最高不超過2片/次,2~3次/d。奧卡西平初始劑量為0.15 g/次,1次/d,治療1周后增加到0.15 g/次,2次/d;根據治療情況逐漸加量,但最高不超過2片/次,2次/d。治療組患者在對照組基礎上聯合草酸艾司西酞普蘭片(山東京衛制藥有限公司,國藥準字H20103548,20 mg)治療,劑量為20 mg/d,均在早餐后服用。兩組患者均持續用藥3個月,記錄為1個療程。
1.3 觀察指標 (1)采用漢密爾頓焦慮量表(HAMA)對患者焦慮情況進行評定,內容包含焦慮情緒、失眠、肌肉系統、認知功能以及感覺系統等14方面,每個方面均進行5個等級劃分,每個等級為0~4分,評分標準為:無癥狀0分;輕度1分;中度2分;重度3分,極重4分;總分為56分,得分越高焦慮情況越嚴重[5]。(2)漢密爾頓抑郁量表(HAMD)對患者抑郁情況進行評定,內容包含抑郁、入睡困難、罪惡感、工作和興趣、強迫以及自卑感等24方面,每個方面均進行5個等級劃分,每個等級為0~4分,評分標準為:無癥狀0分;輕度1分;中度2分;重度3分,極重4分;總分為96分,得分越高抑郁情況越嚴重[6]。(3)以兩組量表的減分率對臨床療效進行評價,分為4個等級,其中減分率在75%及以上為顯著進步;減分率50%~75%為進步;減分率25%~50%為稍有進步;減分率低于25%為無效[7]。總有效率=顯著進步率+進步率+稍有進步率。
1.4 統計學處理 本次兩組研究所得數據由專業記錄員交叉記錄,同一樣本進行3次重復性檢測(無離群檢驗),數據錄入Excel(2010版本)進行校正,導出數據采用SPSS 13.0進行分析,計量資料以(x-±s)形式錄入,實施t檢驗,計數時以“%”形式錄入,實施 字2檢驗,以α=0.05進行校正,當P<0.05時說明數據比較差異存在統計學意義。
2 結果
2.1 兩組患者療效比較 兩組患者臨床治療后主要不良反應為頭暈、嗜睡、心動過速、流涎、皮疹等,兩組治療總有效率和不良反應率比較,差異有統計學意義(P<0.05),見表1。
2.2 兩組患者治療前與治療3個月后焦慮抑郁改善情況比較 兩組患者治療后焦慮和抑郁情況均得到明顯緩解,但治療組患者改善情況更優,兩組比較差異有統計學意義(P<0.05),見表2。
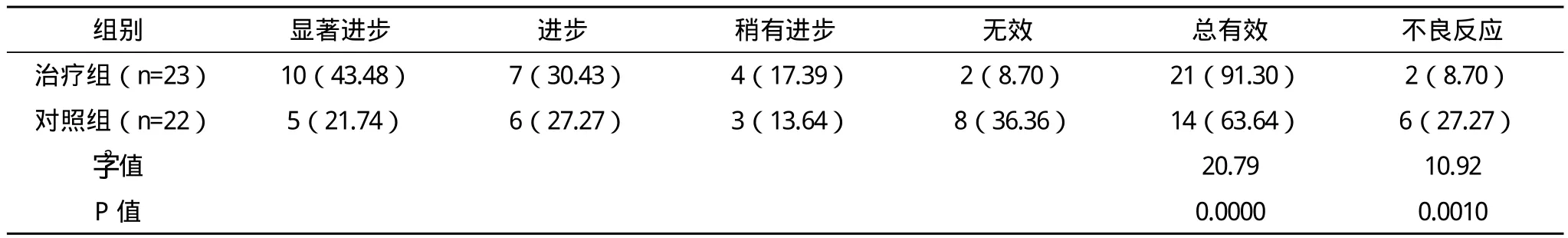
表1 兩組患者臨床治療情況比較 例(%)
3 討論
根據相關的流行病學調查研究顯示,顳葉癲癇病患者可控制發作率約為10%~20%,約有20%~60%的患者控制效果欠佳,且合并有抑郁障礙,發病率高于普通人群[8-9]。臨床大部分學者對抑郁焦慮逐漸發展成為癲癇的共患病的認可,并提出癲癇合并抑郁焦慮的發生是多種因素綜合作用的結果,包含長期的癲癇發作對大腦造成的損傷、遺傳因素、社會因素、心理因素等,主要臨床癥狀為患者在意識清醒的狀態下發生情緒低落、悲觀、抑郁、厭世、焦慮、自卑、自責、興趣減退等,且抑郁焦慮的程度與癲癇疾病史具有明顯的正性相關[10-11]。抑郁焦慮對顳葉癲癇病情及患者生活造成嚴重影響,因此臨床在抗癲癇時采取抗抑郁治療具有重要意義。
顳葉癲癇合并抑郁焦慮的發生已在臨床得到多方面證實,其發作與氨基酸類遞質關系密切,應激反應造成海馬體的萎縮、對神經再生和可塑性產生抑制也是發病的重要因素。臨床大量資料顯示,5-羥色胺以及去甲腎上腺功能低下是誘發抑郁焦慮的病理核心機制,也是臨床藥物抗抑郁治療的理論基礎[12]。相關學者對癲癇動物模型進行研究發現,上述神經遞質功能低下在癲癇病灶的建立過程中具有促進作用,進一步證實抑郁焦慮極易引發癲癇[13]。臨床治療中抗癲癇藥物通常是對癲癇樣放電作用產生抑制,以降低癲癇的發作。抗抑郁藥物與其聯合使用時存在相互作用的風險,部分藥物甚至會誘導癲癇的發作,加重患者大腦的損傷。臨床研究發現,新型的抗抑郁藥物與SSRIs類抗癲癇藥物療效優于傳統抗癲癇藥物[14]。本文中采用德里多(卡馬西平)以及奧卡西平與西酞普蘭聯合使用,取得滿意療效。治療組患者治療后總有效率為91.30%,明顯高于對照組的63.64%,不良反應發生率為8.70%,低于對照組的27.27%,與上述研究結果一致。且本文研究中治療組患者的焦慮及抑郁情緒在治療3個月后明顯改善,組間數據治療后比較,比較差異具有統計學意義(P<0.05),說明聯合用藥的療效及安全性較高。主要是因為西酞普蘭屬于新型5-HT再攝取抑制劑,具有較高的選擇性,對腎上腺素能受體、DI5受體、膽堿能受體以及組胺受體等具有極低的親和力甚至是無親和力,并且能夠通過多種肝藥酶進行同時代謝,不具有對肝藥酶誘導作用,蛋白的結合力也較低,與其他藥物不易發生作用,因此聯合用藥治療時安全可靠。西酞普蘭發揮抗癲癇作用時對其他神經遞質的影響低,不會抑制乙酰膽堿受體的作用,認知功能障礙及鎮靜的危險性小。臨床藥理實驗研究發現,西酞普蘭在所有SSRI藥物中對P450酶(肝臟細胞色素酶)的影響最低,同時與AEDs類藥物發生相互作用幾率低。證實其在顳葉癲癇并抑郁焦慮患者的應用中相對安全性較高。同時Krishnan等[15]研究發現西酞普蘭與血漿蛋白的結合高達80.0%,幾乎不會發生配伍禁忌,針對抗癲癇藥物使用已經到達血藥穩態的患者,西酞普蘭對其他藥物的血漿蛋白結合率及血藥濃度影響小,因此在聯合用藥中其具有明顯優勢。
綜上所述,顳葉癲癇合并抑郁焦慮的發生采用抗癲癇藥物聯合SSRIs類抗抑郁藥物治療的效果顯著,有效促進患者的預后,且不良反應率低,安全性高,具有較高的臨床使用價值。
[1]劉雪梅.心理護理輔助藥物治療癲癇患者的效果觀察[J].中國醫學創新,2012,37(35):60-61.
[2]單嶠,王世勛,李培棟,等.藥物難治性顳葉癲癇術后短期內復發對遠期療效的影響[J].中華神經醫學雜志,2014,13(7):699-702.
[3] Chwiej J, Kutorasinska J, Janeczko K, et al. Progress of elemental anomalies of hippocampal formation in the pilocarpine model of temporal lobe epilepsy-an X-ray fluorescence microscopy study[J].Analytical and Bioanalytical Chemistry,2012,404(10):3071-3080.
[4]尹清,樹海峰,劉宏亮,等.難治性顳葉癲癇腦組織IL-6、IL-6受體及sIL-6R、sgp130的表達及意義[J].中華神經醫學雜志,2012,11(6):605-608.
[5]田芳梅,陳紅,譚炯,等.102例顳葉癲癇灶切除及選擇性杏仁-海馬切除手術的護理配合[J].中國醫學創新,2012,9(35):79-80.
[6]武江,何利兵,李文玲,等.不同病理亞型FCD顳葉癲癇患者手術效果及預后比較[J].山東醫藥,2014,54(2):51-52.
[7] Blauwblomme T, David O, Minotti L, et al. Prognostic value of insular lobe involvement in temporal lobe epilepsy: a stereoelectroencephalographic study[J]. Epilepsia: Journal of the International League Against Epilepsy,2013,54(9):1658-1667.
[8]李萌,余勝坤,浦松,等.234例顳葉癲癇患者臨床資料分析[J].中華神經醫學雜志,2014,13(3):288-291.
[9]韓乃晉.內側顳葉癲癇腦缺省模式網絡改變的功能MRI分析[J].中國醫學創新,2012,9(17):75-76.
[10] Schiecke K, Wacker M, Piper, D, et al. Time-variant, frequencyselective, linear and nonlinear analysis of heart rate variability in children with temporal lobe epilepsy[J].IEEE Transactions on Biomedical Engineering,2014,61(6):1798-1808.
[11]許振強.癲癇所致精神障礙的臨床分析[J].中國醫學創新,2013,18(30):111-113.
[12]王廣新,馬衍輝,周榮雙,等.難治性癲癇患者腦內HIF-1α與多藥耐藥基因1表達的相關性及其意義[J].中國醫學創新,2014,24(6):3-5.
[13] Rui Quintas, Ana Sabela Alvarez, Eleni Koutsogeorgou, et al. The relationship between health-related quality-of life and disability in patients with controlled epilepsy a cross-sectional observational study[J]. American Journal of Physical Medicine and Rehabilitation,2012,91(2 Suppl):S31-S38.
[14]張建磊,王朝輝,李郭飛,等.咪達唑侖治療癲癇持續狀態的臨床研究[J].中國醫學創新,2014,13(26):1-3.
[15] Krishnan S, Xie S. Wavelet-based sparse functional linear model with applications to EEGs seizure detection and epilepsy diagnosis[J].Medical and Biological Engineering and Computing: Journal of the International Federation for Medical and Biological Engineering,2013,51(1/2):49-60.

